Важнейшие
химические производства.
Анализ важнейших химических производств, обоснование выбора условий и
типов реакционных узлов в них построены на основе положений теории химических
процессов и теории реакторов. По характеру образующихся продуктов
рассматриваемые производства подразделены на две группы: неорганические и
органические производства, причем объектами изучения являются многотоннажные
производства.
Технология
связанного азота.
Под связанным азотом понимают азот, находящийся в виде соединений с
другими элементами – аммиака, азотной кислоты, карбамида, аминов, аминокислот,
белков и т.д.
Азот является одним из 4-х элементов, без которых невозможно
существование живой материи. Вовлечение азота в геобиохимические циклы
осуществляется в природе путем его фиксации из атмосферы некоторыми почвенными
микроорганизмами. Тем не мене количество атмосферного азота, фиксируемого этими
микроорганизмами, не соответствуют потребностям современной цивилизации. В этой
связи перевод атмосферного азота в его соединения в промышленных масштабах
является глобальной практической задачей, решение которой нацелено на
производство азотных удобрений, восполняющих дефицит связанного азота в почве.
В настоящее время доминирующим методом фиксации атмосферного азота является
процесс соединения азота с водородом с получением аммиака.
Теоретические
основы синтеза аммиака, обоснования выбора параметров процесса.
Синтез аммиака протекает в соответствии со стехиометрическим уравнением
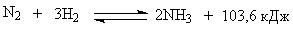 (1)
(1)
Эта реакция обратимая, экзотермическая и сопровождается уменьшением
объема. Реакция протекает на катализаторе – пористом железе с добавлением
стабилизирующих и промотирующих добавок (Al2O3,
K2O, CaO, SiO2 и др.). Он
активен и термически устойчив в области температур 650 – 830 К. Соединения серы
отравляют катализатор необратимо, а кислород и некоторые его соединения,
особенно СО – обратимо, но очень быстро и даже в ничтожно малых концентрациях.
Температура является фактором скорости процесса, однако с ростом
температуры равновесие реакции смещается в сторону реагентов. Это обусловливает
наличие оптимальной температуры процесса, обеспечивающей максимальную
производительность. На практике диапазон оптимальных температур составляет
400-500°С в зависимости от совокупности
других параметров.
Давление является одновременно и фактором скорости и фактором
смещения равновесия в сторону продуктов реакции. Особенно важна последняя
функция давления, т.к. благодаря повышению давления компенсируется негативное
действие температуры как фактора смещения равновесия в сторону исходных реагентов.
Высокое давление также благоприятствует конденсации аммиака на последующих
стадиях. Сверху давление ограничивается увеличением расходов на компримирование
и ускорением износа оборудования. Учет влияния всех противоборствующих факторов
обусловливает выбор оптимального значения давления. На практике работают при
давлениях 30 – 32 МПа.
Соотношение реагентов выбирают исходя из требований стехиометрии и
максимальной производительности, которая как раз соответствует
стехиометрическому соотношению.
Объемная скорость является фактором увеличения производительности
реактора, т.к. величина  , определяющая производительность,
возрастает – снижение конверсии исходной смеси в аммиак перекрывается ростом
объемной скорости W. Поскольку с ростом объемной
скорости газового потока возрастает объем непрореагировавших газов, которые необходимо
возвращать в цикл, то это приводит к увеличению энергозатрат на транспортировку
газов, их нагревание, охлаждение, увеличение размеров трубопроводов и
реакционной аппаратуры. Другим серьезным препятствием к увеличению объемной скорости
является нарушение автотермичности режима из-за снижения тепловыделений. На
практике работают с оптимальными значениями W » 40000 ч-1
которому соответствует степень превращения азота 27 – 28%.
, определяющая производительность,
возрастает – снижение конверсии исходной смеси в аммиак перекрывается ростом
объемной скорости W. Поскольку с ростом объемной
скорости газового потока возрастает объем непрореагировавших газов, которые необходимо
возвращать в цикл, то это приводит к увеличению энергозатрат на транспортировку
газов, их нагревание, охлаждение, увеличение размеров трубопроводов и
реакционной аппаратуры. Другим серьезным препятствием к увеличению объемной скорости
является нарушение автотермичности режима из-за снижения тепловыделений. На
практике работают с оптимальными значениями W » 40000 ч-1
которому соответствует степень превращения азота 27 – 28%.
Высокие объемные скорости в сочетании с соблюдением оптимального температурного
режима, применение азото-водородной смеси высокой степени чистоты и использованием
достаточно активных контактных масс должны обеспечить большую производительность
цехов синтеза аммиака при высоких экономических показателях процесса.
Сырье
для синтеза аммиака.
В качестве исходной смеси в процессе синтеза аммиака используется азото-водородная
смесь. Водород получают конверсией метана
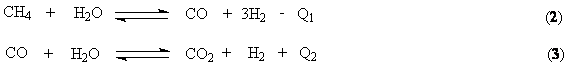
Обе реакции
протекают совместно, при этом в целях значительного связывания метана процесс
ведут при высоких температурах 1080-1100 К, обеспечивающих практическое
смещение равновесия (2) в правую сторону. Процесс ведут в трубчатом
реакторе, через межтрубное пространство которого циркулируют горячие топочные
газы, образующиеся при горении природного газа в факельных горелках,
расположенных в верхней части реактора. С целью форсирования процесса до
образования водорода и связывания СО (контактный яд) выходящий из реактора газ
поступает на 2-ю ступень конверсии в реактор адиабатического типа. Здесь для
поддержания необходимой температуры в реакционной зоне (1230 – 1280 К) в
реактор подается воздух. Необходимое тепло аккумулируется за счет частичного
сжигания природного газа.
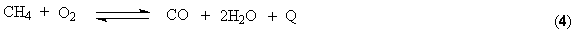
С другой
стороны, последняя реакция является источником образования необходимых для
реакции (2) и (3) водяных паров. Поскольку вместе с воздухом в
реактор подается азот, конвертор 2-ой ступени выполняет одновременно функцию
выделения азота из воздуха. Чтобы сформировать стехиометрическую смесь Н2
: N2 = 3 : 1 воздуха подается столько, сколько требует стехиометрия
процесса синтеза аммиака.
Конвертированный газ содержит СО2 (17 – 18 об.%) и СО (0,3 –
0,5 об. %). Первая примесь является балластом для синтеза аммиака. Многократный
рецикл азотоводородной смеси содержащий СО2 может привести к
прогрессирующему накоплению СО2 в рециркуляте. Это приведет к
снижению скорости реакции и смещению равновесия (1) в нежелательную левую
сторону. Вторая примесь, СО, является катализаторным ядом. В этой связи,
водород, поступающий на синтез, подлежит очистке от СО2 и СО. От
диоксида углерода освобождаются абсорбцией 19 – 21% раствором моноэтаноламина
(NH2CH2CH2OH).
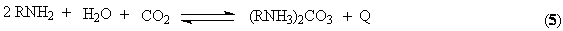
Абсорбцию ведут
при низких температурах обеспечивающих смещение равновесия (5) в сторону
продукта карбонизации. Полученный абсорбат подвергают десорбции при более высокой
температуре смещая равновесие (5) в левую сторону. Образующийся в
результате чистый СО2 является товарным продуктом и может
использоваться как реагент (синтез мочевины), хладоагент и растворитель для
извлечения ценных компонентов из лекарственных трав. Моноэтаноламин после
десорбции возвращается на процесс абсорбции.
СО крайне трудно извлечь количественно сорбционными методами. Поэтому очищенный
от СО2 водород подвергают метанизации, превращая СО в безвредный для
процесса метан. Газ после моноэтаноламинной очистки подогревают и направляют в
реактор, содержащий никелевый катализатор. На нем гидрируется СО и остатки СО2.
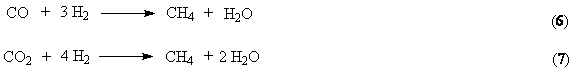
 Содержание СО
мало и адиабатический разогрев составляет несколько десятков градусов. Это
позволяет использовать однослойный реактор. В очищенном газе, поступающем на синтез
аммиака содержание СО не должно превышать 20×10-6
об. долей. Суммарное содержание метана в исходном газе составляет около 1 об.
%.
Содержание СО
мало и адиабатический разогрев составляет несколько десятков градусов. Это
позволяет использовать однослойный реактор. В очищенном газе, поступающем на синтез
аммиака содержание СО не должно превышать 20×10-6
об. долей. Суммарное содержание метана в исходном газе составляет около 1 об.
%.
Технология
процесса.
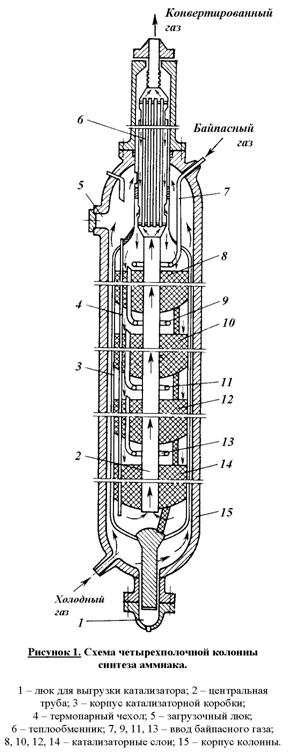
В качестве основного реакционного аппарата синтеза аммиака используется
многополочная колонна (рис. 1). Колонна представляет собой цилиндр высотой
около 30 м и диаметром примерно 2,5 м, выполненный из специальной стали,
способной выдерживать высокие давления, температуры и агрессивное воздействие
азота, водорода и аммиака. Холодный газ подается в нижнюю часть колонны и направляется
вверх между корпусом колонны (15) и корпусом катализаторной коробки (3).
В верхней части реактора холодный газ попадает в межтрубное пространство
теплообменника (6), в котором он нагревается до 400°С за счет теплоты выходящего из реактора по
трубам теплообменника газа синтеза. Подогретая азотно-водородная смесь проходит
последовательно четыре слоя катализатора (8, 10, 12 и 14) и
попадает в центральную трубу (2), по которой направляется к теплообменнику
(6). При этом газ охлаждается примерно до 330°С.
В связи с тем, что реакция синтеза аммиака экзотермична газ на
катализаторных полках сильно нагревается. При этом температура значительно
отклоняется от оптимальной. Для регулирования температурного режима
предусмотрена подача байпасного потока холодной азото-водородной смеси через
патрубки (7, 9, 11 и 13) в каждый слой катализатора.
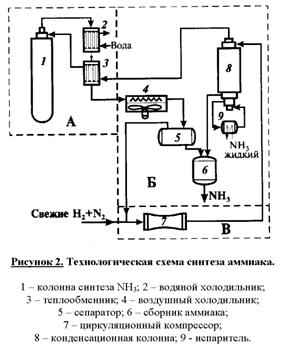 На рисунке 2 приведена сокращенная технологическая схема процесса.
Азотно-водородная смесь поступает в реактор 1. Нагретая за счет теплоты
экзотермической реакции реакционная смесь, выходящая из колонны синтеза,
охлаждается в трех теплообменниках. В первом из них (2) газ охлаждается
водой. В теплообменнике (3) нагревается газ, направляемый в реактор.
Окончательное охлаждение происходит в воздушном холодильнике (4). В
охлажденном газе частично конденсируется аммиак, и его отделяют в сепараторе (5).
Жидкий аммиак собирается в сборнике (6) как продукт. Охлаждения до температуры
окружающей среды недостаточно для полного выделения аммиака и газ из сеператора
направляется в конденсационную колонну (8). В ней газ охлаждается до
минус 2¸3°С, так, что в нем остается 3 – 5 об. % аммиака. Охлаждение осуществляют
за счет испарения жидкого аммиака в испарители (9). Испаритель может
быть совмещен с конденсационной колонной. В ней же жидкий аммиак отделяют от
газа и направляют в сборники.
На рисунке 2 приведена сокращенная технологическая схема процесса.
Азотно-водородная смесь поступает в реактор 1. Нагретая за счет теплоты
экзотермической реакции реакционная смесь, выходящая из колонны синтеза,
охлаждается в трех теплообменниках. В первом из них (2) газ охлаждается
водой. В теплообменнике (3) нагревается газ, направляемый в реактор.
Окончательное охлаждение происходит в воздушном холодильнике (4). В
охлажденном газе частично конденсируется аммиак, и его отделяют в сепараторе (5).
Жидкий аммиак собирается в сборнике (6) как продукт. Охлаждения до температуры
окружающей среды недостаточно для полного выделения аммиака и газ из сеператора
направляется в конденсационную колонну (8). В ней газ охлаждается до
минус 2¸3°С, так, что в нем остается 3 – 5 об. % аммиака. Охлаждение осуществляют
за счет испарения жидкого аммиака в испарители (9). Испаритель может
быть совмещен с конденсационной колонной. В ней же жидкий аммиак отделяют от
газа и направляют в сборники.
Холодный газ затем подогревают в теплообменнике (3) и возвращают в
колонну синтеза (1). Обеспечивают циркуляцию потока компрессором (7).
Перед ним в циркуляционный реакционный газ добавляют свежую азото-водородную
смесь.
При многократной рециклизации азото-водородной смеси происходит
накопление инертов (Ar и CH4) в рециркуляционном газе, поэтому на
линии рециркулирующего газа предусмотрена отдувка (вывод) части газа из
рецикла. Эти газы можно использовать в качестве топлива или восстановительных
агентов для обезвреживания выбросов , содержащих оксиды азота.
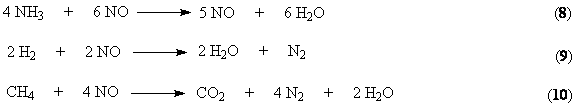
Основные
направления в развитии производства аммиака.
1.
Кооперирование азотной промышленности с промышленностью основного органического
синтеза на базе использования природного газа и газов нефтепереработки в
качестве сырья;
2.
Укрупнение всего производства в целом, и отдельных его подсистем;
3.
Разработка процессов на основе более активных каталитических систем и
снижения за счет этого давления в процессе;
4.
Применение колонн синтеза с «кипящем слоем» катализатора;
5.
Дальнейшее совершенствование систем рационального использования тепла.
Для последней проблемы можно использовать энерготехнологическую систему в
производстве аммиака. Сжатие вначале природного газа на стадии конверсии до 4,5
МПа, а затем азото-водородной смеси до 30 – 32 МПа, ее циркуляция в подсистеме
синтеза осуществляется помощью мощных турбокомпрессоров. Кроме того, в
энергетической системе имеется еще ряд линий. Общее потребление энергии
составляет 880 – 900 кВт×ч/т (NH3).
Ключевым является компрессор азото-водородной смеси с частотой вращения около
11000 об./мин, потребляющий более половины энергии всего производства аммиака.
Применение для привода этого компрессора электродвигателя практически
невозможно. Поэтому для этой цели используется энергоноситель – пар с высокими
параметрами: давлением до 10 МПа и температурой 720 – 740 К. Для привода других
компрессоров используют также паровые турбины на энергоносителях с меньшими
параметрами. В производстве аммиака используется высокопотенциальные
технологические потоки: конвертированный газ и дымовые газы после конверсии
метана. Но их энергии и потенциала недостаточно для образования пара с высокими
параметрами. Необходим дополнительный высокотемпературный источник энергии. Им
является вспомогательный котел с огневым обогревом, установленный в газоходе
после трубчатой печи. Пар, получаемый в котлах, утилизаторах, в линиях
технологических потоков и в дополнительном котле, собирается в паросборнике и
оттуда распределяется на паровые турбины-приводы компрессоров. Т.о. производство
аммиака становится автономным по энергетическому пару, но для его выработки
используется свои вторичные энергетические ресурсы, потребляя также дополнительные
количества топлива – природный газ.