Производство
серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная
кислота по объему производства и потребления занимает первое место. Объясняется
это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и
ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает
черные металлы, в то же время является одной из сильных кислот, в широком
диапазоне температур
(– 40… – 20 260 – 336,5°С)
находится в жидком состоянии.
Безводная серная кислота (моногидрат) представляет собой тяжелую
маслянистую жидкость, которая смешивается с водой с выделением большого
количества теплоты. Плотность H2SO4 при 0°С равна 1,85 г/см3, а температура
кристаллизации 10,7°С.
Крупнейшими потребителями серной кислоты являются производства минеральных
удобрений: суперфосфата, сульфата аммония.
Многие кислоты (фосфорная, уксусная, соляная, концентрированная азотная и
др.) и соли производятся в значительной части при помощи серной кислоты.
Серная кислота широко применяется в производстве цветных и редких
металлов, а также в металлообрабатывающей промышленности. Получение ряда
красителей (для тканей), лаков и красок (для зданий и машин) лекарственных
веществ и некоторых пластмасс также связано с применением серной кислоты. При
помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры,
ПАВ, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными
травами.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной,
а также в других отраслях легкой промышленности. В пищевой промышленности
серная кислота применяется для получения крахмала, патоки и ряда других
продуктов. В электротехнике она используется в качестве электролита в аккумуляторах.
Серную кислоту используют для осушки газов и при концентрации кислот. Наконец,
серную кислоту применяют как компонент реакционной среды в процессах
нитрования, в частности, при получении взрывчатых веществ.
При нитровании, в производстве этилового спирта из этилена, при концентрировании
азотной кислоты и в других процессах применяют серную кислоту концентрацией от
92 до 98%, а выводят из процесса разбавленную 50 – 80%-ную кислоту. Чтобы
возвратить ее в новый цикл, полученные водные растворы упаривают.
Сырьевая база производства серной кислоты – серосодержащие
соединения, из которых можно получить диоксид серы. В промышленности около 80%
серной кислоты получают из природной серы и железного (серного) колчедана.
Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии.
Некоторые производства используют в качестве сырья сероводород, образующийся
при очистке серы в нефтепереработке. Первый обжиг серосодержащего сырья для
получения диоксида серы.
Производство серной кислоты включает в себя следующую последовательность
стадий:
Обжиг серного колчедана или серы.

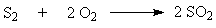
Окисление диоксида серы.
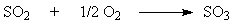
Абсорбция триоксида серы.
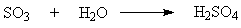
Исходные вещества – минеральное сырье – содержит примеси, поэтому
выходящие со стадии обжига газы подвергаются очистке. Первая стадия – обжиг,
специфичен для каждого вида сырья, и далее она будет рассматриваться для
колчедана и серы как наиболее распространенных исходных веществ. Стадии окисления
и абсорбции в основном одинаковы в разных способах получения серной кислоты.
Поэтому эти стадии будут рассмотрены как типовые процессы.
Обжиг
серосодержащего сырья.
Обжиг колчедана (пирита) является сложным физико-химическим процессом и включает
в себя ряд последовательно или параллельно протекающих реакций:
|
Термическая диссоциация
|
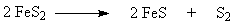
|
|
Газофазное горение серы
|
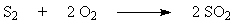
|
|
Горение пирротина
|

|
|
Или суммарно:
|

|
При небольшом избытке или недостатке кислорода образуется смешанный оксид
железа

Обоснование
роли параметров и их выбор.
Температура. Термическое разложение пирита начинается уже при
температурах около 200°С и одновременно воспламеняется сера. При температурах
выше 680°С
интенсивно протекают все три реакции.
В промышленности обжиг ведут при 850 – 900°С, когда общая скорость
процесса лимитируется массопереносом окислителя (кислорода) к поверхности
пирита и продуктов разложения в газовую фазу. В общем виде движущая сила этого
процесса может быть выражена уравнением
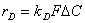 (1)
(1)
Из этого
уравнения видно, что факторами увеличения производительности процесса являются
интенсификация массопереноса (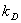 ), увеличение поверхности контакта фаз (F) и концентрации реагентов. Коэффициент массопереноса может быть
увеличен повышением температуры, поверхность контакта фаз существенно
возрастает с увеличением степени дисперсности твердого материала, а высокие
концентрации реагентов обеспечиваются использованием обогащенного пирита и
увеличением содержания кислорода в окислителе. Следует, однако, иметь в виду,
что чрезмерное повышение температуры способствует размягчению и слипанию частиц
твердого сырья, а применение концентрированных реагентов удорожает их стоимость
и приводит к чрезмерному росту температуры в условиях автотермического режима.
Это обусловливает выбор оптимальной температуры, сочетающей достаточную
производительность процесса и использование сырья с соответствующим содержанием
активных компонентов при минимуме процессов агломерации твердого материала. На
практике процесс проводят при температуре 850 – 900°С.
), увеличение поверхности контакта фаз (F) и концентрации реагентов. Коэффициент массопереноса может быть
увеличен повышением температуры, поверхность контакта фаз существенно
возрастает с увеличением степени дисперсности твердого материала, а высокие
концентрации реагентов обеспечиваются использованием обогащенного пирита и
увеличением содержания кислорода в окислителе. Следует, однако, иметь в виду,
что чрезмерное повышение температуры способствует размягчению и слипанию частиц
твердого сырья, а применение концентрированных реагентов удорожает их стоимость
и приводит к чрезмерному росту температуры в условиях автотермического режима.
Это обусловливает выбор оптимальной температуры, сочетающей достаточную
производительность процесса и использование сырья с соответствующим содержанием
активных компонентов при минимуме процессов агломерации твердого материала. На
практике процесс проводят при температуре 850 – 900°С.
Давление. В соответствии с уравнением (1) давление является фактором скорости процесса, однако его рост
может привести в условиях автотермического режима к чрезмерному увеличению
температуры и слипанию частиц твердого материала. Кроме того, увеличение
давления приводит к увеличению расходов на компремирование. Поскольку реакция
обжига в условиях указанных температур протекает достаточно гладко, то предпочитают
работать при атмосферном давлении.
Соотношение воздух-колчедан поддерживается на уровне,
обеспечивающем избыток кислорода по сравнению с его стехиометрическим
количеством, с целью достижения высоких степеней обжига, однако этот избыток не
должен быть чрезмерным, т.к. при значительных избытках рост степени извлечения
серы из колчедана перекрывается значительным разбавлением газов обжига и понижением
концентрации SO2 в них, что отрицательно влияет на последующий
процесс окисления SO2 в SO3.
Ранее доминирующим типом реактора был многополочный реактор, снабженный
скребками для выравнивания слоя на каждой полке и организации транспорта
твердой фазы с верхних полок на нижние (см. типы реакторов для гетерогенных
реакций с участием твердой фазы).
В таком реакторе степень дисперсности колчедана невелика, что существенно
ограничивает производительность реактора. Кроме того, в таком реакторе
движущиеся скребки в высокотемпературной зоне усложняют его конструкцию,
создается неоднородный температурный режим по полкам, в нем трудно организовать
отвод тепла из зоны реакции. Трудности теплосъема не позволяют получить
обжиговый газ с концентрацией SO2 более 8 – 9%. Основное ограничение
– невозможность использования мелких частиц, в то время как для гетерогенного
процесса основной способ ускорения реакции – дробление частиц. По этой причине
более перспективными являются аппараты к «кипящем слоем» твердых частиц. Их
степень дисперсности позволяет на порядок ускорить процесс.
Пылевидный колчедан подается через питатель в реактор. Окислитель
(воздух) подается снизу через распределительную решетку со скоростью,
достаточной для взвешивания твердых частиц. Их витание в слое предотвращает
слипание и способствует хорошему контакту с газом, выравнивает температурный
режим по всему слою, обеспечивает подвижность твердого материала и его переток в
выходной патрубок для вывода огарка из реактора. В слое подвижных частиц можно
расположить теплообменные элементы. Благодаря увеличению глубины обжига
содержание SO2 в обжиговом газе увеличивается до 13 – 15%. Основной
недостаток печей кипящего слоя – повышенная запыленность обжигового газа из-за
механической эрозии подвижных твердых частиц. Это требует более тщательной
очистки газа от пыли в циклоне и электрофильтре.
Сжигание серы.
Сера – легкоплавкое вещество: температура ее плавления 113°С.
Перед сжиганием ее расплавляют, используя пар, полученный при утилизации тепла
ее сжигания. Расплавленная сера отстаивается и фильтруется для удаления
имеющихся в природной сере примесей и насосом подается в печь сжигания. Сера
горит в основном в парофазном состоянии. Чтобы обеспечить ее быстрое испарение,
необходимо ее диспергировать в потоке воздух. Для этого используют форсуночные
и циклонные печи. Первые оборудованы горизонтальными форсунками для тонкого
распыления жидкости. В циклонной печи жидкая сера и воздух подаются тангенциально
и за счет вихревого движения достигается диспергирование жидкости и
перемешивание двух потоков. Мелкие капли быстро испаряются и сера в
парообразном состоянии сгорает. Горение протекает адиабатически, и температура
зависит от концентрации образующегося SO2.
За счет высокой теплоты сгорания серы температура в печи составляет более
1000°С.
Этих условий достаточно для испарения жидкой серы. Печь сжигания работает в
комплексе с вспомогательным оборудованием для плавления и фильтрования серы и
котлом-утилизатором для использования тепла реакции.
Газы обжига колчедана содержат в виде примесей соединения фосфора,
селена, теллура, мышьяка и некоторые другие, образующиеся из примесей сырья.
Естественная влага сырья также переходит в газ. При горении образуются
некоторое количество SO3 и возможно оксиды азота. Эти примеси
приводят или к коррозии аппаратуры или к отравлению катализатора, а также
ухудшают качество серной кислоты. Их удаляют в промывном отделении. Согласно
схеме газ последовательно проходит две промывные башни, орошаемые растворами
серной кислоты (60 и 20%-ой). В первой башне обжиговый газ охлаждается с 300 –
500°С
до 60 – 70°С
и освобождается от остатков пыли и части примесей. Эта башня полая.
Обеспыленный газ отмывается 15 – 20%-ой серной кислотой от соединений As, Fe,
Se во второй башне с насадкой. Окончательная осушка от влаги осуществляется в 3
– 9 башнях (сушильной), орошаемых концентрированной серной кислотой.
Окисление
диоксида серы.
Реакция

является
обратимой и экзотермической и протекает
с уменьшением объема. Она осуществляется на катализаторах, основой которых
является V2O5 с добавлением
оксидов щелочных металлов, нанесенных на оксид кремния.
Обоснование
роли параметров и их выбор.
Температура проходит максимум производительности, характерный для
обратимых экзотермических реакций. Следует иметь в виду, что чрезмерное
увеличение температуры может привести к диффузионному торможению процесса и это
может повлиять на положение экстремума производительности и его величину.
В значительной степени выбор температуры определяется верхним и нижним пределом
этого параметра. При Т<400 0C активность катализаторов весьма мала, а выше 600 0С
происходит их термическая дезактивация. Оптимальными являются температуры, лежащие
внутри этих пределов.
Давление является фактором скорости процесса и фактором смещения
равновесия, однако на практике исходя из соображений экономии энергозатрат, а
также благодаря возможности достичь высокой производите и степени превращения
за счет использования других факторов предпочитают работать при давлениях,
близких к атмосферному. Некоторое избыточное давление необходимо для
преодоления гидравлических сопротивлений установки при организации транспортных
потоков реагентов.
Соотношение O2:SO2. является
фактором смещения равновесия, а также фактором скорости процесса в соответствии
с уравнением Борескова
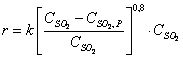 (2)
(2)
Однако сверху это соотношение ограничивается замедлением роста скорости
при высоких 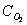 и значительным снижением содержания SO2 в контактных газах,
поступающих на абсорбцию, что снижает эффективность последней. На практике
используют избыток О2 более чем полтора по отношению к стехиометрическому.
и значительным снижением содержания SO2 в контактных газах,
поступающих на абсорбцию, что снижает эффективность последней. На практике
используют избыток О2 более чем полтора по отношению к стехиометрическому.
Время контакта выбирается, исходя из максимально достижимой
конверсии. Пределом такой конверсии является максимальная степень превращения,
при которой скорость процесса близка к нулю. Поэтому за время реакции
выбирается то минимальное время, при котором степень конверсии практически
близка равновесной. Обычно эта величина равна 90-95 %, а соответствующее ей
время – несколько секунд.
Технология
контактного окисления SO2.
Чаще всего в промышленности используют полочные аппараты со съемом тепла
реакции между полками. Схема теплообменника предполагает максимальное использование
тепла реакции для подогрева исходного газа. При этом съем тепла между полками
осуществляют в той мере, которая позволяет приближать рабочую температуру к оптимальному
значению этого параметра.
Одна из важнейших задач производства серной кислоты состоит в увеличении
степени превращения диоксида серы и снижения его выбросов в атмосферу. Эта
задача может быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи – метод
двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в
том, что реакционную смесь, в которой степень превращения SO2 составляет
90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3;
в оставшемся реакционном газе соотношение O2 : SO2
существенно повышается, что приводит к смещению равновесия реакции вправо.
Вновь нагретый реакционный газ опять подают в контактный аппарат, где на
достигается 95% степень превращения оставшегося SO2. Суммарная
степень превращения SO2 в таком процессе достигает
99,5 – 99,8%.
Абсорбция
триоксида серы.
Абсорбция триоксида серы – последняя стадия процесса на которой
образуется серная кислота. Взаимодействие SO3 с водой
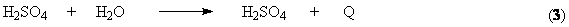
 протекает
достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять
в себе SO3, образуя олеум. Этот продукт удобен для транспортировки,
поскольку он не вызывает коррозии даже обычных сталей. В то же время растворы
серной кислоты чрезвычайно агрессивны.
протекает
достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять
в себе SO3, образуя олеум. Этот продукт удобен для транспортировки,
поскольку он не вызывает коррозии даже обычных сталей. В то же время растворы
серной кислоты чрезвычайно агрессивны.
Равновесие «газ-жидкость» для «H2O-H2SO4-SO3» представлено
на рисунке 1. Особенностью этой системы является то, что в широком интервале
концентраций раствора серной кислоты в паровой фазе присутствуют чистые пары воды,
а над олеумом – в газовой фазе преобладает SO3. Одинаковый состав жидкой и паровой фаз (азеотропная
точка) будет при концентрации серной кислоты 98,3%. Если SO3 поглощать раствором с
меньшей концентрацией, то реакция (3)
будет протекать и в паровой фазе – будет образовываться туман серной кислоты,
который уйдет из абсорбера с газовой фазой. А это – и потери продукта, и
коррозия аппаратуры, и выбросы в атмосферу. Если SO3 абсорбировать олеумом, то
поглощение будет неполным.
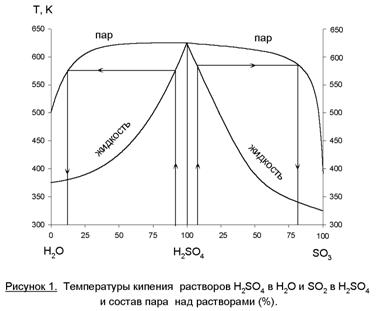
Из этих двух свойств следует двухстадийная схема абсорбции (рисунок 2).
Газ, содержащий SO3 после реактора проходит последовательно олеумый
(1) и моногидратный (2) абсорберы. Другой компонент реакции
(H2O) подается противотоком
через сборник в моногидратный абсорбер. За счет интенсивной циркуляции жидкости
(абсорбата) в ней можно поддерживать близкую к оптимальной концентрацию H2SO4 – 98,3% (увеличение
 концентрации
за проход жидкости не более 1 – 1,5%). Концентрационные условия абсорбции
обеспечиваю полное поглощение SO3 и минимальное образование
сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный.
В нем циркулирует 20% раствор Н2SO4, который частично отбирается
как конечный продукт – олеум. Кислота из предыдущего абсорбера – моногидрат –
также может быть продуктом. В системе циркуляции предусмотрены холодильники для
съема тепла реакции и обеспечения более эффективной абсорбции. При температурах
меньше 100°С
SO3 поглощается практически полностью, диоксид серы – практически не
поглощается.
концентрации
за проход жидкости не более 1 – 1,5%). Концентрационные условия абсорбции
обеспечиваю полное поглощение SO3 и минимальное образование
сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный.
В нем циркулирует 20% раствор Н2SO4, который частично отбирается
как конечный продукт – олеум. Кислота из предыдущего абсорбера – моногидрат –
также может быть продуктом. В системе циркуляции предусмотрены холодильники для
съема тепла реакции и обеспечения более эффективной абсорбции. При температурах
меньше 100°С
SO3 поглощается практически полностью, диоксид серы – практически не
поглощается.
Перспективы
развития сернокислотных производств.
Мощным средством повышения производительности сернокислотных производств
является увеличение концентрации диоксида серы. Высококонцентрированные газы, содержащие
до 80% SO2 уже начали получать в производствах цветных металлов из
их сульфидных руд с применением технического кислорода.
Получение высококонцентрированного сернистого газа позволяет создать
энерготехнологические циклические производства серной кислоты из серы и
колчедана. Диоксид серы полученный с применением технического кислорода
окисляют на 90% в контактном аппарате с «кипящем слоем» катализатора. При абсорбции
SO3 получают высококонцентрированный олеум и моногидрат. Газ после
абсорбции возвращают на контактирование. В реакторе общая степень превращения
составляет 99,995%. Для отвода накапливающегося в результате многократного
рецикла азота часть газа после абсорбции пропускают через малогабаритную
сернокислотную установку, из которой азот выбрасывается в атмосферу.
Интенсивность работы циклической системы, работающей под давлением около 1 МПа,
с применением кислорода в десятки раз превышает интенсивность обычных систем.
Потери серы с отходящими газами и соответственно выбросы SO2 и SO3
в окружающую среду также снижены в десятки раз.
Схемы предусматривают генерирование водяного пара (4 МПа) за счет тепла
газов обжига, который может быть использован как в самой установке для
компенсации затрат энергии на работу компрессоров и насосов, так и в других
цехах завода. Тепло сернистых газов после прохождения очередного
каталитического слоя можно использовать для предварительного подогрева
реагентов на входе в контактный аппарат. Тепло сорбции используется для бытовых
нужд.
Важнейшими направлениями развития производства серной кислоты являются:
1.
Увеличение мощности аппаратуры при одновременной
комплексной автоматизации производства.
2.
Интенсификация процессов путем применения реакторов
«кипящего слоя» (как на стадии обжига, так и при контактном окислении SO2),
более активных катализаторов, повышенных давлений и использование технического
кислорода в процессе окисления.
3.
Разработка энерготехнологических схем с максимальным
использованием теплоты экзотермических реакций, в том числе циклических систем
под давлением.
4.
Увеличение степеней превращения на всех стадиях
производства для снижения расходных коэффициентов по сырью и материалам и
снижение вредных выбросов.
5.
Утилизация вредных выбросов из отходящих газов, а также
твердых отходов (огарок). Например, нежелательные вредные примеси H2S
и SO2 из разных потоков можно объединить и подвергнуть
концентрированию с целью перевода их в элементарную серу.

Твердый огарок, содержащий оксид железа можно использовать в качестве сорбента
для улавливания газов и очистки сточных вод.