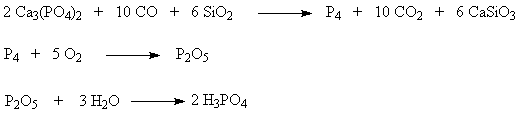Производство
фосфорной кислоты.
Фосфорная кислота H3PO4 является
важнейшим промежуточным продуктом в производстве концентрированных
фосфоросодержащих удобрений. Кроме того, фосфорная кислота используется в
производстве различных технических солей, фосфорорганических соединений, в том
числе инсектицидов, полупроводников, ионообменных смол, а также для создания
защитных покрытий на металлах. Очищенная или так называемая пищевая фосфорная
кислота используется в пищевой промышленности, для приготовления кормовых
концентратов и фармацевтических препаратов.
Сырьё для производства фосфорной кислоты – см. сырьевая основа химической
промышленности (лекция 1).
Фосфор извлекают из фосфатных руд их разложением. В настоящее время наибольшее
распространение получило кислотное разложение руд, содержащих более 25 % Р2О5.
Фосфорная кислота образуется непосредственно при растворении руды, т.е. прямым
извлечением соединений фосфора экстракцией. Отсюда название продукта -
экстракционная фосфорная кислота (ЭФК). Из более бедных руд получают
термическую фосфорную кислоту. Процесс основан на восстановлении фосфора из
природных фосфатов коксом при высоких температурах и дальнейшем получении Н3РО4
из фосфора.
Функциональная
схема производства ЭФК.
Сложность состава исходного сырья, которое не может быть унифицировано,
приводит к существованию ряда вариантов технологических схем его переработки.
Одним из хорошо исследованных является сернокислотное разложение апатитового
концентрата, получаемого обогащением хибинской апатито-нефелиновой руды и
содержащего около 39% Р2О5. Его разложение – гетерогенная
реакция “жидкость – твердое тело”.
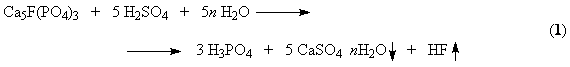
Выделение примесей облегчается переходом их в другую фазу. Кальциевая
составляющая выпадает в осадок в виде гипса (CaSO4), вторая уходит в газовую фазу в виде
фтороводорода HF. Функциональная
схема производства ЭФК (рис. 1) включает разложение измельченного сырья в
реакторе (экстракторе), фильтрацию твердого осадка, упаривание фосфорной
кислоты до товарной концентрации и очистку отходящих газов. Твердый отход
получил название “фосфогипс”. Образующийся фтороводород взаимодействует с
пустой породой сырья
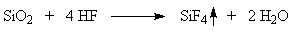
Поэтому при промывке отходящих
газов водой оба летучих продукта улавливаются в виде кремнефтористоводородной
кислоты H2SiF4.
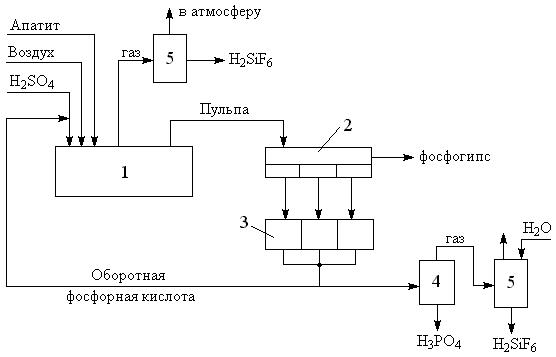
Рисунок. 1.
Функциональная схема производства экстракционной фосфорной кислоты.
1 – реактор разложения апатита (экстрактор); 2 –
вакуум фильтр; 3 – сборник фильтратов;
4 – колона выпарки фосфорной кислоты; 5 – система
очистки газов.
Сернокислотное
разложение апатита.
На скорость превращения апатита по реакции (1) влияет отвод продуктов
реакции – ионов Са2+ и 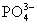 от поверхности частиц
в раствор, и чем меньше концентрация Са2+ в растворе, тем скорость
растворения будет больше.
от поверхности частиц
в раствор, и чем меньше концентрация Са2+ в растворе, тем скорость
растворения будет больше.
Одновременно с растворением апатита происходит образование твердого CaSO4, который
плохо растворим. Связывание Са2+ в CaSO4 должно увеличивать
скорость растворения апатита. Казалось бы, увеличение концентрации серной
кислоты, т.е. ионов 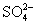 - фактор
благоприятный. Но
- фактор
благоприятный. Но 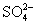 вызывают не только
осаждение Са2+ в виде отдельной фазы в растворе, но и на поверхности
частиц апатита. Образующаяся корка CaSO4 сначала замедляет растворение, а затем блокирует
поверхность, и растворение практически прекращается. Поэтому есть некоторая
оптимальная концентрация CaSO4,
при которой степень извлечения фосфора из сырья будет максимальной. Таким
образом, к концентрации Н2SO4 в реакторе предъявляются жесткие требования:
строгое поддержание этой концентрации на оптимальном уровне во всем объеме
реакционной зоны.
вызывают не только
осаждение Са2+ в виде отдельной фазы в растворе, но и на поверхности
частиц апатита. Образующаяся корка CaSO4 сначала замедляет растворение, а затем блокирует
поверхность, и растворение практически прекращается. Поэтому есть некоторая
оптимальная концентрация CaSO4,
при которой степень извлечения фосфора из сырья будет максимальной. Таким
образом, к концентрации Н2SO4 в реакторе предъявляются жесткие требования:
строгое поддержание этой концентрации на оптимальном уровне во всем объеме
реакционной зоны.
Реакционный узел представляет собой последовательность секций с
интенсивным перемешиванием реагентов в каждой из них и перетоком между ними для
организации движения реакционной массы по каскаду. Перемешивание должно
предотвратить расслоение на твердую и жидкую фазы. В первых секциях происходит
в основном растворение апатита. Остальные секции работают как дозреватели, в
них формируются кристаллы CaSO4.
Между последней и первой секциями организован интенсивный рецикл (при кратности
циркуляции 20 и более).
Его назначение:
§
устранить локальное пересыщение в зоне ввода
реагентов;
§
подать в первую секцию кристаллы CaSO4 как центры
кристаллизации, облегчающие связывание Ca2+ в самом начале растворения;
§
создать однородные условия в секциях для
растворения сырья и роста кристаллов.
Чтобы создать благоприятные условия сначала для растворения, когда
необходимо иметь балансовую концентрацию 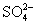 , а затем для формирования кристаллов при небольшом избытке
, а затем для формирования кристаллов при небольшом избытке 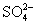 организуют распределенную
подачу серной кислоты в одну из первых и в одну из последних секций каскада.
Степень разложения апатита достигает 97 % и выше, образуются крупные кристаллы,
облегчающие их отделение фильтрацией.
организуют распределенную
подачу серной кислоты в одну из первых и в одну из последних секций каскада.
Степень разложения апатита достигает 97 % и выше, образуются крупные кристаллы,
облегчающие их отделение фильтрацией.
Образование продукционной фосфорной кислоты включает в себя
отделение осадка CaSO4
(фосфогипса) и концентрирование кислоты. В зависимости от условий разложения
образуются кристаллы CaSO4×2Н2О
(дигидрат) или CaSO4×0,5Н2О
(полугидрат). В дигидратном процессе температура 343-353 К и концентрация
фосфорной кислоты 25-35 %. В полугидратном процессе эти показатели составляют
358-378 К и 35 мас. %. Фосфогипс отделяют на вакуум-фильтре. Фильтрат
направляют на выпаривание, где концентрация кислоты увеличивается до 52-54 %.
Это и есть продукционная кислота. При выпаривании из кислоты удаляется 80-90 %
фтора в виде HF.
Отходящие из реактора и из узла выпаривания фторсодержащие газы в системах
очистки поглощаются с образованием кремнефтористоводородной кислоты.
На одну тонну продукта образуется более 2,5 т трудно перерабатываемого CaSO4. C ним
теряется серная кислота, ее эффективная промышленная регенерация из фосфогипса
до сих пор не разработана. Фосфогипс используется для производства гипсовых вяжущих
добавок к цементу, строительных изделий, в сельском хозяйстве для гипсования солончаковых
почв. Большая часть фосфогипса складируется в отвалы.
Экстракционная кислота используется для получения фосфорных удобрений.
Для других целей используется концентрированная фосфорная кислота, которую
получают электротермическим методом. Он основан на восстановлении фосфора из
фосфатов в электродуговых печах с последующим окислением элементарного
парообразного фосфора (Р4) до его оксида