Производство
минеральных удобрений.
Минеральные удобрения являются одним из важнейших для хозяйственной деятельности
человека видов продукции химической промышленности.
Рост численности населения выдвигает перед всеми странами одну и ту же проблему
– умелое управление способностью природы воспроизводить жизненные ресурсы и
прежде всего продовольственные. Задача расширенного воспроизводства продуктов
питания уже давно решается путем применения в сельском хозяйстве минеральных
удобрений.
Классификация
минеральных удобрений.
Минеральные удобрения классифицируют по трем главным признакам - агрохимическому
назначению, составу и свойствам.
По агрохимическому назначению удобрения подразделяют на прямые,
являющиеся источником питательных элементов для растений, и косвенные,
служащие для мобилизации питательных веществ почвы путем улучшения ее
физических, химических и биологических свойств. К косвенным удобрениям
относятся, например, известковые удобрения, применяемые для нейтрализации
кислых почв, структурообразующие удобрения, способствующие агрегированию частиц
тяжелых и суглинистых почв и др.
Прямые минеральные удобрения могут содержать один или несколько разных питательных
элементов. По количеству питательных элементов удобрения подразделяют на простые
(односторонние) и комплексные.
В простые удобрения входит только один из трех главных питательных
элементов: азот, фосфор или калий. Соответственно, простые удобрения делят на азотные,
фосфорные и калийные.
Комплексные удобрения содержат два или три главных питательных элемента.
По числу главных питательных элементов комплексные удобрения подразделяют на двойные
(например, типа NP или РК) и тройные (NPK). Последние называют также полными.
Удобрения, содержащие значительные количества питательных элементов и мало балластных
веществ называют концентрированными.
Комплексные удобрения, кроме того, подразделяют на смешанные и сложные.
Смешанными называют механические смеси удобрений, состоящие из разнородных частиц.
Если же удобрение представляет собой сложные соединения, являющиеся результатом
химического взаимодействия, то они относятся к сложным.
Удобрения, предназначенные для питания растений элементами,
стимулирующими их рост и требующиеся в малых количествах, называются микроудобрениями,
а содержащиеся в них питательные элементы – микроэлементами. Такие удобрения
вносят в почву в очень малых количествах. К ним относятся соли, содержащие бор,
марганец, медь, цинк, и др. элементы.
По агрегатному состоянию удобрения подразделяют на твердые и жидкие (например,
аммиачная вода, водные растворы и суспензии).
К физическим свойствам минеральных удобрений предъявляется ряд
требований. Водорастворимые соли должны быть сыпучими, легко рассеиваться, не
быть сильно гигроскопичными, не слеживаться при хранении, должны обладать
такими свойствами, чтобы сохраняться в почве в течении некоторого времени, не
слишком быстро вымываться дождевой водой и не сдуваться ветром. Этим
требованиям в наибольшей степени отвечают крупнокристаллические и
гранулированные удобрения. Гранулированные удобрения можно вносить на поле с
помощью туковых машин и сеялок в количествах, строго соответствующих агрохимическим
требованиям.
Эффективным свойством для уменьшения слеживаемости является обработка поверхности
гранул поверхностно-активными веществами. В последние годы стали рассматриваться
способы создания вокруг гранул специальных оболочек, которые с одной стороны
предохраняют удобрение от слеживания, с другой – позволяют регулировать во
времени процесс растворения питательных веществ в почвенных водах, т.е. создавать
долговременно действующие удобрения.
Рассмотрим некоторые процессы получения фосфорных, азотных и комплексных
удобрений.
Фосфорные
удобрения.
Существует ряд методов переработки природных фосфатов в удобрения:
механические, термические и методы кислотного разложения.
Одним из методов механической обработки является измельчение фосфатов.
Полученная фосфористая мука при использовании в кислых почвах медленно
растворяется в почвенных водах и таким образом становится долговременно
действующим удобрением.
Фосфорные удобрения могут быть получены термическим разложением фосфатов
при температурах 1200 – 1800°С. Так получают термофосфаты, обесфторенные фосфаты,
плавленые магниевые и термощелочные фосфаты.
Основным методом получения фосфорных удобрений является химическое
разложение фосфатного сырья. Так, в результате сернокислотной обработки
получают простой суперфосфат и фосфорную кислоту, которую в свою очередь,
перерабатывают в двойной суперфосфат, преципитат и сложные удобрения.
Производство
простого суперфосфата.
Сущность производства простого суперфосфата состоит в превращении природного
фторапатита, нерастворимого в воде и почвенных растворах, в растворимые соединения,
преимущественно в монокальцийфосфат (Ca(H2PO4)2)
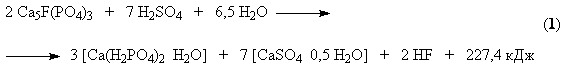
В этом процессе
разложение протекает в две стадии. На первой стадии около 70% апатита реагирует
с серной кислотой. При этом образуется фосфорная кислота и полугидрат сульфата
кальция (уравнение (1)). Эта стадия
характеризуется образованием поверхностных пленок CaSO4 на зернах фосфата.
Структура образующейся корки обусловлена скоростью кристаллизации твердой фазы,
зависящей главным образом от пресыщения раствора сульфатом кальция, которое
определяется в свою очередь концентрацией серной кислоты, температурой и
другими факторами. Поэтому необходима оптимальная концентрация серной кислоты,
сочетающая достаточную скорость растворения апатита с образованием рыхлой
пленки, более проницаемой для диффузии серной кислоты к поверхности фосфата.
Первая стадия заканчивается через 20 – 40 минут после смешения фосфата с серной
кислотой. После полного исчезновения серной кислоты начинается вторая стадия
разложения, в которой оставшийся апатит (~ 30%) разлагается фосфорной кислотой

Образующийся
монокальцийфосфат в отличие от сульфата кальция не сразу выпадает в осадок. Он
постепенно насыщает раствор фосфорной кислоты, после чего начинает выкристаллизовываться
в виде Ca(H2PO4)2×H2O и протекает значительно
медленнее, чем реакция (1), что
объясняется низкой активностью фосфорной кислоты и кристаллизацией твердых фаз.
Она начинается в суперфосфатных камерах и длится в течение 5 – 20 суток
хранения суперфосфата на складе.
Для получения твердого продукта более высокого качества суперфосфат перед
дозреванием подвергают нейтрализации твердыми добавками (известняком,
фосфоритной мукой и т.п.) и гранулируют.
Производство
двойного суперфосфата.
Двойной суперфосфат – концентрированное фосфорное удобрение. Получаемое
разложением природных фосфатов фосфорной кислотой. Оно содержит 42 – 50 % усвояемого
P2O5, что в 2-3 раза
больше, чем в простом суперфосфате. В отличие от последнего двойной суперфосфат
почти не содержит балласта – сульфата кальция. Процесс протекает по уравнению (2).
Азотнокислое
разложение фосфатов.
Получение сложных удобрений.
Прогрессивным направлением в переработке фосфатного сырья является метод
азотнокислого разложения апатитов и фосфоритов. Этот метод позволяет
использовать азотную кислоту не только как средство разложения фосфоритов, но и
дополнительный источник питательных элементов. На основе азотнокислого
разложения фосфатов обычно получают сложные NP – или NPK-удобрения.
В основе процесса разложения фосфатов азотной кислотой лежит реакция
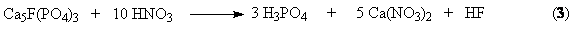
в результате
которой образуется азотнокислая вытяжка, раствор, содержащий нитрат кальция и
свободную фосфорную кислоту. Существует ряд методов дальнейшей переработки
азотнокислой вытяжки. Во многих процессах вытяжку нейтрализуют аммиаком получая
фосфаты аммония (NP-удобрения).
Если перед гранулированием нейтрализованной пульпы к ней добавляют соли калия (KCl, K2SO4), то получают тройное NPK-удобрение –
нитроаммофоску.
Во многих процессах азотнокислой переработки фосфатов нитрат кальция, образующийся
в реакции (3), удаляют из
реакционной смеси выпариванием. Разработка таких схем дает возможность комплексной переработки
фосфатного сырья и создания практически безотходных производств, исключающих
сброс отходов, в частности фосфогипса. Азотнокислый метод разложения фосфатов
позволяет наряду с получением NPK-удобрений
попутно выделять из сырья такие ценные продукты как стронций, редкоземельные
элементы и др., находящие применение в различных отраслях промышленности
(электроника, металлургия и т.д.).
Производство
азотных удобрений.
Важнейшими видами минеральных удобрений являются азотные удобрения: аммиачная
селитра, карбамид, сульфат аммония, водные растворы аммиака и др.
Азотные удобрения отличаются друг от друга по содержанию азота, по форме
соединений азота (нитратные, аммонийные, амидные), фазовому состоянию (твердые
и жидкие).
Производство
аммиачной селитры.
Аммиачная селитра или нитрат аммония (NH4NO3)
– кристаллическое вещество белого цвета, содержащее 35% азота в аммонийной и
нитратной формах, обе формы легко усваиваются растениями. Гранулированную
аммиачную селитру применяют в больших масштабах перед посевом и для всех видов подкормок.
В меньших масштабах ее используют для производства взрывчатых веществ.
Аммиачная селитра хорошо растворима в воде и обладает большой
гигроскопичностью. Это является причиной того, что гранулы удобрения расплываются,
теряют свою кристаллическую форму, происходит слеживание удобрений – сыпучий
материал превращается в твердую монолитную массу.
Для получения практически не
слеживающейся аммиачной селитры применяют ряд технологических приемов.
Во-первых, гранулирование. Суммарная поверхность однородных гранул меньше поверхности
такого же количества мелкокристаллической соли, поэтому гранулированные
удобрения медленнее поглощают влагу из воздуха. Иногда аммиачную селитру
сплавляют с менее гигроскопичными солями, например, сульфатом аммония,
фосфатами аммония, хлоридом калия, нитратом магния.
В основе процесса производства аммиачной селитры лежит гетерофазная
реакция взаимодействия газообразного аммиака с раствором азотной кислоты
Процесс лимитируется растворением газа в жидкости. Для уменьшения диффузионного
торможения необходим интенсивный режим перемешивания реакционной массы. Тепло
реакции рационально использовать для испарения воды из растворов нитрата аммония.
Возможен вариант получения плава нитрата аммония путем использования концентрированной
азотной кислоты и предварительного подогрева ингредиентов (плав содержит 95 –
96% NH4NO3).
В настоящее время наиболее распространены схемы с частичным упариванием
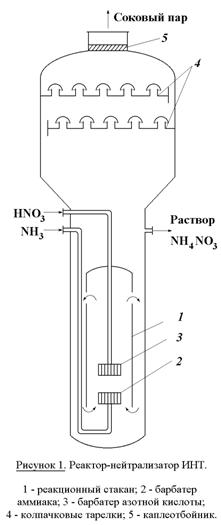
раствора за счет тепла нейтрализации. Нейтрализацию осуществляют в аппарате ИТН
(использование тепла нейтрализации) (рисунок 1). Аппарат состоит из двух
цилиндров (внешний и внутренний). Во внутренний подается газообразный аммиак и
разбрызгивается азотная кислота. Внутренняя часть представляет собой
реакционное пространство, внешняя – зона испарения. Отвод тепла из зоны реакции
необходим не только для выпаривания раствора, но и во избежании перегрева и
разложения азотной кислоты и аммиачной селитры. Соковый пар, образующийся как
результат испарения воды из реакционного раствора используется для подогрева
реагентов и упаривания реакционного раствора.
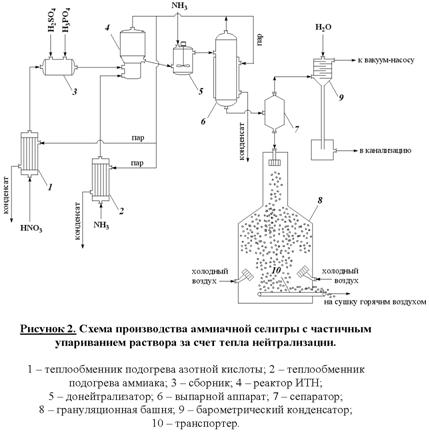
Схема установки представлена на рисунке 2.
 Раствор
аммиачной селитры (60-80%) поступает в донейтрализатор (5). Сюда добавляют аммиак как нейтрализующий агент, а также вещества
уменьшающие слеживаемость удобрений (нитраты кальция и магния). Выпарку
проводят в 2 или 3 ступени с использованием в качестве греющих агентов сокового
пара из аппарата ИТН, вторичного пара выпарки и свежего насыщенного пара. Для
простоты на схеме показан один выпарной аппарат (6). В выпарной установке плав доводят до содержания в нем NH4NO3 98 – 99%. Гранулирование
производят путем разбрызгивания плава в полой железобетонной башне (8) высотой 30 – 35 м. Падающие капли застывают
в гранулы в потоке холодного воздуха, поступающего противотоком с помощью
вентиляторов. Окончательная сушка осуществляется горячим воздухом во
вращающемся сушильном барабане (на схеме не показано).
Раствор
аммиачной селитры (60-80%) поступает в донейтрализатор (5). Сюда добавляют аммиак как нейтрализующий агент, а также вещества
уменьшающие слеживаемость удобрений (нитраты кальция и магния). Выпарку
проводят в 2 или 3 ступени с использованием в качестве греющих агентов сокового
пара из аппарата ИТН, вторичного пара выпарки и свежего насыщенного пара. Для
простоты на схеме показан один выпарной аппарат (6). В выпарной установке плав доводят до содержания в нем NH4NO3 98 – 99%. Гранулирование
производят путем разбрызгивания плава в полой железобетонной башне (8) высотой 30 – 35 м. Падающие капли застывают
в гранулы в потоке холодного воздуха, поступающего противотоком с помощью
вентиляторов. Окончательная сушка осуществляется горячим воздухом во
вращающемся сушильном барабане (на схеме не показано).
 Для
улучшения физических свойств аммиачной селитры целесообразно изготовление на ее
основе сложных и смешанных удобрений. Смешением аммиачной селитры с известняком
получают известково-аммиачную селитру, с сульфатом аммония – сульфонитрат
аммония. Нитрофоску можно получить сплавлением аммиачной селитры с солями
фосфорной кислоты и калия. На основе аммиачной селитры выпускают также жидкие
удобрения, растворяя ее в аммиачной воде.
Для
улучшения физических свойств аммиачной селитры целесообразно изготовление на ее
основе сложных и смешанных удобрений. Смешением аммиачной селитры с известняком
получают известково-аммиачную селитру, с сульфатом аммония – сульфонитрат
аммония. Нитрофоску можно получить сплавлением аммиачной селитры с солями
фосфорной кислоты и калия. На основе аммиачной селитры выпускают также жидкие
удобрения, растворяя ее в аммиачной воде.