Электрохимические
производства.
Основные
направления применения электрохимических процессов.
Электролиз
раствора хлорида натрия. Теоретические основы процесса и технология.
Электрохимическая промышленность, базирующаяся на электрохимических процессах
– одна из крупнейших отраслей народного хозяйства. Она включает электролиз
водных растворов, расплавленных сред и производство химических источников тока
(аккумуляторы, гальванические элементы, топливные элементы и т.д.).
Основные
направления применения электрохимических производств.
При электролизе водных растворов и расплавленных сред могут быть получены
самые разнообразные химические продукты. Электролизом водных растворов натрия и
калия получают такие многотоннажные химические продукты, как водород, хлор,
гидроксиды натрия и калия. Методом электролиза водных растворов осуществляют
энергохимический синтез многих неорганических и органических веществ – гипохлоритов,
хлоратов, перхлоратов, хлорной кислоты, перманганатов, диоксида марганца, а
также адипонитрила, антидетонаторов, например, тетраэтилсвинца, гидрохинона,
фторпроизводных ряда органических соединений и др. На электролизе водных
растворов основаны гидроэлектрометаллургия и гальванотехника. Гидроэлектрометалургия
– это извлечение металлов из водных растворов их солей путем электролиза.
Электролиз обычно служит завершающей стадией ряда металлургических процессов.
Электрохимическими методами получают и рафинируют медь, цинк, кадмий, марганец,
хром, свинец, олово, благородные металлы.
Гальванотехника применяется в металлообрабатывающей промышленности для
нанесения на металлические изделия покрытий из металлов или сплавов. Эти
покрытия наносят с целью защиты металла от коррозии, повышения твердости и
сопротивления механическому износу, с декоративной целью, а также для
изготовления точных металлических копий с различных предметов
(гальванопластика). С развитием новых отраслей техники (атомная энергетика,
ракетостроение, радиоэлектроника и др.) перед гальванотехникой становится более
сложные задачи, например, высокая стойкость покрытий в экстремальных условиях,
определенные магнитные характеристики, высокая жаростойкость,
сверхпроводимость, равномерность свойств покрытия на сложно-профилированной поверхности
и др.
Электролиз расплавленных сред используют в металлургии для производства и
рафинирования металлов, которые не могут быть получены электролизом водных
растворов – целого ряда легких, тугоплавких, благородных и редких металлов, а
также сплавов.
В настоящее время такие материалы как алюминий, магний, натрий, литий,
калий, титан и многие другие получают только электролизом расплавленных сред.
Электролиз расплавов используют также для получения фтора и бора.
Важнейшая область электрохимии – получение и эксплуатация химических источников
тока. Химические источники тока подразделяются на первичные и вторичные.
К первичным относятся источникам энергии, которые могут быть использованы
лишь однократно. К ним относятся батареи и гальванические элементы. Вторичные источники
тока – аккумуляторы, работоспособность которых восстанавливается пропусканием
электрического тока (в направлении, противоположном тому, в котором ток протекал
при разрядке). В топливных элементах «топливо», т.е. восстановитель и окислитель
непрерывно и раздельно подводятся к электродам, в результате чего химическая
энергия преобразуется в электрическую.
Масштабы применения химических источников тока весьма велики. Все
самолеты и автомобили с двигателями внутреннего сгорания снабжены
аккумуляторами, приводящими в действие двигатель. Различные электронные
устройства, например, транзисторные приемники, часы работают за счет
малогабаритных батарей. Большие перспективы имеет электрохимическая энергия,
т.е. применение электрохимических топливных элементов в энергоустановках –
автотранспорте, электростанциях и т.д.
Электрохимические методы все более широко внедряются в технику очистки
сточных вод, в частности для опреснения сильно минерализированных вод
электролизом с регенерацией индивидуальных солей, кислот и щелочей.
Электрохимические методы развиваются в промышленности опережающими темпами
по сравнению с химическими в связи с их очевидными преимуществами. В электрохимических
процессах аппаратура во многих случаях проще и компактнее по сравнению с
альтернативными химическими процессами, электрохимические методы получения ряда
продуктов характеризуются меньшим числом производственных стадий и операций,
более дешевым сырьем и большей глубиной его превращения, одновременным
образованием (причем в раздельном виде) ценных продуктов. Эти преимущества часто
обусловливают более низкую себестоимость получаемой продукции. Одно из главных
достоинств электрохимических методов – чистота получаемых продуктов. Основной
недостаток электрохимических процессов – высокая энергоемкость, поэтому
энергетические затраты составляют главную статью себестоимости продуктов. Поэтому
для электрохимических производств особенно важно снижение энергопотребления
путем совершенствования технологии, а также рационального, экономичного
использования электроэнергии.
Электролиз
раствора хлорида натрия
Электролиз раствора NaCl – наиболее простой и экономичный метод одновременного
получения трех важнейших химических продуктов – хлора, водорода и гидроксида
натрия с использованием дешевого и доступного природного сырья. Это самое крупномасштабное
электрохимическое производство. Суммарная реакция в электролизере может быть
выражена уравнением
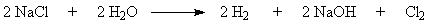
Хлор применяют в больших масштабах как сырье для производства хлорорганических
растворителей и пластмасс, синтетических каучуков, химических волокон, ядохимикатов.
В металлургии хлор применяется для хлорирующего обжига руд, в текстильной и
целлюлозно-бумажной промышленности – для очистки и отбеливания целлюлозы, бумажной
массы и тканей. Большие количества хлора идут на очистку и стерилизацию сточных
вод и питьевой воды.
Гидроксид натрия используется в производстве многих химических продуктов,
прежде всего в промышленном органическом синтезе, в целлюлозно-бумажном производстве,
в производстве искусственных волокон, в металлургии (производство алюминия), в
нефтехимической промышленности и др.
О значении водорода как топлива будущего и химическом реагенте говорилось
раньше.
Электролиз раствора NaCl осуществляется двумя методами, различными по характеру
электродных процессов и по аппаратурному оформлению:
1.
электролиз с твердым катодом и фильтрующей диафрагмой;
2.
электролиз без диафрагмы с жидким ртутным катодом.
Газообразные продукты – хлор и водород при любом способе отличаются
высокой чистотой. При электролизе с ртутным катодом и третий продукт – раствор
гидроксида натрия имеет высокую концентрацию NaOH и является химически чистым.
Благодаря чистоте получаемых продуктов, простому и компактному аппаратурному
оформлению, а также одностадийности процесс электролиза раствора NaCl является
единственным в мире способом производства хлора и основным способом получения
гидроксида натрия.
Электролиз
раствора NaCl с твердым катодом и фильтрующей диафрагмой.
При реализации этого процесса на катоде в соответствии с значениями
электродных потенциалов протекают следующие процессы:
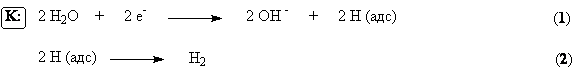
Материалами для катода служит сталь, на которой водород выделяется с
относительно невысоким перенапряжением (0,3 В). В реальных условиях электролиза
(концентрированный раствор NaCl,
содержащий NaOH, температура
90°С)
фактический потенциал выделения водорода составляет около – 0,845 В. Снижение
потенциала до 0,3 – 0,4 В можно достичь применением пористых графитовых
катодов, для упрочнения и гидрофобизации пропитанных политетрафторэтиленом и
активированных солями меди или серебра.
Накапливающиеся в катодном пространстве гидроксид-ионы образуют нейтральные
молекулы гидроксида натрия

На аноде выделяется хлор:

Материалом анода служит оксидно-рутениевая система (композиция из оксидов
рутения и титана, нанесенных на титановую основу), обладающая прочностью и
химической инертность по отношению к кислороду являющемуся побочным продуктом,
образующемся на аноде:
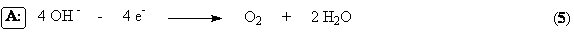
Кроме того, в
объеме электролита анодного пространства в результате гидролиза хлора идут
побочные химические реакции:
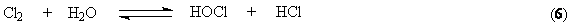
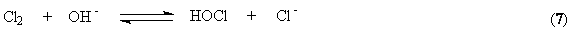
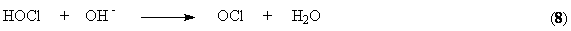
Образующийся в
результате этой последовательной реакции гипохлорит анион претерпевает анодное
окисление
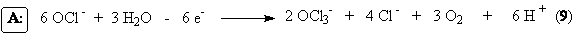
Побочные реакции
снижают выход по току основных продуктов и повышают расходные коэффициенты по
энергии. Поэтому условия электролиза и концентрация электролитов должны
обеспечивать минимальное протекание побочных реакций и достижение максимального
выхода по току целевых продуктов. Для этого электролиз реализуют в электролизерах
непрерывного действия с вертикальными фильтрующими диафрагмами при противотоке
движения электролита и OH –ионов. Схема электролизера представлена на рис. 1.
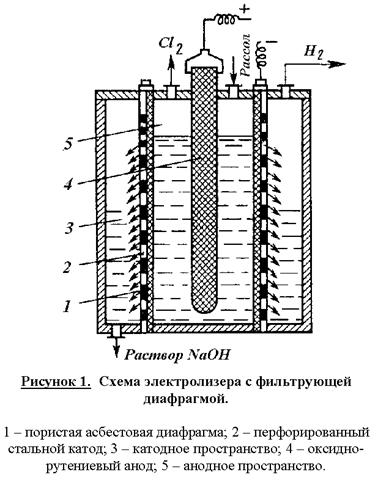 Корпус
ванны в этой конструкции разделен на катодное и анодное пространства пористой
диафрагмой из асбеста, модифицированного полимерными веществами. Диафрагма
плотно прилегает к перфорированному стеклянному катоду. В современных электролизерах
катоды имеют гребенчатую разветвленную форму с целью развития поверхности. В
анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол
подают в анодное пространство и вследствие гидростатического давления он фильтруется
через диафрагму и катод в катодное пространство. Из катодного пространства
непрерывно отводят водород и раствор гидроксида натрия, а из анодного – хлор. В
образующемся хлор-газе содержится 95 – 96% Cl2. Хлор-газ охлаждают до 20°С (при этом конденсируется
вода) и дополнительно сушат промывкой концентрированной серной кислотой. Катодный
продукт – раствор гидроксида натрия содержит 120 – 140 г/л NaOH и 170 – 180
г/л неразложившегося NaCl.
Раствор выпаривают, при этом NaCl
переходит в твердую фазу, т.к. его растворимость резко снижается с увеличением
концентрации NaOH. После
выпарки и плавки щелоков получают безводны гидроксид натрия, содержащий 92 –
95% NaOH и 2 – 4% NaCl.
Корпус
ванны в этой конструкции разделен на катодное и анодное пространства пористой
диафрагмой из асбеста, модифицированного полимерными веществами. Диафрагма
плотно прилегает к перфорированному стеклянному катоду. В современных электролизерах
катоды имеют гребенчатую разветвленную форму с целью развития поверхности. В
анодном пространстве расположен оксидно-рутениевый анод. Очищенный рассол
подают в анодное пространство и вследствие гидростатического давления он фильтруется
через диафрагму и катод в катодное пространство. Из катодного пространства
непрерывно отводят водород и раствор гидроксида натрия, а из анодного – хлор. В
образующемся хлор-газе содержится 95 – 96% Cl2. Хлор-газ охлаждают до 20°С (при этом конденсируется
вода) и дополнительно сушат промывкой концентрированной серной кислотой. Катодный
продукт – раствор гидроксида натрия содержит 120 – 140 г/л NaOH и 170 – 180
г/л неразложившегося NaCl.
Раствор выпаривают, при этом NaCl
переходит в твердую фазу, т.к. его растворимость резко снижается с увеличением
концентрации NaOH. После
выпарки и плавки щелоков получают безводны гидроксид натрия, содержащий 92 –
95% NaOH и 2 – 4% NaCl.
Благодаря противотоку электролита и ионов OH -, последние практически
не попадают в анодное пространство и побочные реакции (5), (7) – (9), за которые они ответственны,
предельно минимизированы.
Электролиз
раствора хлорида натрия с ртутным катодом.
На ртутном катоде электродные реакции (1) и (2) идут с большим
перенапряжением – потенциал разряда составляет 1,7 – 1,8 В. Натрий выделяется
на ртутном катоде с большим эффектом деполяризации и потенциал разряда Na + на ртути
много ниже стандартного и равен 1,23 В. Явление деполяризации ртутного катода
обеспечивается тем, что разряд ионов натрия происходит с образованием
химического соединения – амальгамы натрия
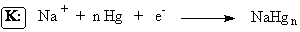
которая
непрерывно отводится с поверхности анода, растворяясь в избытке ртути. На
перфорированном графитовом (или оксидно-рутениевом) аноде выделяется хлор
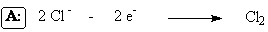
Амальгаму натрия, содержащую 0,1 – 0,3% Na выводят из
электролизера и разлагают нагретой водой в отдельном реакторе-разлагателе. В
разлагателе идет электрохимическая реакция, соответствующая процессу в
короткозамкнутом гальваническом элементе NaHg n [NaOH] С в котором амальгама служит
катодом
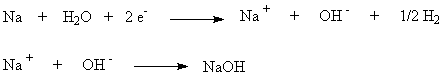
 Схема
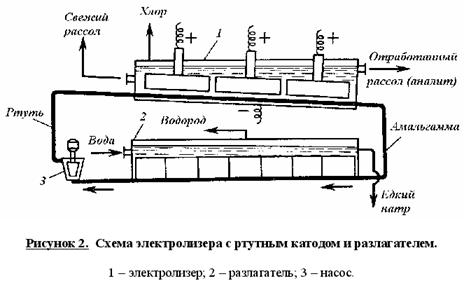
электролизера с ртутным катодом представлена на рисунке 2.
Схема
электролизера с ртутным катодом представлена на рисунке 2.
Глубоко очищенный концентрированный раствор NaCl подают в наклонный
удлиненный электролизер, по дну которого самотеком, противотоком рассолу,
движется ртуть, служащая катодом. Над ртутью расположен горизонтальный
оксидно-рутениевый (или перфорированный графитовый) анод, погруженный в рассол.
Анодная жидкость, содержащая непрореагировавший NaCl, выводится из электролизера
совместно с хлор-газом, от которого отделяется в сепараторах и продувочных
колоннах (на схеме не показаны). Хлор подают на осушку, а обесхлоренный рассол
после очистки от ртути и примесей насыщается каменной солью и возвращается в
электролизер. Амальгама натрия из электролизера перетекает в наклонный
реактор-разлагатель, где движется противотоком дистиллированной воде,
подаваемой в количестве, обеспечивающем получение 45%-ого раствора NaOH. На дне разлагателя
размещены гребенчатые графитовые плиты, образующие с амальгамой
короткозамкнутый гальванический элемент NaHg n [NaOH] С. Отводимый гидроксид натрия
отделяют в сепараторах от водорода и передают потребителям. Ртуть, вытекающую
из разлагателя, ртутным насосом перекачивают в электролизер.
Поскольку на стадии электролиза щелочь не образуется, то в процессе с
ртутным катодом исключены побочные реакции (5), (7) – (9) и процесс характеризуется высоким
выходом по току и энергии.
Однако, метод электролиза с ртутным катодом требует особо тщательной
очистки исходного циркулирующего рассола, так как примеси магния, железа,
кальция и других металлов снижают перенапряжение водорода на ртутном катоде,
что может привести к нарушению катодного процесса и взрывам.
Электролиз с ртутным катодом дает высококонцентрированные, химически
чистые растворы гидроксида натрия, которые необходимы для целого ряда
потребителей, прежде всего в производстве искусственных волокон, при синтезе и
подготовки ионообменных материалов и др. Но использование ртути вредно для
здоровья людей. Для получения химически чистых растворов NaOH начали применять
электролиз раствора NaCl
с ионообменной (катионообменной) мембраной, разделяющей катодное и анодное
пространства. Этот метод более сложен по аппаратурному оформлению и
эксплуатации аппаратуры, но значительно безопаснее, чем ртутный. Мембранный
метод электролиза, так же как и диафрагменный, может считаться малоотходным
технологическим процессом.