Кумольный способ получения фенола.
Фенол С6Н5ОН представляет собой кристаллическое
вещество (tпл=420С,
tкип=181,40С)
В свежеперегнанном виде он бесцветен,. Но при хранении приобретает глубокий
оранжевый или красный цвет.
Основные направления его применения – производство фенолоальдегидных полимеров,
синтетических волокон капрон и нейлон, эпоксидных полимеров и поликарбонатов.
Его используют также в качестве промежуточного продукта в производстве красителей,
лекарственных и взрывчатых веществ, гербицидов. Алкилированием фенола получают
антиокислительные присадки и промежуточные продукты для синтеза неионогенных
ПАВ.
Наиболее прогрессивным способом получения фенола является кумольный, основанный
на реализации следующих стадий:
1.
Окисление изопропилбензола (кумола) в гидропероксид
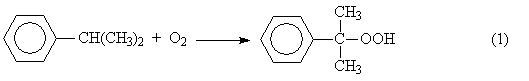
2.
Разложение получаемого гидропероксида на фенол и ацетон
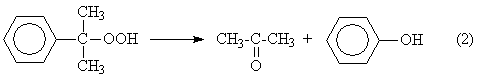
Суммируя
уравнения (1) и (2) получаем результирующее уравнение процесса
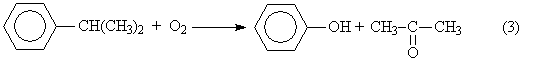
Можно видеть, что в правой части суммарного уравнения (3) фигурируют
только фенол и ацетон, которые являются ценными товарными продуктами. С другой
стороны, в этом процессе требуется дешёвое
и доступное сырьё (изопропилбензол и воздух). Это и делает кумольный
способ получения наиболее экономичным среди всех известных способов получения
фенола.
Рассмотрим основные закономерности протекания стадий окисления и
разложения гидропероксида изопропилбензола.
Окисление
изопропилбензола (кумола)
Окисление изопропилбензола представляет собой типичный
свободно-радикальный процесс с вырожденным разветвлением цепей. В отсутствие
каких-либо посторонних инициирующих агентов зарождение цепей осуществляется
посредством бимолекулярного взаимодействия молекул кислорода и изопропилбензола
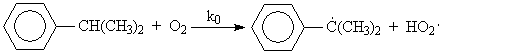
Эта реакция характеризуется высоким энергетическим барьером и протекает
крайне медленно. Низкая скорость инициирования не может обеспечить концентрацию
свободных радикалов на уровне, вызывающем заметное протекание цепного процесса.
Поскольку гидропероксид изопропилбензола легко распадается по слабой кислород-кислородной связи
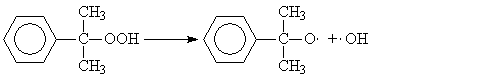
его накопление в
ходе процесса приводит к лавинообразному увеличению скорости генерирования
свободных радикалов, а значит, и скорости окисления изопропилбензола. Такой
характер процесса обусловливает наличие некоторого индукционного периода реакции,
который можно определить как время, в течение которого в системе накапливается количество
гидропероксида, обеспечивающее заметное протекание цепного процесса. В связи с
этим естественным способом сокращения индукционного периода является добавление
в исходный изопропилбензол некоторое количество гидропероксида или окисленной
реакционной массы.
Индукционный период процесса может быть значительно больше по причине присутствия
в реакционной массе ингибиторов свободно-радикального окисления таких как
серосодержащие органические соединения, фенолы и др. В этом случае индукционный
период определяется как время, в течение которого в системе разрушается
ингибитор J-H за счёт его взаимодействия
с радикалами цепи
R×
+ J-H ® RH + J×
Образующиеся при
этом радикалы J× малоактивны и не способны
дальше продолжать цепь. В связи с отмеченной причиной увеличения индукционного
периода важной технологической задачей является очистка исходного сырья от
веществ, являющихся ингибиторами или способных при окислении давать ингибиторы.
Обычные катализаторы жидкофазного окисления (соли марганца, кобальта и
др.) в данном случае нельзя использовать в качестве инициирующих агентов, так
как они вызываеют заметное разложение гидропероксида в побочный продукт –
диметилфенилкарбинол.
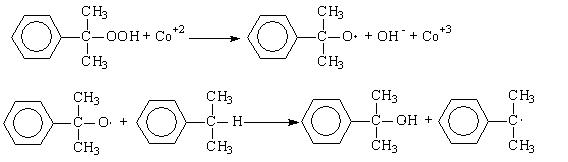
Процесс окисления изопропилбензола в гидропероксид осложняется
образованием побочных продуктов: ацетофенона и диметилфенилкарбинола. Механизм
основной и побочных реакций может быть представлен следующей схемой
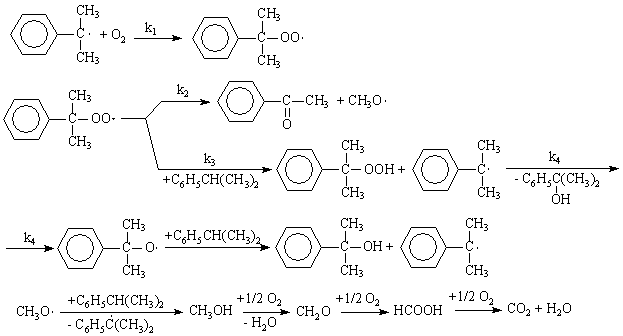
В соответствии с представленной схемой дифференциальная селективность процесса
по гидропероксиду выразится уравнением
|

|
(4)
|
В условиях стационарности
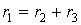
однако поскольку
удельный вес ацетофенона в этом процессе невелик, членом r2 в последнем равенстве
можно пренебречь
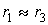
Тогда соотношение
концентраций 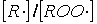 выразится уравнением
выразится уравнением
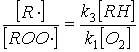
Подставляя
последнее выражение в уравнение (4), имеем окончательно

Анализ этого
уравнения показывает, что селективность реакции падает с понижением
парциального давления кислорода и ростом глубины превращения (что соответствует
накоплению гидропероксида и уменьшению концентрации углеводорода). В
соответствии с более низкими энергиями активации реакции развития цепей
основного процесса по сравнения с побочными Е4>E1 и E2>E3 селективность процесса
растёт с понижением температуры, однако при этом понижается его скорость. Это
обусловливает необходимость выбора оптимальной температуры. На практике процесс
проводят при температурах 105-120°С. Если процесс осуществляется в каскаде реакторов, то
температуру процесса ступенчато понижают при переходе от одного реактора к
другому. Такое решение позволяет при сохранении скорости процесса (за счёт
увеличения концентрации гидропероксида) увеличить селективность процесса.
Увеличение давления приводит к росту скорости и селективности процесса. В
то же время давление ограничивается сверху в связи с более жёсткими условиями
работы оборудования, увеличением расходов на компримирование, расширением
пределов взрываемости паро-газовой смеси над реакционной массой. На практике
работают с давлением 0,3-0,5 МПа.
Время реакции определяется значением оптимальной конверсии. Увеличение конверсии
(соответствующие накоплению ROOH
и исчерпыванию RH)
приводит в соответствии с уравнением (5)
к снижению селективности.
Снижение конверсии, выгодное с точки зрения селективности, приводит к
возрастанию доли непрореагировавшего изопропилбензола, что требует
дополнительных затрат на его рециркуляцию. Оптимальная конверсия,
представляющая компромисс между требованиями высокой селективности и
экономичного рецикла, составляет обычно 25-30%. Таким значениям конверсии
соответствует продолжительность реакции порядка нескольких часов.
В силу высокой реакционной способности изопропилбензола процесс при определенных
условиях может протекать в диффузионной области. В этом случае низкие концентрации
кислорода в реакционной массе, в соответствии с уравнением (5) обусловливают понижение
селективности процесса. Поэтому важной технологической задачей при реализации
процесса является создание эффективного гидродинамического режима.
Эта задача решается созданием режима циркуляции реакционной массы, проведением
процесса в высокоэффективных массообменных аппаратах.
Присутствие кислых примесей в реакционной массе вызывает нежелательный процесс
разложения гидропероксида с образованием фенола, который является ингибитором
процесса свободно-радикального окисления:
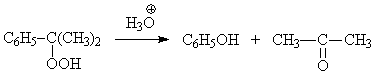
С целью нейтрализации образующихся в ходе процесса кислых примесей, например,
по реакции:
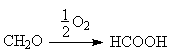
процесс окисления изопрпилбензола часто ведут в
присутствии щелочных агентов. В качестве последних используют BaCO3, CaCO3, Na2CO3, NaHCO2 и др.
Разложение
гидропероксида на фенол и ацетон.
Разложение гидропероксида изопропилбензола катализируется протонными кислотами.
Реакция протекает по ионному механизму:
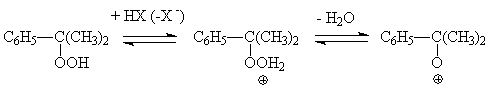
Образующийся
катион перегруппировывается с миграцией енольной группы к кислородному атому и
последующими превращениями, в результате которых получается фенол и ацетон:
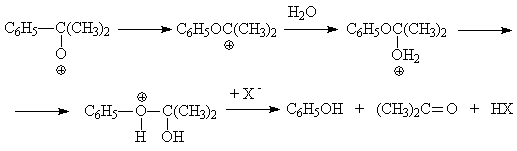
Побочные продукты окисления, содержащиеся в качестве примесей в гидропероксиде,
также способны вступать в различные реакции под действием кислотных катализаторов.
Так, диметилфенилкарбинол дегидратируется с образованием a-метилстирола,
а также выступает в качестве алкилирующего агента по отношению к фенолу. Кроме
того, a-метилстирол
димеризуется:
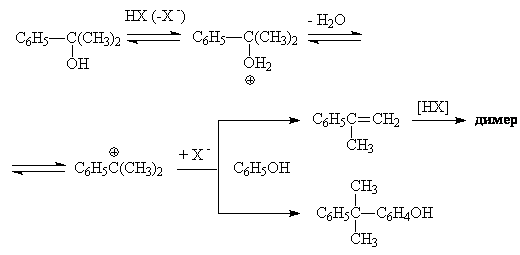
Получаются также небольшое количество смол более сложного строения. При повышении
концентрации кислоты и температуры становятся возможными
кислотно-каталитические превращения ацетофенона и ацетона, например, по типу
альдолной конденсации с последующим отщеплением воды:
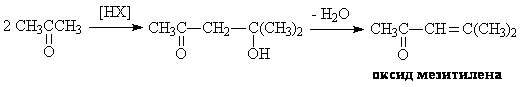
Скорость
основной реакции описывается уравнением:
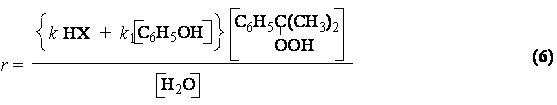
Реакция протекает очень быстро. В присутствии 0,05-0,1 % (масс.) H2SO4 при 50-600С
достигается практически полное превращение за 2-3 мин.
Ввиду высокой скорости процесса при его промышленной реализации
необходимо, чтобы ее значение не достигало предела, при котором невозможно
снять тепловыделения, чтобы сделать процессы съема тепла контролируемыми, реакцию
ведут в разбавителях, в качестве которых выступают продукты реакции и ацетон.
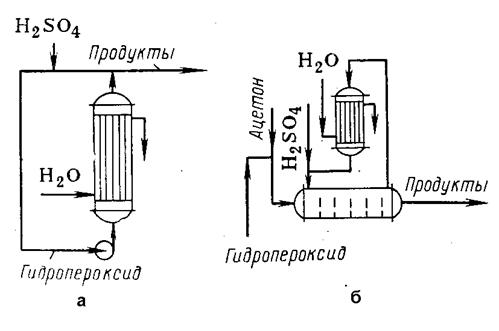
Рис. 1. Реакционные узлы для кислотного разложения
гидропероксидов:
а – проточно-циркуляционная
установка;
б – установка с отводом тепла
за счет испарения ацетона.
Один
из методов проведения реакции состарив применении проточно-циркуляционной
установки (pис. 1а),
когда выделяющееся тепло снимают в трубчатом реакторе за счет охлаждения его
водой. Реакционную смесь по выходе из реактора частично отводят на дальнейшую
переработку, но основное количество направляют на рециркуляцию: добавляют
кислоту-катализатор и в насосе смешивают с исходным гидроперокси-дом. При такой
системе время контакта лимитируется теплоотводом и является завышенным. Кроме
того, рециркуляция смеси ведет к повышенному выходу побочных веществ. Так, на 1
т фенола получается 100—150 кг отходов, в том числе 15-20 кг a-метилстирола, 40—50 кг
димера и смол, 5—10 кг ацетофенона, 30 кг кумилфенола и т. д. Хотя окиси мезитила
образуется немного, но она существенно затрудняет очистку фенола.
Другой
способ кислотного разложения гидропероксидов (рис. 1б) состоит в проведении
реакции в растворе ацетона и отводе тепла за счет его испарения. Ацетон конденсируют
в обратном холодильнике и возвращают в реактор, который можно секционировать
поперечными перегородками. Это наряду с уменьшением концентрации фенола в растворе
и времени контакта снижает выход побочных веществ.
Технологическая
схема получения фенола и ацетона кумольным способом.
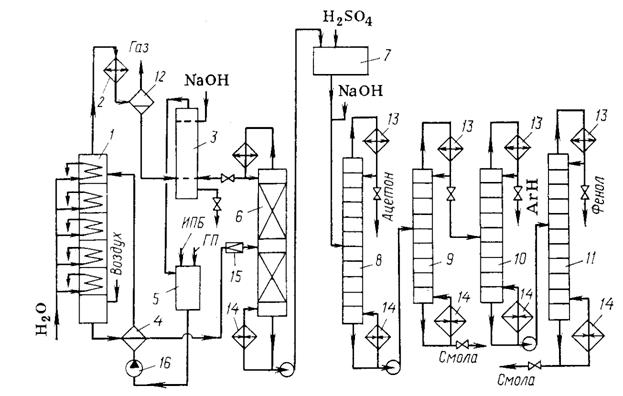
Рис. 2. Технологическая схема
кумольного метода получения фенола и ацетона:
1 – реакционная колонна; 2 – холодильник; З – промыватель-сепаратор;
4 – теплообменник; 5 – сборник; 6, 8-11 – ректификационные колонны; 7 – узел
кислотного разложения гидропероксида; 12 – сепаратор; 13 – дефлегматоры; 14 – кипятильники;
15 – дроссельный вентиль; 16 – насос.
Производство
фенола и ацетона кумольным методом включает стадии получения изопропилбензола,
синтез гидропероксида изопропилбензола и его кислотного разложения в фенол и
ацетон.
Технологическая
схема двух последних стадий изображена на рис. 2. Окисление проводится в тарельчатой
реакционной колонне (19) снабженной
холодильниками: при их помощи поддерживают температуру жидкости от 120°С на
верхней тарелке до 105°С в кубе. Воздух, предварительно очищенный от загрязнений
и механических примесей и подогретый, подают в нижнюю часть колонны под
давлением »0,4
МПа. Свежий и оборотный изопропилбензол (ИПБ), к которому добавлен
гидропероксид (ГП), инициирующий начальную стадию окисления, из сборника (5) подают в теплообменник (4), а оттуда на верхнюю тарелку реактора.
Воздух движется противотоком к жидкости, барботируя через нее на тарелках
колонны. При этом он увлекает с собой пары изопропилбензола и летучих побочных
продуктов (муравьиная кислота, формальдегид), которые конденсируются в
холодильнике (2). Оставшийся воздух
выводят в атмосферу, а конденсат отмывают от муравьиной кислоты водным
раствором щелочи в промывателе-сепараторе (3).
Углеводородный слой сливают в сборник (5),
а водный слой рециркулируют на промывку, сбрасывая в конечном счете в канализацию.
Оксидат
из нижней части колонны (7) содержит
до 30 % гидропероксида. Он отдает свое тепло изопропилбензолу в теплообменнике
(4), дросселируется до остаточного
давления »4
кПа и поступает на вакуум-ректификацию для концентрирования гидропероксида.
Отгонку изопропилбензола ведут в насадочной ректификационной колонне (6) непрерывного действия, снабженной
конденсатором-дефлегматором. Применение вакуума обусловлено термической
нестабильностью гидропероксида. Часть конденсированного изопропилбензола
возвращают из конденсатора-дефлегматора на орошение колонны (6), а остальное количество выводят в
сепаратор (3), промывают щелочью, и
снова направляют на окисление. Кубовая жидкость из колонны (6) содержит 70-75 % гидропероксида, а
также побочные продукты окисления и остатки изопропилбензола. Путем
дополнительной вакуум-ректификации (на схеме не изображена) при остаточном
давлении »665
Па повышают концентрацию гидропероксида до 88-92%. Следующую стадию (кислотное
разложение гидропероксида) осуществляют в узле (7) одним из двух описанных выше методов.
Заключительная
стадия состоит в ректификации, которую ведут в разной последовательности. Чаще
всего вначале при обычном давлении в колонне (8) отгоняют ацетон, затем при пониженном давлении отделяют в
колонне (9) смесь высококипящих
веществ (фенольная смола), остающуюся в кубе, от более летучих продуктов,
включая фенол. От этой фракции в колонне (10)
отгоняют a-метилстирол
и остатки изопропилбензола (углеводородная фракция) и в колонне (11) – фенол, оставляй в кубе
дополнительное количество фенольной смолы.
На
некоторых установках углеводородную фракцию гидрируют и возвращают на
окисление. Это предотвращает ингибирующее действие a-метилстирола и позволяет
вообще не концентрировать гидропероксид перед разложением или проводить только
его «укрепление». Предложен ряд методов утилизации фенольной смолы, в том числе
пиролиз с получением дополнительного количества фенола.