Строение атомов. Понятие о квантовых
числах. Атомные орбитали. Принцип Паули. Электронные
формулы.
В начале XX века физическими
исследованиями было установлено, что атом является сложной частицей и состоит
из ядра и вращающихся вокруг него электронов. В целом атом электро
нейтрален, т.е. заряд ядра равен суммарному заряду электронов.
Состав ядра.
1. Ядро состоит
из протонов и нейтронов. Заряд ядра равен числу протонов.
2. Основная
масса атома сосредоточена в ядре, поскольку масса электрона ничтожно мала и составляет
1/1840 часть от а.е.м.
Округленная до ближайшего целочисленного
значения атомная масса элемента называется массовым числом. Поэтому число
нейтронов в ядре A-Z=N, где A - массовое число, Z - заряд ядра, N - число
частиц. Для обозначения химического элемента слева от его символа
внизу заряд ядра, вверху массовое число.
Изотопы - разновидности
атомов данного элемента, обладающие одинаковым зарядом ядра, но различающиеся
по атомной массе.
Изобары - изотопы
различных элементов, имеющих равную атомную массу. Изобары различаются по
химическим свойствам.
Химический элемент - это
совокупность атомов, имеющих одинаковый заряд ядра, строение электронных
оболочек атомов.
И в 1913 году Бор предложил постулаты, в
которых были предложены условия устойчивости атомов:
1) Электрон может вращаться вокруг ядра,
не излучая и не поглощая энергии лишь на так называемых стационарных орбитах.
Каждой такой орбите соответствует определенное значение энергии. Чем ближе к
ядру находится электрон, тем меньшим запасом энергии он обладает.
2) Переход электрона с одной
стационарной орбиты на другую сопровождается излучением или поглощением
энергии.
В 1923 - 1924 годах происходило развитие
квантовой механики и квантовой химии.
Классическая механика относится к
объектам макромира, квантовая механика и квантовая химия к объектам микромира.
Квантовая механика и квантовая химия имеют 3 основных
отличия.
1) Дискретность вещества и квантование
энергии.
2) Корпускулярно - волновой дуализм.
3) Вероятностный характер законов
микромира.
Первоначально
корпускулярно-волновой дуализм был предписан фотонам - частицам света. Де
Бройль использовал уравнение Эйнштейна, которое описывает E = mc2
энергию электрона как частицы (m). С другой стороны
он использовал уравнение Планка Е = hl (l - частота колебаний.
Получил уравнение для фотона:
![]()
В
нем взаимосвязаны характеристики электрона как частицы, как и волны. В
последствии это уравнение получило экспериментальное подтверждение.
![]()
![]() , где u - скорость
электрона.
, где u - скорость
электрона.
Таким образом, был получен ответ на
вопрос к теории Бора. В момент перехода с одной стационарной орбиты на другую
электрон проявляет волновые свойства, т.е. может находиться в любой части
пространства вокруг ядра. Т.о. под корпускулярно-волновым дуализмом фотона,
электрона и других объектов микромира понимают, как способность проявлять
корпускулярные или волновые свойства или и те и другие одновременно в
зависимости от внешних условий.
Таким образом, электрон - это частица,
если речь идет о дискретности и электрон - это волна, если речь идет о
характере его движения. Экспериментально было установлено, что электрон способен к явлению интерференции и дифракции.
В 1927 году немецкий ученый Гейзенберг
выдвинул принцип неопределенностей:
![]()
Dpx
- неопределенность (ошибка в определении импульса микрочастицы по координате х.
Dx -
неопределенность положения микрочастицы по этой координате.
Невозможно одновременно с достаточной
точностью определить положение и импульс любого микрообъекта. Если с
достаточной точностью определить координаты микрообъекта то мы получим большую
ошибку в определении его энергии (то есть импульса) и наоборот, если объект
имеет определенное значение энергии, то его координаты остаются неопределенными.
Это связано с вероятностным характером положения электрона и его энергии.
Следствие1:
движение электронов в атоме - это движение без траектории, поэтому понятие
орбита движения электрона, введенное Бором оказалось неприемлемым. Можно
говорить лишь о вероятности нахождения электрона в той или иной части пространства электронного облака - та часть
пространства вокруг ядра, в котором наиболее вероятно нахождение электрона.
Поэтому электронное облако не имеет резко очерченных границ, границы его
размыты.
Следствие
2: электрон
в атоме не может упасть на ядро. Падение электрона на ядро сильно уменьшило бы
неопределенность его координаты (в 105 раз), так как радиус атома 10-1
нм, а радиус ядра 10-6 нм. Такое уменьшение неопределенности
координаты вызвало бы резкое увеличение неопределенности энергии. Был бы очень
большой разброс по значениям энергии. Энергия электрона в атоме водорода 102
кДж/моль, а в случае неопределенности энергии, минимальная энергия электрона 1011
кДж/моль. Разница составляет 109 кДж/моль. В этом случае электрон
должен был бы покинуть атом.
В 1926 - 1927 годах немецкий ученый
Шредингер вывел уравнение, в котором движение электрона в атоме под действием
электростатического поля ядра описывается так называемой волновой функцией. y(x, y, z)
- волновая функция, то есть функция пространственных координат электрона,
которые не зависят от времени.
![]()
Е
- полная энергия электрона;
Еп - потенциальная
энергия;
m - масса;
Ñ - оператор
"набла";
Ñ2 - сумма вторых
частных производных по независимым переменным координатам электрона x, y, z;
¶2 - вторая
частная производная.
![]()
Решение
этого уравнения производят на ЭВМ, что
позволяет найти с достаточно высокой точностью энергию и плотность электронного
облака на различных расстояниях от ядра. Плотность электронного облака
характеризуется плотностью вероятности, то есть çy2ç - модулем квадрата волновой функции. Та часть
пространства, где значение y2
максимальна и будет местом вероятного пребывания электрона. Из решения
уравнения вытекает появление целочисленных параметров, ограничивающих
энергетические характеристики электрона, получивших название квантовых чисел.
Квантовые числа
Все
квантовые числа имеют целочисленные значения, кроме спинового квантового числа.
Любая энергетическая характеристика электрона пропорциональна кванту энергии.
n -
главное квантовое число;
l -
побочное (орбитальное) квантовое число;
ml - магнитное квантовое число;
ms - спиновое квантовое число;
Главное,
орбитальное и магнитное квантовые числа
описывают энергетическое состояние электрона в электронном облаке. n характеризует размер электронного облака, l - форму электронного облака, ml
- ориентацию электронного облака в пространстве.
Главное квантовое число (n)
Характеризует
запас энергии электрона (энергетический уровень) и размер электронного облака.
Может принимать целочисленные значения от 1 до бесконечности (теоретически).
Теоретически границы периодической системы являются неопределенными. А
практически, в соответствии с существующими границами периодической системы,
главное квантовое число может принимать все целочисленные значения от 1 до 7.
Исхода из значения n, можно вычислить максимальное
число элдектронов на на данном энергетическом уровне по формуле 2n2. Число значений n, т.е. число
энергетических уровней совпадаетс номером периода в
периодической системе:
1
период: n = 1, Nmax
= 2 электрона;
2
период: n = 1, 2, Nmax
= 8 электрона;
3
период: n = 1, 2, 3, Nmax =
18 электрона;
4
период: n = 1, 2, 3, 4, Nmax
= 32 электрона.
Формулу 2n2 можно
применять для значений n от 1 до 4. Для
элементов 6 преиода: n = 5
соответствует предвнешнему энергетическому уровню, n = 6 - последнему уровню. Для этих уровней
экспериментально установлены ограничения числа электронов: на предвнешнем Nmax = 18 электронов, на внешнем
Nmax = 8 электронов.
Побочное квантовое число (l)
Характеризует
энергетический подуровень электрона. В пределах одного энергетического уровня
электроны обладают примерно одинаковым запасом энергии, но их электронные
облака различаются по форме, т.е. энергетический уровень разделяется на
подуровни.
l может
принимать все целочисленные значения от 0 до n - 1.
n = 1, l = 0;
n = 2, l = 0, 1;
n = 3, l = 0, 1, 2;
n = 4, l = 0, 1, 2, 3.
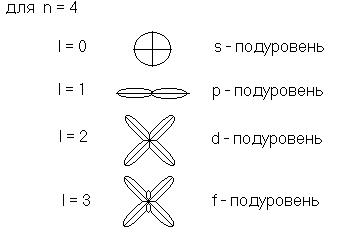
Количество
подуровней равно номеру уровня. Например:
Исходя из значения l,
можно рассчитать максимальное количество электронов на энергетическом подуровне
по формуле 2(2l +1):
l = 0, Nmax = 2,
s-подуровень - 2 электрона;
l = 1, Nmax = 6,
p-подуровень - 2 электрона;
l = 2, Nmax = 10, d-подуровень - 2 электрона;
l = 3, Nmax = 14, f-подуровень - 2 электрона.
Максимальное
заполнение электронами энергетических уровней и подуровней:
|
Энергетический уровень (n) |
Nmax = 2n2 на уровне |
Энергетический подуровень(l) |
Nmax=2(2l+1) на подуровне |
Запись энергетич. состояния |
|
1 |
2 |
l = 0 (s) |
2 |
1s2 |
|
|
2 |
8 |
l = 0 (s) l = 1 (p) |
2 6 |
2s2p6 |
|
|
3 |
18 |
l = 0 (s) l = 1 (p) l = 2 (d) |
2 6 10 |
3s2p6d10 |
|
|
4 |
32 |
l = 0 (s) l = 1 (p) l = 2 (d) l = 3 (f) |
2 6 10 14 |
4s2p6d10f14 |
|
|
5 (предпоследний) |
не более 18 |
l = 0 (s) l = 1 (p) l = 2 (d) |
2 6 10 |
5s2p6d10 |
|
|
6 |
не более 8 |
l =
0 (s) l = 1 (p) |
2 6 |
6s2p6 |
|
Максимальное
заполнение всех энергетических уровней и подуровней наблюдается у последнего
элемента 6 периода Rn - радон:
![]() 1s22s2p63s2p6d104s2p6d10f145s2p6d106s2p6
1s22s2p63s2p6d104s2p6d10f145s2p6d106s2p6
Магнитное квантовое число (ml)
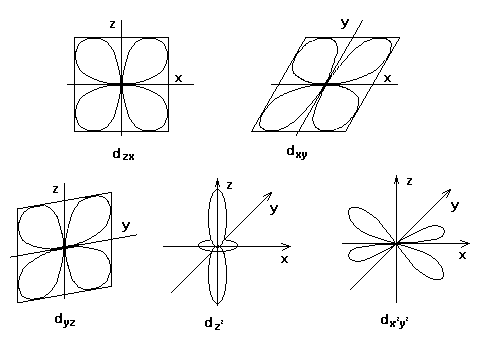
Характеризует
ориентацию электронного облака в пространстве под воздействием внешнего
магнитного поля. Электрон, как и любой движущийся электрический заряд возбуждает вокруг себя магнитное поле. На каждый
данный электрон в атоме действуют магнитные поля соседних электронов. В
результате электронное облако определенным образом ориентируется в
пространстве. ml приобретает
целочисленные значения в зависимости от l.
Число
значений l соответствует числу возможных
ориентаций облака в пространстве.
l=0; m=0 (s-подуровень)
Электронное
облако s-подуровня имеют одну ориентацию.
l=1; m=-1;0;1 (p-подуровень)
Электронные
облака p-подуровня имеют 3 различные ориентации.
l=2; m=-2;-1;0;1;2 (d-подуровень)
Электронные
облака d-подуровня имеют 5 различных ориентаций.
l=3; m=-3;-2;-1;0;1;2;3 (f-подуровень)
Электронные
облака могут иметь 7 различных ориентаций в пространстве.
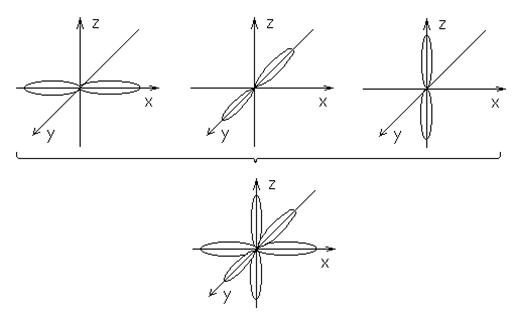
Число
значений m можно вычислить по формуле: 2l+1.
Электронное
облако определенного размера, определенной формы и определенным образом
ориентированное в пространстве называют орбиталью и
обозначают ÿ.
s-подуровень
ÿ
p-подуровень
ÿÿÿ
d-подуровень
ÿÿÿÿÿ
f-подуровень
ÿÿÿÿÿÿÿ
Спиновое квантовое число (ms)
Характеризует
направление вращения электрона вокруг собственной оси. Электрон
может с равной вероятностью вращаться вокруг собственной оси как по, так и
против часовой стрелки. ![]() В каждой орбитали максимально может находиться два электрона с антипараллельными спинами. Поэтому, учитывая число орбиталей на каждом подуровне максимальное число электронов
можно рассчитать по формуле: 2(2l+1).
В каждой орбитали максимально может находиться два электрона с антипараллельными спинами. Поэтому, учитывая число орбиталей на каждом подуровне максимальное число электронов
можно рассчитать по формуле: 2(2l+1).
Принцип Паули
В
атоме не может быть двух электронов с одинаковыми значениями четырех квантовых
чисел, то есть значения хотя бы одного квантового числа должны различаться (в атоме нет двух похожих электронов).
Правило составления электронных формул атомов
Заполнение
электронами энергетических уровней и подуровней происходит в соответствии со
следующими правилами:
1. Принцип минимальной энергии. В первую очередь
заполняются уровни и подуровни, ближе расположенные к ядру, а именно 1s, 2s, 2p…
Заполнение уровней и подуровней идет в соответствии с
правилами Клечковского:
1)
Emin ¸(n+l)min;
2) Если n+l для двух энергетических подуровней одинаково, то в
первую очередь заполняется тот энергетический подуровень, где n минимально.
|
подуровень |
n + l |
|
1s |
1+0=1 |
|
2s |
2+0=2 |
|
2p |
2+1=3 |
|
3s |
3+0=3 |
|
3p |
3+1=4 |
|
3d |
3+2=5 |
|
4s |
4+0=4 |
|
4p |
4+1=5 |
|
4d |
4+2=6 |
|
4f |
4+3=7 |
|
5s |
5+0=5 |
|
5p |
5+1=6 |
|
5d |
5+2=7 |
|
6s |
6+0=6 |
|
6p |
6+1=7 |
Примечание. Так как энергия подуровня 4f примерно равна
энергии подуровня 5d, то может происходить проскок электрона.
Итак, в соответствии с принципом минимальной энерии, уровни и
подуровни заполняются электронами в следующем порядке:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
5p 6s 4f 5d 6p
2. Положение элемента в периодической системе указывает
на распределение электронов по энергетическим уровням и подуровням.
а) порядковый номер соответствует заряду атома и
общему количеству электронов в атоме;
б) номер периода совпадает с количеством
энергетических уровней;
в) номер группы соответствует общему числу валентных
электронов в атоме;
г) подгруппа указывает на
распределение валентных электронов в атоме: если элемент стоит в главной
подгруппе, то все его валентные электроны находятся на последнем энергетическом
уровне; если в побочной, то на последнем энергетическом уровне находится один
или два электрона, а остальные валентные электроны находятся на d-подуровне предпоследнего энергетического уровня.
Дан пример электронных формул для Br, Mn, Pb, La,Tm.
У девяти элементов периодической системы наблюдается
единичный проскок электрона, т.е. один электрон с внешнего энергетического
уровня переходит на d-подуровень предвнешнего
энергетического уровня, где занимает энергетически более выгодное положение.
Это следующие элементы: Cu, Ag, Au; Cr, Mo, Nb; Ru, Rh, Pt.
У одного элемента Pd наблюдается двойной проскок электрона.