Химическая
связь. Метод ВС и метод МО на примерах простейших
молекул (NO, N2, CO2, H2O, NH3, CH4 и т.п.).
Химическая связь.
Химическая связь
- это взаимодействие между атомами, приводящее к образованию молекул и к
прочному удерживанию атомов друг около друга. Доказано, что связь имеет
химическую природу и осуществляется за счет взаимодействия валентных
электронов. Различают несколько типов химических связей: ионная,ковалентная неполярная, ковалентная полярная,
донорно-акцепторная, водородная и дативная.
Однако в
последнее время все эти типы связей рассматриваются как разновидности ковалентной связи. Так, например, ионная
связь считается предельным случаем ковалентной полярной связи, когда общая
электронная пара максимально смещается к одному атому.
Ионная связь.
В 1916г.
немецкий ученый Коссель выдвинул первую теорию,
основные положения которой справедливы и в настоящее время и входят как
составная часть в современную теорию ионной связи.
1.
Ионная
связь образуется между атомами элементов, резко различающихся
по своим свойствам, т.е. между атомами металла и неметалла.
2Na + Cl2 = 2NaCl
Разноименно
заряженные ионы электростатически притягиваются друг
к другу по закону Кулона. При образовании ионов осуществляется стремление атомов к
образованию устойчивой восьмиэлектронной конфигурации
уровня.
2. 100%-ной ионной связи в природе не существует. Так как электроны
от атомов металлов не переходят в полное владение к атомам неметалла, т.е. во
всех ионных молекулах есть некоторая доля ковалентной связи. Даже в молекуле FrF степень ионности связи
составляет 93%. Следовательно, она содержит 7% ковалентной связи. В связи с
этим эффективные заряды в ионных молекулах не являются целочисленными.
d - эффективный заряд;
dFr = +0,93;
dF = -0,93.
При
распределении (растворении) ионных молекул в воде ионная связь разрывается и электроны от атома металла переходят в полное
владение к атомам неметалла и заряды становятся целочисленными.
Ковалентная
связь
В 1916г. Льюис
выдвинул первую теорию, основные положения теории об общей паре электронов
входит как составная часть в современную теорию ковалентной связи:
1) Ковалентная
связь образуется между атомами элементов близких по свойствам, например, между
атомами неметаллов или между 2-мя атомами металлов (в кристаллической решетке
металлов осуществляются металлические свойства, и присутствует некоторая доля
ковалентной связи).
2) Каждый из
взаимодействующих атомов для образования ковалентной связи предоставляет один
электрон, следовательно, образуется общая пара электронов. Если ковалентная
связь образована атомами одного неметалла или атомами с одинаковой
электроотрицательностью, то общая электронная пара не
смещается ни к одному из атомов, т.е. образуется ковалентная неполярная связь.
Если связь
образуется атомами с различной электроотрицательностью,
то общая электронная пара смещается к более электроотрицательному элементу. Так
образуется ковалентная полярная связь.
3) Спины
одиночных электронов взаимодействующих
атомов должны быть антипараллельны, так как. электроны, образующие связь,
с атомных орбиталей переходят на общую молекулярную орбиталь. На одной молекулярной орбитали,
также как и на одной атомной орбитали могут
находиться 2 электрона с антипараллельными спинами.
Если сближаются два атома, и одиночные электроны имеют параллельные спины, то
связь не образуется. Между такими электронами возникают силы отталкивания
и они не могут находиться на одной орбитали.
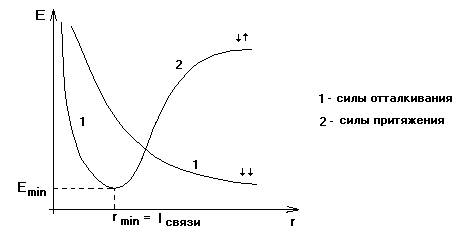
Нарисуем
энергетическую диаграмму, характеризующую изменение энергии при сближении двух
атомов водорода.
lсвязи – длина связи
l Н-Н = 0,074 нм
ЕН-Н = 431 кДж/моль
При сближении
двух атомов водорода между ними возникают силы притяжения и силы отталкивания. (силы притяжения действуют между
электроном и ядром, а отталкивания – между электронами атомов и ядрами). Если
спины одиночных электронов двух атомов водорода антипараллельны,
то при сближении двух атомов водорода преобладают силы притяжения и
потенциальная энергия системы уменьшается до некоторого минимального значения.
При дальнейшем сближении начинают преобладать силы отталкивания, т.е.
дальнейшее сближение атомов энергетически не выгодно, потенциальная энергия
начинает расти, а следовательно дальнейшее сближение
атомов невозможно.
Точка минимума
на диаграмме соответствует энергии и длине связи в наиболее устойчивом
состоянии молекулы. Если же спины электронов сближающихся атомов водорода
параллельны, то между ними действует только сила отталкивания, следовательно,
молекула не образуется.
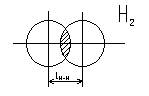
При образовании
ковалентной связи происходит перекрывание электронных облаков взаимодействующих
атомов. В результате в пространстве между ядрами образуется зона повышенной
электронной плотности.
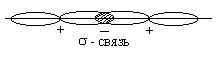
Для р-
электронных облаков возможны два типа перекрывания.
При образовании s- связи зона
повышенной электронной плотности находится на линии соединяющей ядра атомов.
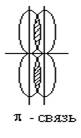
При образовании p - связи
образуются две зоны повышенной электронной плотности, которые располагаются по
обе стороны от линии, соединяющей ядра атомов.
Для описания
ковалентной связи в настоящее время пользуются двумя методами:
1) Метод валентных
связей (ВС) – описывает геометрию молекул и тип
перекрывания электронных облаков.
2)
Метод молекулярных орбиталей – основан на
построении энергетических диаграмм.
Эти два метода
применяют параллельно, т.к. они дополняют друг друга.
Основные характеристики ковалентной связи.
Длина связи -
это минимальное расстояние между ядрами атомов, соответствующее наиболее
энергетически устойчивому состоянию молекулы. Чем больше энергия связи и чем
меньше длина связи, тем устойчивей молекула.
Дипольный
момент.
Применяется для
характеристики полярности связи.
m = q*l, где q
- единичный заряд; l - длина связи.
m приводится в
таблицах. Если молекула состоит из двух атомов, то дипольный момент молекулы
равен дипольному моменту связи.
m(HCl) = m (H - Cl)
Если молекула
состоит из трех и более атомов, то дипольный момент равен векторной сумме
дипольных моментов всех связей.
m(Н2О)
= 1,84 D
m(СО2) = 0
Метод валентных
связей.
1. Определить
форму орбиталей, на которых
находятся одиночные электроны, образующие связь.
2. Изобразить
перекрывание электронных облаков.
3. Определить форму молекулы (линейная, угловая, пирамидальная) и
валентный угол (т.е. угол между связями).
1.
Линейные
молекулы (валентный угол равен 1800).
Молекула
водорода
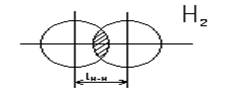
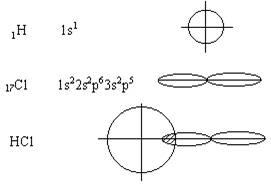
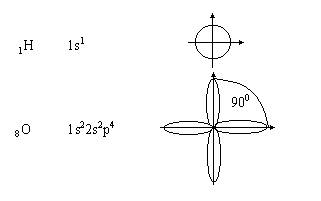
Молекула HCl
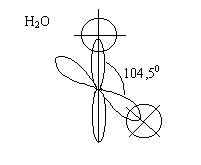
2. Угловые
молекулы (Н2О, Н2S,
H2Se, H2Te)
При образовании
молекулы воды электроны атома водорода, имеющие параллельные спины, отталкиваются и валентный угол расширяется до 104,5.
При увеличении
радиуса центрального атома силы отталкивания между электронами атомов водорода
уменьшаются и угол (B.У.) сокращается.
В.У. (Н2S) = 930
В.У. (H2Se)
= 900
В.У. (H2Te)
= 900
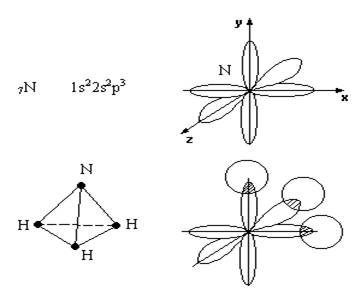
3. Пирамидальные
молекулы (NH3, PH3, AsH3…).
Ковалентность (насыщаемость)
- максимальное число ковалентных связей, которое может образовать данный атом в
основном или возбужденном состоянии. Ковалентность равна числу одиночных электронов.
Так, например
атом водорода одновалентен:
Ков Н
= 1;
Ков О = 2;
Ков N = 3.
Некоторые атомы
могут повышать свою ковалентность
за счет перехода в возбужденное состояние.
Гибридные орбитали атома Be в возбужденном
состоянии находятся под углом 1800. Гибридизация электронных облаков
сопровождается выравниваем энергии s-
и р- подуровней и
выравниваем формы электронных облаков.
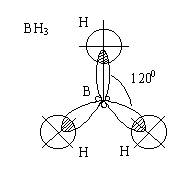
Три гибридных
электронных облака атома бора в возбужденном состоянии располагаются в
одной плоскости
под углом 1200.
ВН3 -
плоская угловая молекула с валентным углом 1200.
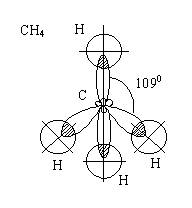
В пространстве
четыре гибридных орбитали атома углерода в
возбужденном состоянии находятся под углом 1090.
Все связи С - Н равноценны по величине энергии и длине связей,
следовательно, форма молекулы метана - тетраэдр.
Молекула этилена
С2Н4.
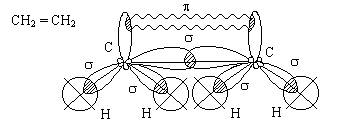
Четыре гибридных
электронных облака атома углерода располагаются в пространстве под углом 1090.
Два гибридных облака каждого из атомов углерода образуют ковалентную связь с
атомами водорода (s-связь). Еще одно гибридное
облако каждого атома углерода участвует в образовании s связи С-С и еще
одной p-связи.
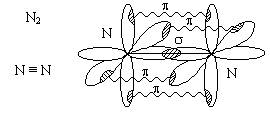
Еще один пример
- молекула азота.
Молекула азота -
прочная. Азот с трудом вступает в химические реакции. При обычной температуре
ведет себя очень инертно. Азот вступает в реакции лишь при высокой температуре
(800 - 900).
Итак, метод
валентных связей описывает геометрию молекул и позволяет сделать выводы о
некоторых свойствах молекул.
Метод
молекулярных орбиталей.
Метод молекулярных орбиталей описывает
энергетическое состояние валентных электронов в атоме.
1. Электроны в молекуле принадлежат ядрам всех атомов,
составляющих молекулу.
2. При образовании связи электроны с атомных
орбиталей переходят на молекулярные орбитали. Из двух атомных орбиталей
образуются две молекулярные орбитали. Одна из них –
связывающая, обладает энергией более низкой чем
исходные атомные орбитали (волновые функции
электронов складываются и происходит выигрыш энергии). Вторая молекулярная орбиталь – разрыхляющая, которая обладает более высоким
уровнем энергии, чем исходные атомные орбитали
(волновые функции электрона вычитаются и преобладают силы отталкивания). Из n атомных орбиталей образуется n молекулярных орбиталей.
3. Заполнение электронами молекулярных
орбиталей происходит в соответствии с теми же правилами,
что и атомных орбиталей:
1) принцип минимальной энергии (Клечковского);
2) принцип Паули;
3) правило Хунда;
4. По методу молекулярных орбиталей можно вычислить порядок связи:
p = (nсв - nразр )/ 2 , где
nсв
– число электронов на связывающей орбитали, nразр - число электронов на разрыхляющей орбитали.
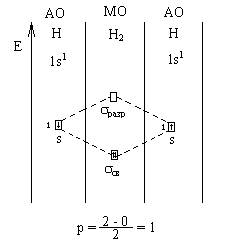
Рассмотрим молекулу водорода по методу ММО.
Вывод: связь в молекуле водорода одинарная.
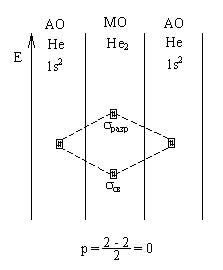
Возможно ли образование молекулы гелия Не2?
Вывод: связь не образуется.
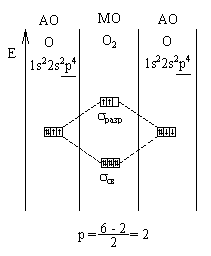
Каков порядок связи в молекулах СО и N2 ?
Вывод: в молекулах СО и N2 связь
тройная.
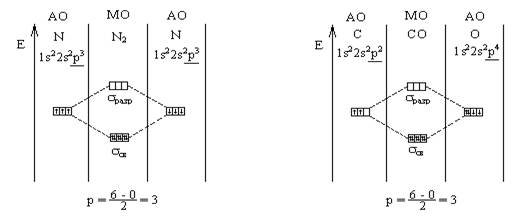
Сравнение свойств молекул СО
и N2.
|
Свойство |
СО |
N2 |
|
Длина
связи, нм |
113 |
110 |
|
Энергия
связи, кДж/моль |
1071 |
941 |
|
Температура
кипения, 0С |
83 |
78 |
|
Плотность
(в жидком состоянии), г/см3 |
0,793 |
0,796 |
Имеется две трактовки, объясняющие сходство порядка
связи и свойств молекул СО и N2.
1) В молекуле СО атом кислорода имеет два одиночных электрона,
которые могут образовать две связи с атомом углерода. Одна орбиталь
атома углерода свободна. Поэтому, один из спаренных электронов кислорода может
перейти на свободную орбиталь
атома углерода. Затем образуется еще одна связь.
2) За счет одиночных электронов атома углерода и
кислорода образуются две ковалентные связи, а третья связь донорно-акцепторная,
т.е. пары электронов атома кислорода переходят на
свободную орбиталь другого атома (углерода).
Молекула кислорода.
Метод валентных связей не объясняет парамагнитные
свойства кислорода. ММО объясняет этот факт наличием одиночных электронов.
Объяснить, почему молекула фтора F2 диамагнитна, т.е. не взаимодействует с магнитным
полем.
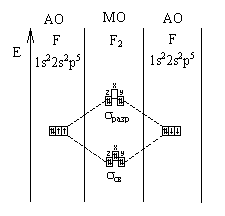
Из трех р-орбиталей две
обладают немного более низким уровнем энергии:
Таким образом, метод молекулярных орбиталей
дает дополнительную информацию о свойствах молекул, тогда как метод валентных
связей иногда не может объяснить некоторых различий. Метод ММО всегда дает
соответствие с экспериментальными данными.
|
|
N2 |
О2 |
F2 |
|
Энергия
связи, кДж/моль |
940 |
420 |
180 |
|
Длина
связи, нм |
0,011 |
0,012 |
0,014 |
|
Порядок
связи |
3 |
2 |
1 |
Чем больше порядок (кратность связи), тем больше
энергия связи, тем меньше длина связи, тем прочнее молекула.
Донорно-акцепторная
связь.
Или донорно-акцепторный механизм образования
ковалентной связи.
В случае донорно-акцепторной связи один из атомов,
образующих связь (донор электронов), предоставляет пару электронов, а другой
атом (акцептор электронов) предоставляет свободную орбиталь.
Схемы образования ковалентной и донорно-акцепторной
связи
Ковалентная связь: А· + хВ Þ ![]() Þ А-В
Þ А-В
Донорно-акцепторная связь: ![]() + ðВ Þ
+ ðВ Þ ![]() Þ А®В
Þ А®В
Классическим примером образования донорно-акцепторной
связи является ион аммония:
NH3 +H+
= NH4+
Атом азота в молекуле аммиака предоставляет свободную
пару электронов.
Все четыре связи N - Н в ионе равноценны по величинам энергии и длине
связи. Этот факт еще раз подтверждает, что донорно-акцепторная связь отличается
от ковалентной лишь происхождением общей электронной пары.
Чаще всего донорно-акцепторная связь встречается в
комплексных соединениях.