Комплексные
соединения. Строение комплексных соединений с позиций метода ВС
и теории кристаллического поля.
Теория
кристаллического поля.
Теория кристаллического поля (ТКП) основана на электростатической
модели Косселя и Магнуса,
но учитывает возможные изменения строения электронных оболочек
комплексообразователя под влиянием лиганда. Также как
и в кристаллах, ион комплексообразователя окружен соседними частицами.
Первоначально ТКП была применена к кристаллам , а
затем перенесена на комплексные соединения.
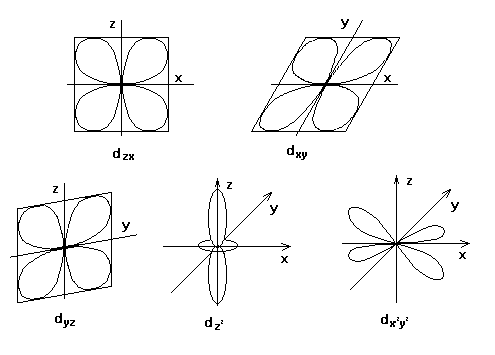
ТКП учитывает действие поля лигандов
на d-орбитали комплексообразователя.
d-орбитали имеют 5 различных
ориентаций в пространстве:
В свободном атоме или ионе энергия всех d-орбиталей одинакова, в том случае, если мы рассматриваем один и тот же энергетический
уровень. В комплексном ионе лиганды обращены своим отрицательным концом к комплексообразователю.
Между электронами комплексообразователя и лигандов
начинают действовать силы отталкивания. Это приводит к увеличению потенциальной
энергии d-электронов. Чем ближе d-орбитали комплексообразователя
располагаются к лигандам, тем в большей степени
возрастает энергия d-электронов. Если
d-орбитали
более удалены от лигандов, то энергия тоже
возрастает, но в меньшей степени. В результате под действием поля лигандов происходит расщепление энергетических уровней d-орбиталей. Появляются
высокие и низкие по запасу энергии d-орбитали.
Рассмотрим октаэдрическое
строение комплексных связей. При октаэдрическом
окружении комплексообразователя наиболее близко к вершинам октаэдра располагаются
3dz2 и 3dx2y2 орбитали. Следовательно, в
этом случае силы отталкивания возрастают в большей степени, чем для остальных 3d-орбиталей, которые располагаются
дальше от вершины октаэдра(3dyz, 3dxy, 3dyz орбитали).
Наблюдается следующее расщепление энергетических
уровней:
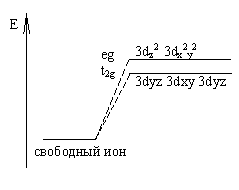
При образовании донорно-акцепторной связи пары
электронов от лигандов переходят на свободные орбитали комплексообразователя. Причем в первую очередь
будут заполняться те орбитали, у которых уровень
энергии ниже. При октаэдрическом окружении в первую
очередь начнут заполняться 3dyz, 3dxy, 3dyz орбитали.
При тетраэдрическом окружении комплексообразователя
оказывается, что ближе к вершинам
тетраэдра располагаются 3dyz, 3dxy, 3dyz орбитали. Следовательно,
они будут обладать более высоким энергетическим уровнем, чем 3dz2 и 3dx2y2 орбитали. В этом случае
расщепление энергетического уровня будет выглядеть следующим образом:
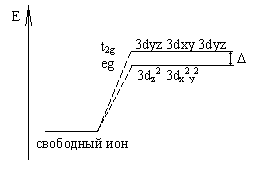
D - энергия расщепления энергетических уровней.
Энергия расщепления энергетических уровней зависит от
природы лигандов. Существуют лиганды,
оказывающие более сильное действие (сильное поле лигандов), а есть такие, которые оказывают более слабое
действие (слабое поле лигандов). В соответствии с
этим, все лиганды располагают в определенный ряд, называемый
электрохимический ряд лигандов:
CN- >
NO2 - > SCN- > H2O > F-
> OH- > Cl- >
Br-- > J-
В случае расщепления энергетических уровней d-орбиталей отражение света
этими соединениями таково, что появляется окраска. Именно в ионах d-элементов происходит расщепление энергетических
уровней, поэтому чаще всего ионы d-элементов окрашены, особенно в том случае,
если имеются свободные d-орбитали.
Так ион Сu+ не
окрашен, Zn2+ не имеет окраски, так как d-подуровень у них полностью завершен.
Если в комплексном соединении наблюдается sp или sp3 гибридизация, то расщепления энергетических уровней не происходит и
соединения не окрашены (т.к. sp и sp3 гибридные
облака не равноценны).
При образовании донорно-акцепторной связей электроны лигандов в первую очередь заполняют d-орбитали с более низким
уровнем энергии. При октаэдрическом окружении
образуется три орбитали с более низким уровнем
энергии eg. Если
число электронов не превышает число d-орбиталей с низкой
энергией, то они располагаются на этих орбиталях.
Если же число электронов превышает число орбиталей с
низкой энергией, то возможны два варианта:
1)
электроны от лиганда пойдут на орбитали более
низкой энергии и произойдет спаривание электронов;
2)
электроны пойдут
на более высокие по запасу энергии орбитали и
большинство электронов по возможности будут одиночными (в соответствии с
правилом Хунда).
Для того чтобы перевести электрон с орбитали, где он один, на другую орбиталь, где уже имеется электрон, необходимо затратить
некоторое количество энергии. Она обозначается Р.
Р определяется квантово-механическим расчетом. В
зависимости от соотношения энергии Р и D могут получаться комплексы с большим значением
спинового квантового числа (большое число одиночных электронов) или с низким
значением суммарного спинового квантового числа. Говорят, что образовалось высокоспиновое или низкоспиновое
состояние. Это зависит от природы иона комплексообразователя и от природы лигандов.
Если
энергия Р превышает энергию D, то электроны пойдут на расщепленные более высокие
энергетические уровни (высокоспиновое состояние).
Если энергия D больше, чем энергия Р, то электроны не смогут
перейти на более высокий из расщепленных энергетических уровней и начнется спаривание
электронов на более низком из энергетических уровней (низкоспиновое
состояние). От этого зависят магнитные и другие свойства комплексных
соединений.
Комплексные
(координационные) соединения
Во второй половине прошлого века швейцарский ученый
Вернер предложил теорию строения комплексных соединений ,
так называемую, координационную теорию. По этой теории вокруг центрального
иона-комплексообразователя координируются отрицательно заряженные ионы или
полярные молекулы - лиганды. Количество лигандов, расположенных вокруг иона-компексообразователя
Вернер назвал координационным числом. Ион - комплексообразователь вместе с лигандами составляют внутреннюю сферу комплексного
соединения. Вокруг внутренней сферы располагаются ионы внешней сферы, имеющие
противоположный заряд. Теория Вернера описывала лишь структуры комплексных
соединений, но теорию химической связи не давала. Вернер исследовал большое
число комплексных соединений и
экспериментальным путем доказал их строение.
Различные классы комплексных соединений:
1)
Кислоты.
Например, Н2[PtCl6], H2[SiF6], H[AuCl4].
2)
Основания.
Например: [Cu(NH3)2](OH), [Cu(NH3)4](OH)2, [Ag(NH3)2]OH.
3)
Соли. Например: [Ni(NH3)6]SO4, Na2[Zn(OH)4].
4)
Неэлектролиты. Например: [Pt(NH3)2Cl2], [Fe(CO)5].
Существует также классификация комплексных соединений
по типу лигандов:
1)
Комплексные
аммиакаты (NН3 - лиганды): [Co(NH3)6]Cl2;
2)
Комплексные гидроксо-соединения (ОН - лиганды): Na[Al(OH)4];
3)
Аква-комплексы (Н2О - лиганды):
[Al(H2O)6]Cl3;
4)
Ацидо-комплексы (F-, Cl-, SO32-, CN-): K4[Fe(CN)6].
Существует номенклатура комплексных соединений.
В 1916 году немецкие ученые Коссель
и Магнус предложили теорию химической связи в
комплексных соединениях. Они объясняли химическую связь электростатическим
притяжением между комплексообразователем и лигандами
(отрицательно заряженные ионы или полярные молекулы притягиваются к иону - комплексообразователюю, который обычно имеет положительный
заряд). Между частицами лигандов действуют силы
отталкивания, т.к. они своим отрицательным зарядом стремятся как можно ближе подойти
к иону комплексообразователя. Чем больше лигандов окружает
оружает комплексообразователь, тем сильнее происходит
отталкивание. На основании закона Кулона Коссель и Магнус рассчитали энергию связи лигандов
с комплексообразователем. В этих расчетах
они принимали комплексообразователь
и лиганды за недеформируемые заряженные шары.
Они рассчитали наиболее вероятное значение координационных чисел (К.ч.) для
различных комплексообразователей (к-о).
Например, если комплексообразователь имеет валентность, равную 1, то наиболее
вероятное значение координационного числа 2 или 3. Если валентность равна 2, то
координационное число 4 или 3. При валентности, равной 3 координационное число
6 или 4. Чаще всего К.ч. = 2*Вк-о.
В действительности координационное число не может
определяться лишь валентностью комплексообразователя, так как оно зависит от
размера иона комплексообразователя, от размера и природы лигандов,
от концентрации раствора.
Координационные числа определяются опытным путем и
часто совпадают с рассчитанными Косселем
и Магнусом.
Координационное число 8 встречается очень редко. Оно
наиболее вероятно для ионов-комплексообразователей f- и d-элементов
шестого периода.

В теории Косселя и Магнуса не рассматривается пространственное строение
комплексных соединений и, исходя из положения этой теории о том, что комплексообразователи
и лиганды представляют собой недеформируемые шары,
вытекает, что при комплексном числе 4 лиганды должны
располагаться в пространстве по вершинам тетраэдра. В действительности иногда
оказывается, что при комплексном числе 4 комплексное соединение имеет форму
искаженного тетраэдра или плоско-квадратное строение. Для комплексов обнаружена
цис-
и транс-изомерия.
В том случае, если бы мог существовать только
тетраэдр, цис- и транс-изомеры не могли
возникнуть, так как все четыре вершины тетраэдра равноценны.
Вторым недостатком этой теории является то, что она не
могла объяснить магнитные свойства молекул комплексных соединений, т.е. наличие
(отсутствие) одиночных электронов (по этой теории считалось, что электронное
строение комплексообразователя не изменяется при образовании комплекса).
Современная теория строения комплексных соединений
использует положения квантовой химии и объясняет природу химических свойств комплексных
соединений. Для этого используются: метод валентных свойств, теория кристаллического
поля, метод молекулярных орбиталей.
Экспериментальным путем были установлены
пространственная форма молекул комплексных соединений с различными
комплексообразователями и соответствующие им типы гибридизации:
|
Тип гибридизации |
Форма молекул |
Комплексообразователь |
|
sp |
линейная |
Ag+, Cu+ |
|
sp3 |
тетраэдрическая |
Al3+, Zn2+,
Co2+, Fe2+, |
|
dsp2 |
плоско-квадратная |
Pd2+, Au3+ |
|
sp3d2 |
октаэдрическая |
Ni2+, Cr3+,
Co3+, Ni3+, Pd4+ |