Окислительно-восстановительные
реакции. Направление их самопроизвольного протекания. Окислительно-восстановительные
потенциалы. Зависимость окислительно-восстановительных потенциалов от концентрации
растворов и рН среды.
Электрохимические
свойства растворов
Электрохимические равновесия – это равновесия, происходящие на границе раздела
«металл – раствор электролита». Эти процессы либо сопровождаются возникновением
электрического тока, либо происходят под действием тока.
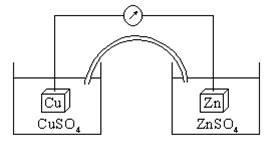
Гальванический элемент состоит из двух электродов,
опущенных в раствор электролита и соединенных проводником, существует для
преобразования энергии химических реакций в электрический ток.
Элемент Даниеля – Якоби:
Cu2+ +
2e- ® Cu
Zn
- 2e- ® Zn2+
![]()
анод (-) Zn | ZnSO4 ||
CuSO4 | Cu (+) катод
Zn + CuSO4
= ZnSO4 + Cu
Если ![]() процесс протекает
самопроизвольно.
процесс протекает
самопроизвольно.
![]()
n – число электронов в
реакции;
F – число Фарадея;
![]() - ЭДС гальванического
элемента.
- ЭДС гальванического
элемента.
![]()
Рассмотрим
процессы, происходящие с системе,
если пластину металла опустить в раствор электролита.
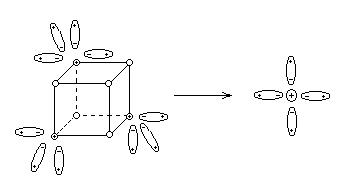
В
узлах кристаллической решетки металла находятся атомы, ионы и свободные
электроны.
Ионы
металла уходят в раствор, следовательно, металл заряжается отрицательно, а раствор
положительно.
Мекр. + mН2Ор-р = Меn+×mН2Ор-р + nе
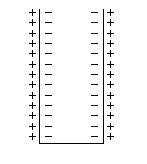
При
некотором количестве ионов перешедших в раствор наступает равновесие, которое
зависит от природы металла, температуры, концентрации ионов
металла, концентрации свободных электронов в металле. Это равновесие определяет
все процессы на границе раздела. На границе раздела «металл – раствор электролита» возникает «двойной электрический
слой», следовательно, возникает разность потенциалов, называемая электродным
потенциалом.
На
пластике меди отрицательный заряд будет
меньше, чем на пластинке цинка. Процессы выравнивания концентрации
электронов происходят мгновенно. Реакция прекращается при израсходовании
электролита (или металла).
Измерение электродных потенциалов
Непосредственно
измерить электродный потенциал сложно, поэтому все электродные потенциалы
сравнивают с каким-либо одним («электродом сравнения»). В качестве такого
электрода используют обычно так называемый водородный электрод.
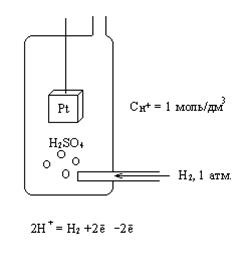
Водородный электрод:
Вид
процесса на поверхности Pt зависит от
второго электрода. Если электрод активный, то происходит окисление, если
малоактивный, то восстановление.
![]()
ЭДС
гальванического элемента, состоящего из водородного и исследуемого электродов, измеренная при стандартных условиях называется стандартным электродным потенциалом
данного металла. Стандартные электродные потенциалы зависят от природы
металлов, концентрации раствора и температуры и имеются в таблицах.
Эта
зависимость определяется формулой Нернста:
![]()
![]()
Окислительно-восстановительные
процессы.
Окислительно-восстановительные
реакции это реакции, протекающие с изменением
степеней окисления. В реакции участвуют окислитель, восстановитель и среда.
Обычным методом, описывающим протекающие процессы является электронно–ионный.
K2Cr2O7
+ 3H2S + 4H2SO4 = 3S + Cr2(SO4)3
+ K2SO4 + 7H2O
![]() 3 H2S – 2e- ® So + 2H+ окисление, Н2S – восстановитель;
3 H2S – 2e- ® So + 2H+ окисление, Н2S – восстановитель;
1 Cr2O72- + 14H+ + 6e- ® 2Cr3+ + 7H2O восстановление, Cr2O72- - окислитель.
Если
среда раствора кислая, то для уравнивания используются Н+ и Н2О;
если щелочная, то ОН- и Н2О.
3H2S + Cr2O72-
+ 14H+ ® 3S + 6H+
+ 2Cr3+ + 7H2O
3H2S + Cr2O72-
+ 8H+ ® 3S + 2Cr3+ +
7H2O
Направление
самопроизвольного протекания окислительно-восстановительных реакций.
По
аналогии со стандартным электродным потенциалом металла можно ввести понятие
стандартного окислительно-восстановительного потенциала, т.е. потенциала
восстановительной полуреакции (есть в таблицах).
Если ![]() , то процесс протекает самопроизвольно.
, то процесс протекает самопроизвольно.
![]() ,
,
т.е.
для самопроизвольного процесса необходимо условие:
![]()
![]()
![]()
![]() - условие
самопроизвольного протекания о/в процесса.
- условие
самопроизвольного протекания о/в процесса.
В большинстве
случаев для определения направления процессов достаточно воспользоваться
стандартными потенциалами, так как концентрация реагирующих веществ влияет незначительно (в пределах 0,1 – 0,2 В).