Пятая группа
Периодической системы Д.И.Менделеева – ванадий, ниобий, тантал.
|
|
V |
Nb |
Ta |
|
|
d34s2 |
d45s1 |
d36s2 |
|
ra,нм |
0,134 |
0,146 |
0,146 |
|
Ст.ок. |
5+,
4+ |
[5+],
3+, 0 [5+], 0 |
3+,
2+, 0 |
|
Коорд.ч. |
4,
5, 6 |
6,
7, 8 |
6,
7, 8 |
По группе повышается устойчивость высших степеней
окисления.
Химические
свойства металлов.
Очень много общего с элементами подгруппы Ti. На воздухе V, Nb, Ta покрываются оксидно-нитридно-карбидной пленкой. В отсутствие этой
пленки металлы ведут себя как активные. Измерение электронных потенциалов производится
при постоянной зачистке поверхности.
V, Nb, Ta при обычной t не реагируют с водой, соляной кислотой, серной кислотой,
азотной и NaOH
(т.к. защитная) лишь HF и царская водка могут разрушать защитную пленку.
2V + 6H2F2
+ 2H3[VF6] + 3H2
Nb и Тa реагируют с H2F2очень
медленно, для Та получается H3[TaF8].
3V + 12HCl + 4HNO3
= 3VCl4 +4NO + 8H2O
При нагревании до 400-500оС порошкообразный
V реагирует с О2:
4V + 5O2
2V2O5
4Nb + 5O2
2Nb2O5
При нагревании защитная пленка растрескивается и V может
реагировать с азотной кислотой, серной кислотой и NaOH(конц.)
2V + 3H2SO4
(к) 2(VO)SO4 + 2SO2 + 3H2O
cульфат ванадия
V + 6HNO3
(к) (VO2)NO3 + 5NO2 + 3H2O
нитрат ванадия
4V + 4NaOH + 5O2
4NaVO3
+ 2H2O
Nb, Ta – аналогично.
Для V5+ характерны соединения, где он входит в состав катиона
VO2+, и где он входит в состав анеона
VO3-. Таким образом соединения V5+ амфотерны.
Окраски
растворимых соединений V.
VO2+ - желтый
VO+ - синий
V3+ -
зеленый
V2+ - фиолетовый
Оксиды
и гидроксиды.
2+ V(OH)2
и VO – основной характер, V2+ -
сильно гидратирован.
[V(H2O)6]2+
[V(H2O)6]SO4
+ 2NaOH = V(OH)2
¯ +Na2SO4
+ 6H2O
V(OH)2 + H2SO4
[V(H2O)6]SO4
V(OH)2 + NaOH ¹
V2+
неустойчивая cтепень окисления, под действием О2 переходит в
4+.
2V(OH)2 +
2O2 + 10H2O = 2[VO(H2O)5(OH)2]
V2O3 и V(OH)3
– основной характер, ион V3+ гидратирован, координ.число. = 6.
[V(H2O)6]2(SO4)3
+ 6NaOH = 2V(OH)3 ¯ + 3Na2SO4
+ 12H2O
2V(OH)3 +
3H2SO4 = [V(H2O)6]2(SO4)3
V(OH)3 + NaOH ¹
V(OH)3
- на воздухе окисляется.
4V(OH)3 + O2
+ 8H2O = 4[VO(H2O)5](OH)2
VO2 – амфотерный
оксид.
V(OH)4, H4VO4¯ - гипованадиевая кислота,
желтый осадок.
Амфотерность VO2 может быть выражена схемой:
VO-4
VO2 VO+
VO2 – реагирует с кислотами и с щелочами.
VO2 + H2SO4
+ 4H2O = [VO(H2O)5]SO4
VO2 +
4NaOH = Na4VO4
+ 2H2O
VO44- - способен к реакция полимеризации за счет реакций оляции и оксоляции, этому способствует
щелочная среда.
4VO2 +
2NaOH = Na2[V4O9]
Реакция VO2 cо щелочью идет легче, чем с кислотой т.е. оксид
является амфотерным с преобладанием кислотных
свойств.
V2O5
V2O5 - cвежеприготовленный и стоявший ведут себя по разному
(V2O5 свежеприготовленный более химически активен):
NaVO3 + H2SO4
= V2O5 × H2O +
Na2SO4
V2O5
+ 2NaOH 2NaVO3 + H2O
2NH4VO3
V2O5 +
2NH3 + H2O
V2O5 + H2SO4 = (VO2)2SO4 + H2O - характер амфотерный
Преобладают кислотные свойства.
V2O5 менее устойчив, чем VO2 и при t > 650oC
V2O5 = 2VO2 + O
Наиболее устойчивым соединением из всех соединений
ванадия является
[VO(H2O)5]SO4 -
сульфат пентаакваоксо V (IV)
Катион [VO(H2O)5]2+
- не разрушается ни при действии сильных оснований, ни сильных кислот.
[VO(H2O)5]SO4
+ 2NaOH = [VO(H2O5)](OH)2
+ Na2SO4
[VO(H2O)5](OH)2 + H2SO4 = [VO(H2O)5]SO4
+ 2H2O
Во влажной атмосфере V2O5 полимеризуется и
превращается в труднорастворимую кислоту H4[V10(H2O)28]
Наиболее устойчив NH4VO3. Насыщенные растворы этого вещества склонны к пересыщению и для начала кристаллизации необходимо добавить
кристаллик NH4VO3 или
потереть стеклянной палочкой о стенку сосуда.
NaVO3 + NH4Cl = NH4VO3
¯ + NaCl
Для Nb и Ta характерна
лишь степень окисления 5+, т.е. оксиды. Nb2O5 и Ta2O5 с кислотами не реагируют. Это весьма инертные вещества и со щелочами реагируют
лишь при сплавлении.
Nb2O5 +
6NaOH 2Na3NbO4 + 3H2O
Nb2O5 и Ta2O5 имеют
ярко выраженный кислотный характер.
Окислительно-восстановительные свойства.
V4+ -
устойчивая степень окисления и соединения V4+ слабые
окислители и слабые восстановители.
Соединения V5+ - сильные окислители.
V2O5
+ 6HCl = Cl2 + 2VOCl2 + 3H2O
2NaVO3 +
3Zn + 6H2SO4 = 2VOSO4
+ 3ZnSO4 + Na2SO4 + 6H2O
Соединения V2+ - сильные восстановители:
2VCl2 +
2HCl = H2 +
2VCl3
16VSO4 +
2KNO3 + 10H2SO4 = (NH4)2SO4
+ 8V2(SO4)3 + K2SO4
+
+ 6H2O
Осаждение
ванадатов.
Подавляющее большинство ванадатов не растворимы в воде, растворимы только V щелочных
металлов и аммония.
2NaVO3 + BaCl2
= Ba(VO3)2¯ + 2NaCl –
осадок белого цвета
NaVO3 + FeCl3 = Fe(VO3)3 ¯ + NaCl – осадок от желтого до красного цвета
NaVO3 + AgNO3 = Ag(NO3) ¯ + NaNO3 - осадок
от желтого до красного цвета
NaVO3 + Hg(NO3)2 = Hg(VO3)2
¯ + NaNO3 - осадок
белого цвета
NaVO3 + Pb(NO3)2 = Pb(VO3)2 ¯ + NaNO3 - осадок
от желтого до красного цвета
Полимеризация
ванадатов.
В сильнощелочной среде (рН
> 13,5) полимеризация не наблюдается. При рН <
13,5 происходит полимеризация ваннадатов, т.к.
возможно образование оловых и оксо-мостиков.
H3VO4
= 3H+ + VO43-
В кислой среде возможно присоединение Н+ (протонизация)
Если еще подкислить среду и увеличить концентрацию
ванадата, то далее идет отщепление молекулы Н2О.
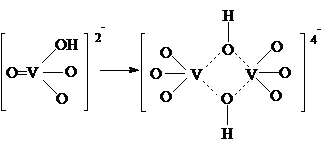

Могут получиться три- и тетрамеры.
Образование полимеров происходит только в концентрированных
растворах, а в разбавленных растворах соединения V5+ мономерны.
Диаграмма состояния соединений V5+
в растворах.
Перекисные соединения. При добавлении Н2О2 в раствор V5+
щелочных электролитов усиливается окраска и образуется пероксокомплексы:
HVO3 + H2O
= HVO2[O 22-] + H2O
H3VO4
+ H2O = H3VO3[O
2]2- + H2O