Восьмая,
девятая, десятая группы Периодической системы Д.И.Менделеева
Общая характеристика железа, кобальта,
никеля.
Электронное строение:
Fe: 3d6 4s2
Co: 3d7 4s2
Ni: 3d8 4s2
Характерные степени окисления:
Fe: +2, +3, +6
Co: +2, +3
Ni: +2, +3
Природные
ресурсы.
Железо –
4-й элемент по распространенности в земной коре после кислорода, кремния и
алюминия)
Железо = 4,56 %,
кобальт = 4·10-3 %,
никель = 8·10-3 %.
Железо может встречаться в самородном состоянии
метеоритного происхождения.
Fe3O4 – магнитный железняк, Fe2O3
– красный железняк; Fe3O3 х H2O
– бурый железняк; FeS2 – пирит; FeCO3 – сидерит.
Кобальт и никель образуют мало
самостоятельных материалов. Встречаются в полиметаллических рудах.
CoAsS - кобальтовый блеск; (Fe, Ni) S8 – железо-никелевый
колчедан; NiAs - никелин.
Получение.
Восстановление из оксидов
железа углем:
Fe2O3 + 3C = 2Fe + 3CO
При этом получают чугун,
содержащий до 3% углерода. Из чугуна сталь
получают двумя способами.
Конверторный способ выплавления стали:
C + O2 = CO2
(выжигают уголь, при этом окисляются и другие примеси). Образующиеся оксиды
реагируют с оксидом кальция, образуя шлаки.
CaO + CO2 = CaCO
CaO + SiO2 = CaSiO3
Мартеновский способ:
Чугун расплавляют струей
горящего природного газа.
Производство кобальта и
никеля – процесс очень сложный. Первоначально выделяют их оксиды из руд пирометаллургическим
или гидрометаллургическим методом, которые восстанавливают водородом или
алюмотермией:
NiO + H2 = Ni + H2O
NiO + Al = Ni + Al2O3
Свойства.
Эти металлы имеют различные
свойства, хотя стоят последовательно.
ЖЕЛЕЗО:
Модификации железа:
a - Fe ® b - Fe ® g - Fe ® d - Fe
tпл. =769o 910o 1400o
Они отличаются строением
кристаллических решеток и магнитными свойствами:
a - Fe –ферромагнетик,
обладает самопроизвольной намагниченностью.
b , g , d - Fe – парамагнетики (их
магнетизм проявляется в магнитном поле)
a - Fe -
объемно-центрированная кубическая решетка.
b - Fe - кубическая, g - Fe – гранецентрическая,
d - Fe – объемно –
центрированная кубическая решетка
Железо – это металл средней
активности, покрывается пленкой (пассивируется), но в
присутствии влаги окисляется: Fe2O3 ×хH2O. В мелко раздробленном состоянии
железо объединяется со многими неметаллами с образованием:
a) твердых растворов: C, Si, N,
B, Р ;
b) металлоподобных соединений: Fe3C, Fe3Si,
Fe3P, Fe4N
c) солеподобных соединений: FeCl3 , FeS.
Железо достаточно активно
реагирует с кислотами 1-го рода, обладает отрицательным потенциалом:
Fe + 2HCl = FeCl2 + H2
Потенциал железа: Е0 Fe2+/Fe0 = -0,44В
В HNO3 (конц) и H2SO4 (конц)
пассивируется (Fe3O4) –
покрывается защитной пленкой, но при нагревании пленка растворяется:
Fe + HNO3 (конц) .
t > Fe(NO3)3 + NO2 + H2O
Fe + H2SO4 (конц) .
t > Fe2(SO4)3 + SO2
+ H2O
Соединения железа.
Железо, кобальт и никель
образуют комплексы, в которых их степени окисления = 0.
Fe(0):
Fe(CO)5 – пентакарбонил
железа, довольно устойчивое соединение.
Fe (твердое вещество) + СО
(газ) . t, P > Fe(CO)5 (жидкость)
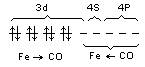
- по донорно–акцепторному механизму.
При нагревании:
Fe(CO)5 . t=300
> Fe + 5CO (способ получения
чистейших металлов)
Fe(II):
FeO - черный, Fe(OH)2
–светло-зеленый, FeS¯, FeCO3 – светло-зеленый, FeSO4
Растворимые в воде соли Fe(II) имеют светло-зеленую окраску, склонны к образованию аква - комплексов.
[Fe2+(H2O)6]
– бледно-зеленый.
Оксид и гидроксид
Fe(II) обладают основным характером, но имеется слабо
выраженная амфотерность.
FeO + 2HCl = FeCl2 + H2O
Fe(OH)2 + 2HCl = FeCl2 + 2 H2O
Fe(OH)2 + 4NaOH(конц.) Na4[Fe(OH)6]
Получение аммино-комплексов:
FeCl2 + 6NH3 . спирт > [Fe(NH3)6]Cl2
[Fe(NH3)6]Cl2
+ H2O ® Fe(OH)2
+ 2NH4Cl + 4NH3
Аммиакаты –
неустойчивы, как и гидроксо - комплексы. Устойчивыми
являются цианидные комплексы Fe(II).
FeCl2 + 2KCN ® Fe(CN)2
¯+ 2KCl
Fe(CN)2 + 4KCN ®K4[Fe(CN)6]
– желтая кровяная соль
Гексацианоферрат (II) калия –
достаточно устойчивое соединение:
K4[Fe(CN)6] + 4HCl = H4[Fe(CN)6] + 4KCl железосинеродистая
кислота
K4[Fe(CN)6] + FeCl3 ® KFe3+[Fe2+(CN)6]¯ + 3KCl - качественная реакция на Fe(III) берлинская лазурь (ярко синяя)
Fe(II) легко окисляется кислородом воздуха:
Fe(OH)2 + O2 + H2O
® Fe(OH)3
бледно-зелен. бурый
Более устойчивы двойные соли
железа:
(NH4)2
Fe2+(SO4)2 – железо-аммонийные квасцы (соль Мора)
Сульфат железа в растворе
быстрее окисляется.
Fe(III):
Fe2O3
, Fe(OH)3 – обладают амфотерным
характером.
Основные свойства:
Fe(OH)3¯+ 3HCl ® FeCl3 + 3H2O
[Fe3+(H2O)6]
– светло-фиолетовый
Ионы железа сильно гидролизованы.
FeCl3 + H2O ® FeOHCl2
+ HCl
Fe(OH)2Cl . t >
Fe2O3 × хH2O¯
(FeOH)2+
- бурый
При нагревании гидролиз идет
до конца с выпадением осадка гидроксида железа(III).
Кислотные свойства:
Fe(OH)3¯+ NaOH ® Na3[Fe(OH)6]
Fe2O3 + NaOH (кр.) . t
> NaFeO2 (феррит) + H2O
Ферриты легко гидролизуются в воде (и без нагревания).
NaFeO2 + H2O = Fe(OH)3
¯+ NaOH
Склонны к образованию анионных комплексов:
FeCl3 + 6KCN ® K3[Fe3+(CN)6] + 3KCl
– качественный реактив на Fe(II)
красная кровяная соль
K3[Fe(СN)6] + FeSO4
®
KFe2+[Fe3+(CN)6]¯ + K2SO4
синий цвет (турнбуллева
синь)
KFe2+[Fe3+(CN)6]
и KFe3+[Fe2+(CN)6] имеют одинаковый состав
(это одно и то же соединение) Þ K[Fe2(CN)6]-
Fe(III) может быть и окислителем, и восстановителем, но
чаще является окислителем: Fe3+Cl3 + KI1- ® Fe2+I2 + I2 + KCl
FeCl3
+ H2S2- ® FeS + S0 + HCl
Fe(VI):
Получают окислением железа
(III):
Fe23+O3
+ KOH + KNO3 (сильн.окислитель)
® K2Fe+6O4
(феррат)+ KNO2 + H2O
Степень окисления +6 для
железа не характерна.
K2Fe+6O4 + H2O ® Fe(OH)3
+ KOH + O2
K2FeO4 + H2SO4
(конц.) ® Fe2O3
+ K2 SO4 + O2 + H2O
Железная кислота в водном
растворе не существует.
Свойства кобальта.
В свободном состоянии
кобальт – серебристо-белый металл с желтым оттенком. По сравнению с железом, он
более твердый и хрупкий, менее активен, чем железо. Реагирует с неметаллами при
нагревании:
2Co + O2 . t = 300 > 2CoO
Co + 2HCl = CoCl2 + H2
Кобальт образует соединения
в степени окисления = 0
Co(0):
Co2о(CO)8
– октакарбонил, оранжевое кристаллическое вещество
Co + CO (t=200о, P=2,5 атм)® Co2(CO)8
– менее устойчивый
Co2(CO)8 . t=60
. > 2Co + 8CO
Строение аналогично железу
(по донорно-акцепторному механизму).
Co(II): -
наиболее характерная степень окисления.
СоО – серо-зеленый оксид, амфотерный.
Со + О2 (t)= CoO
Co(OH)2 (t)= CoO
+ H2O , CoCO3 (t)=
CoO + CO2
Co(OH)2 – гидроксид
– амфотерный, с преобладанием основных свойств.
CoCl2 + 2NaOH = Co(OH)2 ¯ + 2NaCl
Существует в виде двух
модификаций:
-
свежеполученный –
синий,
-
при нагревании
переходит в розовый:
[Co2+(H2O)6]
– ярко-розовый.
CoCl2 (безводный)
– синий.
CoCl2 × 6 H2O – розовый
CoCl2 × 6H2O . t > CoCl2 × 4H2O (розовый) . t > CoCl2 × 2H2O(фиолетовый) . t > CoCl2 × H2O (голубой) . t>140 > CoCl2 (голубой,
безводный)
Соединения Co(II) склонны к
образованию комплексов:
CoCl2 + NH3 ___ спирт > [Co(NH3)6]Cl2
[Co(NH3)6]Cl2
+ H2O = Co(OH)2 + 2NH4Cl
+ NH3
[Co(NH3)6]2+ +
O2 + H2O ® [Co(NH3)6]3+
+ 4OH-
Co(OH)2 – обладает слабо выраженной
амфотерностью. Образует комплексы со щелочами:
Co(OH)2 + 2NaOH(конц) . t >
Na2[Co(OH)4]
Анионные комплексы
образуются при взаимодействии хлорида кобальта с хлоридами щелочных металлов: CoCl2 + 2KCl Û K2 [CoCl4]
Анионные комплексы
неустойчивы. Но известен устойчивый анионнный комплекс
– цианидный:
CoCl2 + 4KSCN = K2[Co(SCN)4]
+ 2KCl
(синий)
– аналитическая реакция для
обнаружения Со(II).
K2[Co(SCN)4] + H2O
® [Co(H2O)6]2+(SCN)2
+ 2KSCN
синий розовый
Co(III).
Не характерны бинарные
соединения, т.к. Co(III) – сильный окислитель.
4[Co(H2O)6]3+
+ 2H2O ® 4[Co(H2O)6]2+
+ O2 + 4H+
Устойчивы комплексные
соединения Co(III):
Катионный комплекс:
[Co(NH3)6](OH)3 - устойчив к
действию кислот
желт.
Анионный комплекс:
K3[Co(CN)6] – устойчив, получают при взаимодействии
CoCl2 с KCN в присутствии
кислорода:
2 H2O + 4CoCl2 + 24 KCN + O2 ® 4K3[Co(CN)6]
+ 4KOH + 8KCl
K3[Co(NO2)6]¯ - это комплексное соединение используют для обнаружения
ионов калия.
Свойства никеля:
Никель – серый блестящий
металл.
Характерная степень
окисления +2.
Соединения Ni+2 –
достаточно устойчивы. Никель менее активен, чем железо и кобальт. Его
электродный потенциал отрицательный Þ при взаимодействии с кислотами выделяется водород.
Кислородом воздуха никель
окисляется при нагревании:
2 Ni + O2 ___t=500
> 2 NiO
С элементами - S, N2 , H2 , Hal2 - никель реагирует при нагревании, образуя нестехиометрические
соединения.
Характерны комплексы, где Ni(0) : Ni(CO)4
Ni + 4CO ___t=60-80 >
Ni(CO) (бесцветная жидкость) __t>180
> Ni + 4CO
Ni(II):
NiO, Ni(OH)2
– зеленого цвета – обладают основным характером.
Ni(OH)2(t) = NiO + H2O; NiCO3(t) = NiO + CO2
Ni(NO3)2(t) = NiO + NO2 +O2
Гидроксид никеля в воде не растворим и
получается косвенным путем:
NiCl2 + NaOH = Ni(OH)2
¯ + 2NaCl
NiO + H2SO4 = NiSO4
+ H2O
Ni(OH)2 + 2HCl = NiCl2 + 2H2O
Он обладает склонностью к
образованию комплексов:
Ni(OH)2 + NH3 --> [Ni(NH3)6](OH)2
зелен. синий
Анионные комплексы:
NiSO4 + 6KCN = K4[Ni(CN)6]
+ K2SO4
NiCl2 + 2KCl = K2[NiCl4] – в
воде легко разлагаются.
Ni(III):
Ni(OH)3¯ - гидроксид.
Ni(NO3)2 + Br2 +
KOH = Ni(OH)3¯ + KBr
черн.
Ni(OH)3 - обладает слабо – амфотерным
характером.
Ni(OH)3 = H2O + NiOOH – гидроксид оксоникеля.
Ni(OH)3 + KOH(конц.)
= K3[Ni(OH)6]
NiO + KOH + KClO3 = KNiO2 + KCl + H2O
Применение.
Железо и его сплавы
составляют основу современной техники. Никель
и кобальт – важные легирующие добавки к сталям. Широко применяются жаростойкие
сплавы на основе никеля – нихром и др. Из медно-никелевых сплавов – мельхиор –
изготавливают монеты, украшения, предметы домашнего обихода. Металлы семейства
железа широко используются как катализаторы. Железо – в синтезе аммиака, никель
Ренея – катализатор гидрирования. Оксид Fe2O3 и ферриты используются в радиоэлектронике как магнитные
материалы. Fe3O4 –
благодаря высокой химической стойкости и электропроводности служит материалом
для изготовления анодов.