Одиннадцатая
группа Периодической системы Д.И.Менделеева - медь, серебро, золото.
Физико-химические свойства
|
|
tпл,
оС |
tкип, оС |
r г/см3 |
Ео,
В |
|
Cu |
1084,5 |
2540 |
8,94 |
+0,34 (Сu ® Cu2+ ) |
|
Ag |
961,2 |
2170 |
10,5 |
+0,8 (Ag ® Ag+) |
|
Au |
1064,4 |
2840 |
19,3 |
+1,5 (Au ® Au3+) |
Строение атомов и устойчивые степени окисления.
|
|
Cu |
Ag |
Au |
|
|
3d104S1 |
4d105S1 |
5d106S1 |
|
|
0,128 |
0,144 |
0,144 |
|
степени
окисления |
0,
2+, 1+, 3+, 4+ |
0,
1+, 2+, 3+, 5+ |
0,
1+, 3+, 5+, 7+ |
С увеличением радиуса атома обычно повышается
устойчивость высших степеней окисления. Особенностью серебра является то, что
оно выпадает из этой закономерности, т.к. 4d10 оболочка у Ag очень стабильна, т.к. d- подуровень
заполнился еще у Pd. Cu, Ag способны к комплексообразованию.
Низшие степени окисления у Ag и Au
могут быть легко стабилизированы за счет перевода в комплексные соединения.
Стабилизация низших степеней окисления возможна также за счет образования
трудно растворимых соединений (сульфидов и галогенидов) ПР
(Cu2S) ~ 10-50. Cu2S встречается в природе и
это связано не с устойчивостью степени окисления +1, а именно с тем, что очень
низка растворимость этого соединения (стабилизация неустойчивой степени
окисления за счет уменьшения растворимости). Соединения IB гр. сильно различаются по свойствам в ряду Cu - Ag - Au, поэтому свойства соединений рассмотрим отдельно. У
каждого из них много особенностей и аналогию проводить сложно.
Свойства Cu и ее соединенй.
Cu при обычной t на
воздухе покрывается зеленоватой пленкой карбоната гидроксомеди
или сульфита гидроксомеди.
2Сu + О2 + CO2 +
H2O = (CuOH)2CO3
2Cu + О2
+ SO2 + H2O = (CuOH)2SO3
При t = 400оС
2Cu + O2 2CuO
(уст. до t =1100оС)
При t=1100оС
4CuO 2Cu2O + O2 (уст. до tпл
=1233оС)
При t=1800оС
2Cu2O 4Cu + O2
Взаимодействие со щелочами
Cu(Ag, Au)
+ раствор NaOH ¹
Взаимодействие с кислотами
Cu + HCl
Cu + H2SO4
Cu + HNO3
Есть особенности при взаимодействии этих металлов с
другими кислотами, например:
Cu + 2HJ = Cu J + H2
Ео СuJ/Cu= -0,18В
2Cu + 2HCl = 2CuCl + H2 Ео СuJ/Cu= -0,13В
Cu + H2S
= Cu2S ¯ + H2 Ео СuJ/Cu= -0,7В
Выделение Н2
возможно также с KCN
2Сu + 4KCN + 2H2O = 2K[Cu(CN)2] + H2
Ео
= -0,44В
Такие комплексы Cu очень устойчивы.
Взаимодействие Cu с не металлами.
N2, C и Н2 не взаимодействует
2Сu + Cl2 = CuCl2 (при комнатной t)
Cu + S = Cu2S (t= 300oC)
Химические свойства соединений меди
Сu2O
1. Получение:
2CuOH = Cu2O + H2O
2CuF + 2NaOH = Cu2O +
2NaF + H2O
Cu2O +
2HClк = 2H[CuCl2] + H2O
Соединение Н[CuCl2]
устойчиво только в концентрированных растворах НСl, а при разбавлении разлагается:
H[CuCl2] = CuCl ¯ + HCl
Cu2O +
2NaOH + 2H2O = 2Na[Cu(OH)2]
Несмотря на то, что Cu2О может
реагировать с концентрированной щелочью, характер оксида считается основным,
т.к. о характере оксидов и гидроксидов судят по
свойствам соединений при обычной температуре и средних концентрациях.
Поскольку +1не устойчива, то
для нее характерны реакции диспропорционирования
Cu2O + H2SO4
= Cu + CuSO4 + 2H2O
CuO
Cu(OH)2 CuO
+ H2O
(CuOH)2CO3 CuO
+ CO2 + H2O
CuO - основной оксид,
Cu(OH)2
- основной гидроксид
Cu(OH)2 +
2H+ = 2Cu2+ + 2H2O
Cu2+ +
4H2O = [Cu(H2O)4]2+
Cu(OH)2
+ 4H3O+ = [Cu(H2O)4]2+
- голубой раствор
Cu(OH)2 + NaOH ¹
Cu(OH)2 +
2OH- [Cu(OH)4]2-
Cu2O +
4NH3 + H2O = 2[Cu(NH3)2]OH
CuO + 4NH3
+ H2O = [Cu(NH3)4](OH)2
Комплексные аммиакаты Cu2+, более
устойчивы, чем комплексные аммиакаты Cu+
Еще более устойчивы цианидные
и тиосульфатные
CuJ + 2KCN = K[Cu(CN)2] + KJ
CuBr + 2Na2S2O3
= Na3[Cu(S2O3)2]
+ NaBr
Комплексы Cu2+: чаще всего кооординационное
число = 4 или 5, реже 6.
[CuCl5]3-, [Cu(NO2)6]4-
[Cu(NH3)4]2+
В аква комплексах чаще всего
координационное число = 4.
Так, например: СuSO4 × 5H2O правильнее будет предста-вить: [Cu(H2O)4]SO4
. H2O
[Cu(H2O)4]2+
имеет строение плоского квадрата:
Рассмотрим соли Cu+ и
Cu2+
1) Галогениды CuHal
CuF CuCl¯ CuBr¯ CuJ¯
Труднорастворимые галогениды устойчивы, поэтому:
2CuSO4 +
4KJ = 2CuJ¯ + J2 ¯ + 2K2SO4
СuF -
растворимая соль - неустойчива, в водной среде диспропорционирует
CuF = CuF2 + Cu
Cu2SO4
- растворим в воде
CuSO4 = CuSO4 + Cu (в водной среде)
В неводной среде реакция может пойти в обратном
направлении.
Усиление окраски при переходе от фторида к бромиду
связано с тем, что перенос ![]() с атома галогена на атом меди в этом ряду усиливается. В кристаллическом
состоянии CuCl2 и CuBr2 образуют
полимерные структуры следующего строения:
с атома галогена на атом меди в этом ряду усиливается. В кристаллическом
состоянии CuCl2 и CuBr2 образуют
полимерные структуры следующего строения:
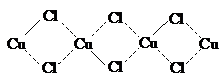
CuF2 в водном
растворе подвергается необратимому гидролизу (существует основная соль):
CuF2 + H2O = CuOHF + HF
Совместный гидролиз:
2СuSO4 + 2Na2CO3
+ H2O = (CuOH)2CO3
+ 2CO2 + 2Na2SO4
ПР(CuOH)2CO3
< ПР Cu(OH)2
CuS гидролизу не подвергается (ПР)
ПР(СuS) ~ 10-38
CuS можно растворить в HClк или HNO3(к)
CuS + 2HCl = CuCl2 + H2S
3CuS + 8HNO3
= 2NO + 2S + 3Cu(NO3)2 + 4H2O
Cеребро Ag
1. Отношение к О2.
На воздухе при обычной температуре серебро не
реагирует. Однако небольшие примеси H2S в воздухе снижают устойчивость Ag.
4Ag + O2
+ 2H2S = 2Ag2S ¯ + 2H2O
Ag2O можно получить
по обменной реакции:
AgNO3 + NaOH = Ag2O + 2NaNO3
+ H2O
2AgOH = Ag2O +
H2O
2Ag2O 4Ag + O2
В водном растворе с низкой концентрацией ионов Ag+ CAg+ =0,01
г/л) возможно растворение Ag2O в воде:
Ag2O + H2O
= 2AgOH
т.е. AgOH существует только
в разбавленных растворах:
Ag2O + H2O
= 2AgOH (ПР = 1,6
× 10-8)
AgOH -
сильное основание.
AgOH = Ag+ + OH- рКв = -3,6 - средней силы электролит.
Соли Ag+ - гидролизу не подвергаются.
(AgNO3, AgF - растворимые соли) - соли сильного основания и
сильной кислоты рНр-ра AgNO3 = 7.
Ag2O - оксид
основного характера. При обычных условиях:
Ag2O +
2HNO3 = 2AgNO3 + H2O
Ag2O + NaOH ¹
H2O + Ag2O
+ 2NaOH 2Na[Ag(OH)2]
В безводной среде (сплавление).
Ag2O +
2NaOH = 2NaAgO + H2O
Оксид Ag2O можно
растворить в NH3.
Ag2O +
4NH3 + H2O = 2[Ag(NH3)2]OH
Известен оксид AgO, который чаще представляют в виде смешанного оксида
4AgO = Ag2O . Ag2O3
. Этот оксид неустойчив и разлагается при 100оС. Ag1+ Ag3+
O2 2Ag + O2
В среде H2SO4 этот
оксид неустойчив даже при обычной температуре, т.е.
2AgAgO2
+ 2H2SO4 = 2Ag2SO4
+ O2 + 2H2O
Галогениды серебра.
Основной особенностью галогенидов cеребра является их светочувствительность, т.е.
неустойчивость на свету:
2AgHal ![]() 2Ag + Hal2
2Ag + Hal2
AgF не входит в этот ряд, т.к. растворим в воде и
подвергается гидролизу с образованием основной соли.
рПР (AgCl) = 9,74
рПР (AgBr) = 12,3
рПР (AgJ) = 15,6
Поэтому возможно растворение галогенидов серебра в
избытке галогенидов щелочных металлов, который приводит к образованию более растворимого галогенида:
AgJ + KCl ¹
AgCl ¯ + KJ = AgJ¯ + KCl
ПР (AgCl) > ПР(AgJ)
Аналогично и растворение в сульфидах щелочных
металлов.
2AgCl ¯+ K2S = Ag2S¯ + 2KCl
рПР(Ag2S) = 49,14
Светочувствительность галогенидов серебра.
Светочувствительность - это разложение галогенидов на
металлы и галогены в течение некоторого времени (медленная реакция):2AgHal +
2Ag + Hal2 (2AgCl + 2Ag + Cl2)
Наиболее устойчив AgCl
AgCl > AgBr > AgJ – уменьшается светочувствительность;
AgJ – обладает наибольшей светочувствительностью.
Трудно растворимые галогениды можно растворить в
аммиаке, тиосульфате, цианиде:
AgHal + NH3 = [Ag(NH3)2]Hal
AgHal + 2Na2S2O3
= N3[Ag(S2O3)2]
NaHal
AgHal + 2KCN = K[Ag(CN)2]
+ RHal
Фотографические процессы на основе галогенидов Ag
Оптимальной светочувствительностью
обладает AgBr. В фотопленке AgBr
находится в составе эмульсии на основе желатина. Изготовление фотографий состоит
из нескольких этапов:
1) Экспозиция
2AgBr 2Ag + Br2
Отражение света от различных участков фотообъекта различно. От более светлых участков на
фотопленку падает более интенсивный световой поток и разложение AgBr протекает с большей скоростью. В результате на фотопленке
образуются темные участки. От более темных участков фотообъекта
свет падает с меньшей интенсивностью и скорость процесса меньше (светлые
участки).
2) Проявление (восстановление).
Восстановители: Na2SO3, гидрохинон, метол. Процесс разложения AgBr продолжается с большей скоростью, причем процесс
является аутокаталитическим (кат.Ag).
3) Фиксирование изображения:
Удаление с фотопленки неразложившегося AgBr тиосульфатом натрия Na2S2O3
AgBr + 2Na2S2O3
= Na3[Ag(S2O3)2]
+ NaBr
4) Регенерация серебра:
2Na3[Ag(S2O3)2]
+ Zn = Na6[Zn(S2O3)4] + 2Ag ¯
5) При изготовлении отпечатков на фотобумаге идут те
же процессы, т.е. фотоэмульсия на бумаге содержит AgBr.
Свет проходя через фотопленку с фиксированным изображением
попадает на фотобумагу (интенсивность зависит от изображения на
фотопленке):
Окислительно восстановительные свойства Ag (I)
Сильные окислители 2AgCl¯ + Zn = ZnCl2 + 2Ag
Доказать окислительные свойства Ag+ можно
реакциями с формальдегидом и с гипофосфористой
кислотой:
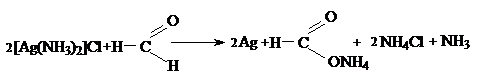
Золото Au
Au3+
устойчивая степень окисления, причем наиболее устойчивая в составе комплексный
соединений. Один из наиболее
устойчивых комплексов H[Au(Cl4)]
– тетрахлороаурат (III) водорода образуется при растворении Au в царской водке.
Au + HNO3(к) + 4HCl(к) = NO + 2H2O
+ H[AuCl4)]
HNO3(к) + 3HCl(к) = NOCl + 2Cl- + 2H2O
NOCl = NO + Cl-
Au + 3Cl-
= AuCl3
AuCl3 + HCl + H[AuCl4]
В очень концентрированой HCl могут образоваться кристаллы H[AuCl4] × 4H2O – желтые игольчатые кристаллы.
Растворение Au
происходит под действием сильного окислителя Cl- в комплексообразующей
среде (Cl-). Au можно также
растворить в селеновой кислоте.
2Au + 6H2SeO4 = Au2(SO4)3
+ 3SeO2 + 6H2O
При высоких температурах золото можно окислить и
молекулярным хлором.
2Au + 3Cl2 2AuCl3 - темно красные игольчатые кристаллы.
AuCl3 подвергается гидролизу, т.е. при присоединении воды неустойчив.
AuCl3 + H2O = H[Au(OH)Cl3]
AuCl3 + 3NaOH = Au(OH)3
¯ + 3NaCl
Au(OH)3 = H2O + AuOOH ¯ - золотая кислота (амфотерный
характер).
При нагревании золотая кислота разлагается.
2AuOOH Au2O3
+ H2O
Au2O3 – устойчив до 160оС.
2Au2O3 4Au + 3O2
Амфотерность AuOOH
H2O + AuOOH + NaOH = Na[Au(OH)4]
2Au(OH)3 + Ba(OH)2 Ba[Au(OH)4]2
× 5H2O
AuOOH + HNO3 H[Au(OH)3]
Au(I) -
неустойчивая степень окисления. Ее можно стабилизировать за
счет образования труднорастворимых соединений золота
(AuCl ¯,
AuBr¯, AuJ¯)
или за счет комплексообразования (H[Au(CN)2],
H[AuCl2], Na3[Au(S2O3)2].
Получение соединений Au
Au2O3
![]() Au2O + O2
Au2O + O2
AuCl3 AuCl + Cl2
H[Au(Cl)4] + 3KJ = 3KCl + HCl
+ AuJ + J2
Соединения золота (I) склонны к реакциям диспропорционирования
3AuCl = AuCl3 + 2Au
3AuCl + H2O
= H[AuCl3OH]
+ 2Au
3Au2O +
8HCl = 2H[Au(Cl)4]
+ 4Au + 3H2O
Высокая склонность к комплексообразованию
у Au3+ и (Au1+). Могут образовать комплексы со всеми лигандами, даже с NO3- и SO42-
Au3+ H[Au3+(NO3)4], H[Au3+(SO4)2],
Au+ [Au(NH3)Cl]
Окислительно-восстановительные свойства соединений
золота
Au+ и Au3+ -
сильные окислители.
FeCl2, FeSO4, SnCl2,
формальдегид, KJ - восстановители
H[Au(Cl4)] + 3FeCl2 = Au + 3FeCl3
+ HCl