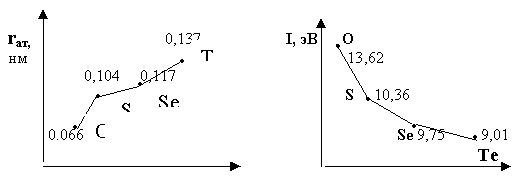
Шестнадцатая
группа Периодической системы Д.И.Менделеева - кислород и элементы подгруппы
серы
Общая характеристика.
164О 1s22s2p4
3216S 1s22s22p63s2p4
7934Se 1s22s22p63s2p6d104s2p4
12852Te 1s22s22p63s2p6d104s2p6d10f145s2p4
Характерные степени окисления
|
-2 |
0 |
+2 |
+4 |
+6 |
|
H2Эn (n =1-6) |
Э2 (n=1-8) |
SCl2 |
ЭF4 ЭO2 H2ЭO3 ЭOГ2 |
ЭF6 (крО2) ЭО3 Н2ЭО4 Н6ТеО6 |
Особенности свойств кислорода.
1. Самая высокая электроотрицательность.
2. Нет d- подуровня
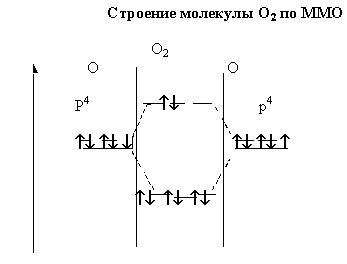
3. Низкие степени окисления(-2; -1; 0; +2(OF2))
Молекулы диамагнитны.
Физические
свойства.
Особенности
образования полисульфатов H2Sn.
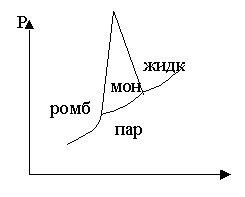
Диаграмма состояния серы
Свойства простых веществ
S + F2 Û SF6
S + O2 Û SO2
S + Cl2Û SCl2
S + H2Û H2S
S + nMeÛ MeSn(сульфиды, часто полисульфиды)
Водородные и кислородные соединения
Особенности строения
У всех молекул халькогенов
существует sp3 – гибридизация
Химические
свойства халькогеноводородов.
В ряду H2O®H2S®H2Se®H2Te
Кислородные свойства возрастают, устойчивость
снижается, являются восстановителями
H2S +
KMnO4 + H2SO4 Û 5S + K2SO4
+ 2MnSO4 + 8H2O
5H2Se +
6KMnO4 + 9H2SO4Û 5H2SeO3
+ 6MnSO4
5H2Se +
6KMnO4 + 9H2SO4 ® 5H2SeO3
+ 6MnSO4 + 9H2O
Cвойства оксидов ЭО2.
1. строение – угловые молекулы
2. окислительно - восстановительные свойства
SO2 – и
окислитель и восстановитель
SO2 + 2H2S
Û 3S + 2H2O
SO2 + I2
+ H2O Û 3H2SO4
+ 6HI
Cхема некоторых реакций с SO2
SO2 + Cl2
Û SO2Cl2
SO2 + O2
Û SO3 (c платиновым Pt+)
SO2 + MnO2(водн.)Û S2O6Mn
SO2 + Zn
+ H2O Û S2O4Zn
(водная суспензия цинка)
SO2 + H2S
+ H2O Û H2S2O3
+ S+ H2O® H2S3O4
+ H2SO3 Û H2S4O6
+ H2O
Строение и свойства
оксокислот.
Cила кислот
|
Kдисс |
S |
Se |
Te
|
|
Н2ЭО3Û Н+ + НЭО3- НЭО3-
Û Н+ +
ЭО32- Н2ЭО4
Û Н+ +
НЭО4- НЭО4- Û Н+ + ЭО42- |
1,9 7,7 3,0 1,92 |
2,6 8,3 71,0 2,0 |
2,6 8,0 77 11,2 |
Устойчивость
|
|
Окислительная
способность
|
||||||||
|
Н2SО3 |
> |
Н2SeО3 |
> |
Н2TeО3 |
|
Н2SО3 |
> |
Н2SeО3 |
< |
Н2TeО3 |
|
(падает) |
|
¯ |
|
¯ |
|
|
|
¯ |
|
¯ |
|
Н2SО4 |
< |
Н2SeО4 |
< |
Н2TeО4 (Н6TeO6) |
|
Н2SО4 |
> |
Н2SeО4 |
> |
Н2TeО4 (Н6TeO6) |
Кроме обычных оксокислот,
для серы характерны 2 класса кислот, в которых имеются цепочки из атомов серы.
1. Полисульфандисульфоновые
кислоты
![]()
![]() HO3S Sn SO3H (политионовые)
HO3S Sn SO3H (политионовые)
n £ 20
Получение.
oдновременное пропускание в воду SO2 и H2S
1. SO2 + H2S + H2O (жидкость
Ракенродора)
2. H2Sn + SO3
Наиболее важное значение имеют 2 кислоты: тритионовая и тетратионовая(по
общему количеству атомов серы) – H2S3O6 и H2S4O6, которые относятся к кислотам средней силы.
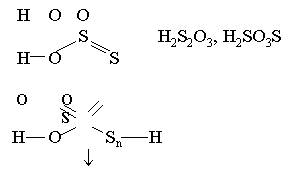
2. Полисульфанмоносульфоновые кислоты
Ряд кислот
Н2S2O3 –
сильная кислота, но малоустойчивая
В окислительно –
восстановительных реакциях является восстановителем. Восстанавливается
по-разному в зависимости от окислителя и от среды.
H2SO3S
+ H+ ® SO2 + H2O
+ S
SO3S2-
+ OH- ® SO42-
+ S2- +H2O
С сильными окислителями(MnO42-, Cr2O72-, Cl2, Br2)
SO3S2-
+ 5H2O ® 2 SO42--
+10H+
Cо слабыми окислителями(I2, Fe3+, Cu2+)
2SO3S2- ® S4O62-
Пероксокислоты

Пероксомоносерная – H2SO5 Пероксодисерная – H2S2O8
(NH4)2S2O8 – пероксидисульфат аммония
S2O82- + 2e- ® 2 SO42- (не зависит от среды)
SO52- + 2H2O –2e- ® SO42- + H2O
Обычно в процессе необходим катализатор(Ag+)
Серная кислота и ее производные.
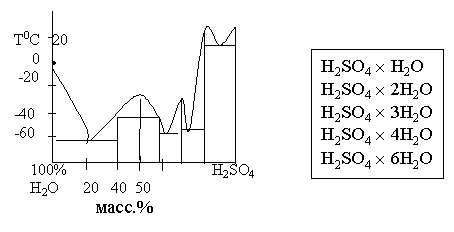
Фазовая диаграмма H2SO4+ H2O
водоотнимающее действие кислоты связано с образованием гидратов
(идет с выделением количества теплоты)
Производные H2SO4.
1.Пероксокислоты
2.Полисульфаны: моно-(ди - , поли-)сульфановые
3.При дегидратации H2SO4 образуется ряд кислот (путем пиролиза)
