Протолитометрия. Кривые титрования (примеры
построения) различных типов. Теории индикаторов.
Методы кислотно-основного титрования (протолитометрия)
Сущность кислотно-основного тирования
В основе
кислотно-основного титрования лежит
соединение ионов НзО![]() и гидроксид-ионов ОН
и гидроксид-ионов ОН![]() с образованием малодиссоциирующих молекул воды (гл. XVII, § 3). Этим методом, пользуясь
титрованными растворами щелочей, определяют количество или концентрацию кислот
(НСl, H
с образованием малодиссоциирующих молекул воды (гл. XVII, § 3). Этим методом, пользуясь
титрованными растворами щелочей, определяют количество или концентрацию кислот
(НСl, H![]() SO
SO![]() , Н
, Н![]() РO
РO![]() , Н
, Н![]() С
С![]() O
O![]() ). С помощью растворов кислот находят концентрацию оснований
(NaOH, КОН, Са(ОН)
). С помощью растворов кислот находят концентрацию оснований
(NaOH, КОН, Са(ОН)![]() , Ва(ОН)
, Ва(ОН)![]() ). Метод пригоден также для определения протолитически кислых
и щелочных солей (Na
). Метод пригоден также для определения протолитически кислых
и щелочных солей (Na![]() CO
CO![]() , NH
, NH![]() Cl и т.п.).
Cl и т.п.).
Поскольку реакция нейтрализации не сопровождается
каким-нибудь внешним эффектом, например изменением окраски раствора, точку эквивалентности определяют с помощью
индикаторов. Но обычно индикаторы изменяют окраску не строго в точке
эквивалентности, а с некоторым отклонением от нее. Иначе говоря, конечная точка
титрования не всегда совпадает с точкой эквивалентности, она только более или
менее соответствует точке эквивалентности. Поэтому даже при правильном выборе
индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный выбор индикатора
может исказить результаты анализа. Рассмотрим теорию индикаторов и правила их
выбора при различных случаях титрования.
Индикаторы кислотно-основного титрования.
Индикаторы –
это слабые органические кислоты (или слабые основания), у которых
недиссоциированные молекулы и образуемые ими ионы имеют различную окраску.
Поэтому они носят общее название кислотно-основных
индикаторов.
Индикаторы, обладающие свойством присоединять протоны,
называют основными индикаторами и обозначают
через IndOH, где Ind![]() — катион индикатора.
Такие индикаторы диссоциируют по схеме:
— катион индикатора.
Такие индикаторы диссоциируют по схеме:
IndOH+H+«Ind++H2O
акцептор
протона
Индикаторы, обладающие свойством отдавать протоны,
называют кислотными индикаторами и
обозначают через HInd. Молекула такого индикатора
играет роль донора протона, т.е. дает при диссоциации катион Н![]() и анион Ind
и анион Ind![]()
![]() .
.
В табл. указана окраска недиссоциированных молекул и
анионов некоторых индикаторов.
Окраска некоторых индикаторов.
|
Индикатор |
Окраска
недиссоциированных молекул |
Окраска
ионов |
|
Метиловыйоранжевый
Метиловый красный Лакмус Фенолфталеин
Тимолфталеин
Бромтимоловый
синий |
Красная Красная Красная Бесцветная Бесцветная Жёлтая |
Жёлтая Жёлтая Синяя Малиновая Синяя Синяя |
Таким образом, окраска молекул индикаторов, обладающих
кислотными свойствами, проявляется в кислой среде, а окраска аниона — в щелочной.
Приведенные рассуждения являются, однако, несколько
упрощенными. Согласно ионно-хромофорной теории молекулы кислотно-основных индикаторов
содержат так называемые хромофоры (носители
цветности), т.е. особые группы' атомов с сопряженными двойными связями и
неподеленными парами электронов:
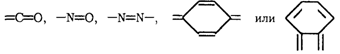
Последняя группировка атомов называется хиноидной. При изменении рН раствора или при
диссоциации хромофоры могут перегруппировываться. Перемена окраски у
индикаторов — результат изменений в их
внутреннем строении. У одноцветных индикаторов это связано с появлением или
исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены
превращением одних хромофоров в другие.
Типичный одноцветный индикатор — фенолфталеин При рН < 8
молекулы его не содержат хиноидной группировки и поэтому бесцветны. Однако при
действии щелочи на фенолфталеин (рН 8—10) образуется
анион, который включает хиноидную группировку и окрашен в малиновый цвет:
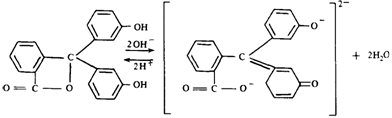
Дальнейшее
увеличение рН (до 13—14) вызывает новую
перегруппи-ровку, в результате чего получается соль, лишенная хиноидной
группировки и поэтому бесцветная:
Типичным двухцветным индикатором можно считать
метиловый оранжевый:
![]()
В водном растворе он оранжевый, при рН < 3,1 приобретает красную, а при рН > 4,4 — желтую окраску. Объясняется это
тем, что азот азогруппы индикатора обладает свойством присоединять катион Н+
кислоты и превращаться в ион красного цвета.
Таким образом, при действии кислот наблюдается переход
желтой Краски индикатора в красную. Но при действии оснований происходит обратное
превращение:

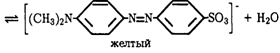
Иначе говоря, кислотно-основные индикаторы могут
существовать в ух взаимно переходящих (таутомерных) формах, имеющих различную
окраску. Переход из одной формы индикатора в другую происходит под действием
ионов H+и ОН-,
поскольку одна из форм индикатора является слабой органической кислотой или
слабым основанием. На окраску индикаторов влияет также присутствие в соединениях
других группировок, называемых ауксохромами.
К последним относятся группы —ОН, —NH2, и их производные, содержащие те или иные радикалы, например
группы —ОСН3, —N(СН3)2
и т.п. В противоположность хромофорам, ауксохромы сами не сообщают окраску
индикаторам, но обладают свойством усиливать действие хромофоров, повышать
интенсивность вызываемой ими окраски. Подробнее этот вопрос рассматривается в
курсе органической химии с учетом квантово-механических представлений.
Свойство молекул различных индикаторов диссоциировать
в нейтральной среде характеризуют константами диссоциации. Например, у метилового
оранжевого К =
10-4, у лакмуса К = 10-8,
а у фенолфталеина К»10-9. Следовательно, фенолфталеин является наиболее слабой
органической кислотой из этих индикаторов.
Таким образом, интенсивность окраски
фенолфталеина меняется в интервале рН от 8
до 10.
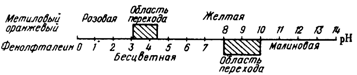
Рис.1
Окраска фенолфталеина и метилового оранжевого при различных значениях рН
Интервал значений рН, в пределах
которого индикатор изменяет вою окраску, называют областью перехода.
Важнейшие индикаторы метода нейтрализации имеют
следующие области перехода и показатели титрования:
|
|
Область перехода pH |
Показатель титрования pT |
|
Тропеолин |
1,4 – 3,2 |
2,0 |
|
Метиловый
оранжевый |
3,1 – 4,4 |
4,0 |
|
Метиловый
красный |
4,4 – 6,2 |
5,5 |
|
Лакмус |
5,0 – 8,0 |
7,0 |
|
Фенолфталеин |
8,0 – 10,0 |
9,0 |
|
Бромтимоловый
синий |
8,0 – 9,6 |
8,0 |
|
Тимолфталеин |
9,4 – 10,6 |
10,0 |
Потенциометрическое
титрование. Изменение концентрации
иона непременно сопровождается изменением потенциала на индикаторном электроде,
погруженном в титруемый раствор. При этом около точки эквивалентности
наблюдается скачок потенциала, который фиксируется при помощи потенциометра.
Кондуктометрическое
титрование основано на том, что за
ходом реакции следят по электрической проводимости титруемой среды между двумя
инертными (например, платиновыми) электродами, вычерчивают кривую зависимости
электрической проводимости от объема прибавленного титранта. При титровании определяемого
вещества раствором реактива получаются малодиссоциирующие или малорастворимые
соединения, вследствие чего электрическая проводимость титруемого раствора
заметно понижается. При этом минимум электрической проводимости на кривой наблюдается
в конце титрования и соответствует точке эквивалентности. Добавление же
небольшого избытка реактива вызывает при титровании сильных электролитов новое
увеличение электрической проводимости, которое и считают признаком конечной
точки титрования. Этот метод, позволяющий определить точку эквивалентности по
резкому увеличению электрической проводимости анализируемого раствора, называют
кондуктометрическим титрованием. Его используют в количественном анализе при
работе по методу нейтрализации. Например, при титровании гидроксида калия
хлороводородной кислотой
К+ +
ОН- + H+ + С1- ® К+ +
С1- + Н2О
концентрация щелочи в растворе постепенно уменьшается.
Поскольку электрическая проводимость раствора хлорида калия гораздо ниже электрической
проводимости раствора гидроксида калия и хлороводородной кислоты, по мере нейтрализации
будет наблюдаться уменьшение электрической проводимости. В точке эквивалентности
титрования она будет наименьшей, а при добавлении избытка кислоты снова
увеличится. Это и позволяет определить конечную точку титрования.
Амперометрическое
титрование отличается тем, что за
ходом реакции следят с помощью ртутного капающего, вращающегося платинового или
другого микроэлектрода, играющего роль индикаторного электрода и находящегося в
паре с подходящим электродом сравнения.
Обычно анализируемый раствор наливают в ячейку
полярографа, снабженного капельным ртутным микроэлектродом и электродом
сравнения: устанавливают напряжение между электродами, требуемое для (деления
на катоде того или иного металла, после чего анализируемый раствор титруют
реактивом. В ходе титрования отмечают микро-амперметром изменение диффузного тока
по мере прибавления реактивом. Строят
кривую амперометрического титрования, откладывая по оси ординат показания
микроамперметра, а по оси абсцисс — объем
стандартного раствора реактива в миллилитрах. По кривой амперометрического
титрования находят точку эквивалентности, которой соответствует минимальный
ток.
Содержание определяемого вещества вычисляют по объему
стандартного раствора реактива, израсходованному на титрование до точки
эквивалентности. Амперометрическое титрование используют для определения хроматов,
фосфатов, сульфатов и других анионов в водных растворах. Метод более точен, чем
обычное титрование, применим для исследования мутных и окрашенных растворов.
Кулонометрическое
титрование — это прием титрования, основанный на измерении
количества электричества, затраченного на выполнение электродной реакции. При
этом титрующий агент (например, кислотно-основного типа) не прибавляется в виде
стандартного раствора как обычно, а образуется в результате электродной
реакции.
Электролиз при кулонометрическом титровании проводят
при постоянной величине тока. Объем раствора или массу выделившегося вещества
не измеряют, а находят затраченное на электролиз количество электричества по
времени, измеренному секундомером. Например при электролизе раствора комплексоната
ртути (на ртутном катоде) ртуть восстанавливается до металлической, а
получающийся комплексон III можно
титровать раствором катионов кальция, цинка, меди (II) и др.
Кривые титрования.
Можно выделить два способа
построения кривых титрования. Первый основан я расчете величины изменяющегося
параметра при изменении состава раствора отдельные моменты титрования. Для
этого используют формулы зависимости величия переменного параметра от
концентрации титруемого вещества или титранта. Второй способ предполагает вывод
и использование общего уравнения кривой титрования.
Первый более прост и полезен при
ознакомлении с принципом построения кривых, так как при этом фиксируется
внимание на составе раствора в различных моменты титрования. Второй способ
является более общим, он удобен при расчете кривых с привлечением ЭВМ; для
ручных расчетов общее уравнение приходится упрощать.
Если для построения кривых
титрования не используется общее уравнение, необходимо провести четыре типа
расчетов, соответствующих различным участка кривой;
1) до начала титрования;
2) до точки эквивалентности
(область буферных растворов);
3) в точке эквивалентности;
4) за точкой эквивалентности.
По оси абсцисс откладывают либо
объем титранта (в миллилитрах), либо степень оттитрованности, т.е. долю
оттитрованного вещества.
Степень оттитрованности f выражаетсж
отношением количества добавленного титранта к исходному количеству титруемого
вещества:
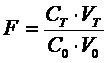
CT
и C0 -
концентрации (моль эквивалентов в литре) растворов титранта и титруемого
вещества соответственно; V0 - исходный объем титруемого вещества;
VT- добавленный объем титранта.
Степень оттитрованности можно
выразить также отношением объемов титранта в иной точке и в точке эквивалентности.
А если концентрации титранта и титруемого вещества одинаковы, то
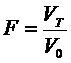
Величину f можно выразить в
процентах. Очевидно, что в начале титрования f=0, в точке эквивалентности f<l (<100%),
за точкой эквивалентности f>1 (>100%).
По оси ординат откладывают либо
переменный параметр (можно величину, пропорциональную ему), либо логарифм
переменного параметра. В первом случае получается линейная кривая титрования,
во втором - логарифмическая.
Линейная кривая титрования
выражается двумя прямолинейными участками, пересекающимися в точке эквивалентности.
Такие кривые нашли применение для определения точки эквивалентности с помощью
физико-химических методов, когда переменным параметром является какое-либо
физическое свойство, пропорциональное концентрации. Для выбора индикатора и
определения погрешности титрования более удобны логарифмичекие кривые
титрования.
Логарифмическая кривая
титрования представляет собой S-образную кривую, на которой имеются области
плавного и резкого изменения логарифма переменного параметра. Резкое изменение
наблюдается вблизи точки эквивалентности; эта область называется скачком
титрования. Границы скачка оценивают исходя из заданной точности титрования, и
Построение кривых титрования кислот и оснований.
Метод кислотно-основного
титрования основан на протолитическнх реакциях.
SH2+ + S- === 2SH
в частности, для водных
растворов
Н3О+ + ОН-
= 2Н2О.
Метод применим для определения
концентрации кислот (соляная, уксусная и т.п.), оснований (гидроксид натрия,
карбонат натрия, аммиак и т.п.), амфолитов (гидрокарбонат натрия, дигидрофосфат
натрия и т.п.).
Изменяющимся параметром при
построении кривых титрования служит величина РН раствора.
Вычисление концентрации ионов
водорода обычно проводят с точностью до двух значащих цифр. Такая точность
вполне достаточна для выбора индикатора и оценки индикаторных погрешностей
титрования. Поэтому даже если концентрация ионов водорода может быть вычислена
с большей точностью, значения рН можно округлять до второго знака после запятой.
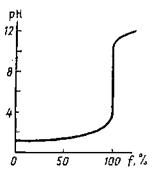
Рис.1. Кривая титрования 0.1000 М раствора соляной кислоты 0.1000 М раствором гидроксида натрия.
На кривых титрования
одноосновных кислот наблюдается один скачок.
На величину скачка титрования влияет ряд факторов.
1. Концентрация кислоты. Чем ниже концентрация титруемой кислоты, тем меньше скачок титрования.
2. Температура. Величина константы автопротолиза воды, входящей в формулы расчета рН,
зависит от температуры - с повышением температуры величина константа
автопротолиза заметно возрастает. Поэтому с повышением температуры рН воды
также водных растворов оснований уменьшается. Это приводит к смещению точки
эквивалентности и ветви кривой за точкой эквивалентности в область меньших
значений рН; в результате скачок титрования уменьшается. При изменении
температуры рН растворов кислот и буферных смесей изменяется в меньшей степени.
3. Природа титруемой кислоты. Чем меньше константа диссоциации кислоты, тем выше рН
растворов в начале титрования и в области буферного действия. Чем слабее
титруемая кислота, тем сильнее сопряженное основание, образующееся при
титровании Отсюда ясно, что с уменьшением константы диссоциации кислоты точки
эквивалентности и начальная ветвь кривой титрования смещаются в область более
высоких значений рН, однако за точкой эквивалентности кривая остается без
изменений, и скачок титрования уменьшается.
Чем слабее кислота, тем меньше
скачок титрования. При каком же минимальном значении константы диссоциации
кислоты возможно обнаружение точки эквивалентности с помощью кислотно-основных
индикаторов? Величина скачка не должна быть меньше интервала перехода окраски
индикатора, обычно лежащего пределах Кaинд ±1. Следовательно, необходимо выполнение
условия КaHA >10-10 – 10-11.
Титрование одноосновных кислот.
Рассмотрим способы вычисления рН
в моменты титрования, соответствующие, различным участкам кривой титрования.
1. До начала титрования. Раствор содержит только титруемую кислоту; рН раствора
до начала титрования рассчитывают по исходной концентрации кислоты используя в
зависимости от силы кислоты формулы (12, гл.2.2.1) или (15 ). Если в таблицах,
не приведена константа диссоциации кислоты, но имеется константа диссоциации
сопряженного основания, расчет проводят, используя дополнительную формулу (24
).
Итак, в случае титрования
сильной кислоты
[Н+] = С0
слабой кислоты
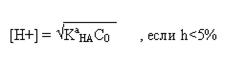
или
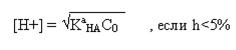
если h>5%.
2. До точки эквивалентности. Раствор представляет собой смесь неоттитрованной
кислоты и сопряженного основания. Формула, используемая для расчета рН, зависит
от силы титруемой кислоты.
а) При титровании сильной кислоты рН рассчитывают по концентрации неоттитрованной
кислоты, поскольку сопряженное основание слишком слабо, чтобы оказать влияние
на кислотно-основное равновесие, поэтому
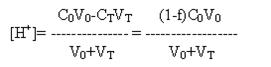
если С0=СT.
Без учета изменения объема
раствора в процессе титрования
Если C0 = CT, то
или, если величина f выражена в
процентах,
б) При титровании слабой кислоты образующиеся растворы представляют собой
буферные смеси. Расчет рН в этом случае следует проводить по формуле (33 ):
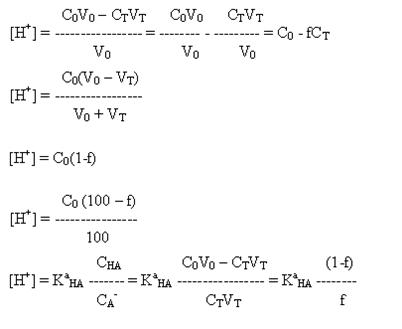
или
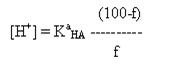
Как видно в этой области кривой
титрования рН не зависит от разбавления раствора.
Следует заметить, что если
допущения, сделанные при выводе формулы (33 ), вблизи точки эквивалентности
оказываются неприемлемыми и для расчета,рН необходимо пользовать более сложные
формулы.
3. В точке эквивалентности. Раствор содержит только основание А- в
количестве, явном исходному количеству титруемой кислоты.
а) При титровании сильной кислоты образуется очень слабое сопряженное
основание, поэтому рН раствора определяется кислотно-основными свойствами
растворителя и рассчитывается по величине константы автопротолиза растворителя:
![]()
б) При титровании слабой кислоты образуется сопряженное основание с
более ярко выраженными основными свойствами, чем у растворителя, поэтому рН раствора
определяется концентрацией основания и рассчитывается по формуле. 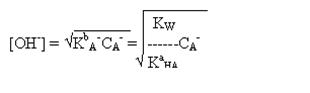
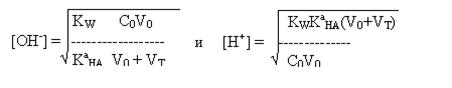
без учета изменения объема
раствора при титровании
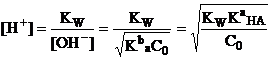
4. За точкой эквивалентности. Раствор представляет собой смесь слабого и сильного
оснований. Более сильное основание подавляет диссоциацию слабого основания, и
поэтому рН раствора определяется избытком добавленного титранта, поэтому
![Подпись: C0(VT – V0) KW (V0 + VT)
[OH-] =------------------ и [H+] = --------------------
V0 + VT C0(V0 + VT)](14.files/image059.gif) Если C0 = CT, то
Если C0 = CT, то
![Подпись: CTVT – C0V0 CTV0
[OH-] = ------------------ = --------- - C0 = fCT – C0
V0 V0](14.files/image060.gif) Без учета изменения объема раствора в процессе титрования
Без учета изменения объема раствора в процессе титрования
![Подпись: KW
[OH-] = C0 (f-1) и [H+] = --------------
C0( f - 1)](14.files/image061.gif) Если C0 = C, то
Если C0 = C, то
![Подпись: 100 KW
[H+] = ----------
C0 (f – 1)](14.files/image062.gif) или
или
если величина f выражена в
процентах.
На кривых титрования
одноосновных кислот наблюдается один скачок.
На величину скачка титрования влияет ряд факторов.
4. Концентрация кислоты. Чем ниже концентрация титруемой кислоты, тем меньше скачок титрования.
5. Температура. Величина константы автопротолиза воды, входящей в формулы расчета рН,
зависит от температуры - с повышением температуры величина константа
автопротолиза заметно возрастает. Поэтому с повышением температуры рН воды
также водных растворов оснований уменьшается. Это приводит к смещению точки
эквивалентности и ветви кривой за точкой эквивалентности в область меньших
значений рН; в результате скачок титрования уменьшается. При изменении
температуры рН растворов кислот и буферных смесей изменяется в меньшей степени.
6. Природа титруемой кислоты. Чем меньше константа диссоциации кислоты, тем выше рН
растворов в начале титрования и в области буферного действия. Чем слабее
титруемая кислота, тем сильнее сопряженное основание, образующееся при
титровании Отсюда ясно, что с уменьшением константы диссоциации кислоты точки
эквивалентности и начальная ветвь кривой титрования смещаются в область более
высоких значений рН, однако за точкой эквивалентности кривая остается без
изменений, и скачок титрования уменьшается.
Чем слабее кислота, тем меньше
скачок титрования. При каком же минимальном значении константы диссоциации кислоты
возможно обнаружение точки эквивалентности
с помощью кислотно-основных индикаторов? Величина скачка не должна быть меньше
интервала перехода окраски индикатора, обычно лежащего пределах Кaинд ±1. Следовательно, необходимо
выполнение условия КaHA
>10-10 – 10-11
Титрование многоосновных кислот.
Число скачков, наблюдаемых на
кривых титрования многоосновных кислот, зависит от абсолютного значения
последовательных констант диссоциации, а также от их соотношения. Вспомним, что
одноосновная кислота с КaHA <
10-8 оттитрована быть не может. Это условие справедливо и для многоосновных
кислот, растворы которых можно рассматривать как смесь одноосновных кислот. Для
кислот НnА, имеющих константы диссоциации больше 10-8,
число скачков титрования зависит от соотношения констант. Если соотношение ![]()
![]() 102-l03,
то на кривой титрования наблюдается один скачок, соответствующий оттитровыванию
сразу всех протонов многоосновной кислоты. Это происходит потому, что в
растворе нет кислоты, способной подавить диссоциацию остальных. Правда, при
соотношении констант 103 на кривой титрования в области первого
скачка наблюдается слабо выраженный перегиб, но не столь резкий, что можно было
провести постадийное титрование кислоты. Например, для щавелевой кислоты константы
диссоциации равны 5.62.10-2 и 5.89.10-5
соответственно, поэтому кривой титрования наблюдается только один хорошо
выраженный скачок, пригодный для количественного определения. Отчетливо
выраженные скачки титрования соответствующие постадийному титрованию протонов многоосновной наблюдаются только в том случае,
если соотношение констант диссоциации
102-l03,
то на кривой титрования наблюдается один скачок, соответствующий оттитровыванию
сразу всех протонов многоосновной кислоты. Это происходит потому, что в
растворе нет кислоты, способной подавить диссоциацию остальных. Правда, при
соотношении констант 103 на кривой титрования в области первого
скачка наблюдается слабо выраженный перегиб, но не столь резкий, что можно было
провести постадийное титрование кислоты. Например, для щавелевой кислоты константы
диссоциации равны 5.62.10-2 и 5.89.10-5
соответственно, поэтому кривой титрования наблюдается только один хорошо
выраженный скачок, пригодный для количественного определения. Отчетливо
выраженные скачки титрования соответствующие постадийному титрованию протонов многоосновной наблюдаются только в том случае,
если соотношение констант диссоциации ![]() 104.
104.
Рассмотрим построение кривой титрования двухосновной кислоты последовательными
константами диссоциации, различающимися более чем в 104 раз.
До начала титрования. Раствор содержит только кислоту Н2А. Поскольку различие в
величинах констант диссоциации большое, можно пренебречь диссоциацией, по
второй стадии и титруемый раствор рассматривать как раствор одноосновное
кислоты. В зависимости от силы кислоты рН следует рассчитывать по формуле (12 )
или (15 ).
До точки эквивалентности. Раствор представляет собой смесь неоттитрованной
кислоты Н2А и сопряженного основания НА-, т.е. буферную
смесь. Расчет рН следует проводить по формуле (33 ), если титруют не слишком
разбавленный раствор.
В первой точке эквивалентности. В растворе находится основание НА- образовавшееся
в результате титрования кислоты Н2А. Поскольку НА- амфолит,
то для расчета рН следует взять подходящую для конкретного случая (в зависимости
величин.)одну из формул, например (52 ).
За первой точкой эквивалентности. Раствор представляет собой смесь неоттитрованной кислоты
НА- и образующегося в результате титрования сопряженного основания А2-,
т.е. буферную смесь. Для расчета рН вновь пригодна формула (33 ).
Во второй точке эквивалентности. Раствор содержит основание А2-, обычно
достаточно сильное , чтобы можно было пренебречь диссоциацией его по второй
стададии. Поэтому расчет рН можно провести по формуле (24 ) .
За второй точкой эквивалентности. В растворе находится смесь слабя основания А2'
и сильного основания - титранта. Поскольку именно последний определяет рН
раствора, расчет проводят по формуле (13 ).
Пример 3. Постройте кривую титрования 100.0 мл 0.1000 М раствора сернистой
кислоты (1/2 H2SO3) 0.1000 М раствором гидроксида
натрия.
Решение. На кривой титрования
сернистой кислоты будут наблюдаться четких скачка титрования, поскольку обе
константы достаточно велики KaH2SO3=l.3.10-2,
КaHSO3- = 6.8.10-8 и
соотношение констант > 104.
До начала титрования. Степень диссоциации сернистой кислоты по стадии равна почти 36%,
поэтому для расчета рН используется формула ();
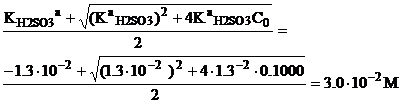
рН=1.52.
До первой точки эквивалентности.
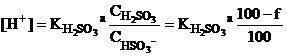
Например, при добавлении 25.0 мл
раствора гидроксида натрия (f=50%):
![]() pH = 1.89
pH = 1.89
В первой точке эквивалентности. В этот моментг f = 100%, т.е. в растворе содержится
только гидросульфит ион в концентрации в 1.5 раза меньшей, чем исходная
концентрация сернистой кислоты (за счет разбавления раствора при титровании).
Строго для расчета рН следует использовать формулу (2-12), так как КaHSO3- >> КW но
CHSO3- сопоставима с величиной KaH2SO3:
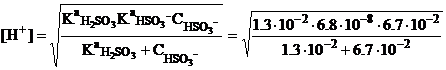
рН=4.58.
В данном случае практически тот
же результат получается при использовании формулы (), пригодной при условии,
когда KaHSO3-CHSO3- > KW, CHSO3- > KaH2SO4:
![]()
рН=4.53.
За первой точкой эквивалентности.
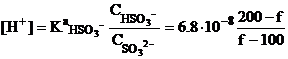
Например, при добавлении 75.0 мл
титранта (f = 150%):
![]()
рН=7.20.
Во второй точке эквивалентности. В этот момент f=200%, т.е. в растворе
«•держится только сульфит-ион в концентрации в два раза мевывей, чем исходная
концентрация сернистой кислоты,
поэтому
![]()
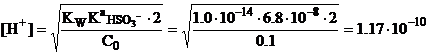
рН=9.93.
За второй точкой эквивалентности. Величина рН определяется концентрацией избыточного
количества титранта
![]()
Результаты вычислений приведены
в табл. 3.
По данным табл. 3 построена
кривая титрования (рис. 3).
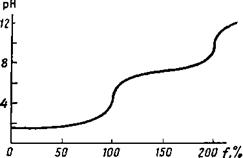
Рис.З.Кривая
тнтрования 0.1000М раствора сернистой кислоты 0.1000М, раствором гидроксида натрия
Титрование одноосновных оснований.
Рассмотрим способы вычисления рН
в моменты титрования, соответствующие различным участкам кривой титрования.
До начала титрования. Раствор содержит только титруемое основание, 1 раствора рассчитывают по
исходной концентрации основания, используя в зависимости от силы основания
формулы (13) или (24). В случае титрования сильного основания:
[ОН-]=C0 ; ![]()
слабого основания:
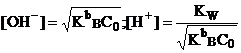
![]() ,
если h<5% или
,
если h<5% или
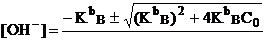 , если h<5%
, если h<5%
До точки эквивалентности. Растворы представляют собой смесь неоттитрованного
основания и сопряженной кислоты.
а) При титровании сильного основания рН рассчитывают по концентрации оттитрованного
основания, поскольку сопряженная кислота слишком слаба, чтобы влиять влияние на
кислотно-основное равновесие:
![]()
Если C0 = CТ , то
![]()
Без учета изменения объема в
процессе титрования
[OH-]=C0 - fCT,
Если C0 = CT , то [ОН- ] = C0(1 – f) или, если величина f выражена в
процентах,
![]()
б) При титровании слабого основания образующиеся растворы представляют собой
буферные смеси. Расчет рН проводят по формуле (33);
![]()
или
![]()
Как и в случае построения кривых
титрования слабых кислот, вблизи точки эквивалентности необходимо пользоваться
более сложными формулами.
В точке эквивалентности, раствор содержит только слабую кислоту ВН в количестве,
равном исходному количеству титруемого основания.
а) При титровании сильного основания образуется очень слабая сопряженная кислота,
поэтому рН раствора определяется кислотно-основными свойствами растворителя.
Для водных растворов
![]()
б) При титровании слабого основания образуется сопряженная кислота, рН раствора
рассчитывают по формуле (15):
![]()
если C0 = CT, то
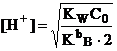
За точкой эквивалентности. Раствор представляет собой смесь слабой и сильной
(титранта) кислот. Величина рН раствора определяется избытком добавленного
титранта, поскольку сильная кислота подавляет диссоциацию слабой кислоты:
![]()
Если C0 = CT ,то ![]()
Без учета изменения объема в процессе
титрования
[H+] = f CT – C0
Если С0 = CT,
то [H+]=C0 (f - l) или, если величина f выражена в процентах f-100
![]()
На кривых титрования
одноосновных оснований наблюдается один величина которого зависит от тех же
факторов, что и величина скачка на кривых титрования одноосновных кислот.
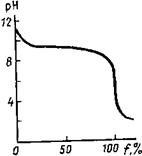
Рис.
4. Кривая титрования 0.1000 М раствора аммиака 0.1000 М раствором соляной
кислоты.
Титрование многоосновных оснований.
Построение кривых титрования
многоосновных оснований принципиально не отличается от построения кривых
титрования многоосновных кислот. Убедимся в этом на конкретном
примере.
Пример 5. Постройте кривую титрования 100.0 мл 0.1000 М раствора карбоната
натрия(1\2 Na2CO3) 0.1М раствором соляной кислоты.
Решение. Титруем двухосновное
основание; последовательные константы диссоциации
отличаются более чем в 104 раз:
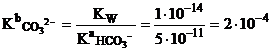
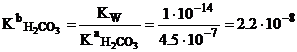
До начала титрования. В растворе содержится основание, карбонат-ион, степень
Диссоциации
которого не превышает 5%, поэтому для расчета pH используем формулу
![]()
рОН=2.35; рН=14.00-2.35=11.65.
До первой точки эквивалентности. Раствор представляет собой смесь неоттитрованного
карбонат-иона и образующегося гидрокарбонат-иона (буферная смесь):
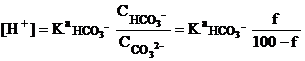
Например, при добавлении 25.0 мл
титранта (f=50%):
![]()
рН=10.30
В первой точке эквивалентности. В этот момент f = 100%, т.е. в растворе содержится
только гидрокарбонат-ион в концентрации в 1.5 раза меньшей, чем исходная
коицентрация карбоната натрия. Для расчета рН используем формулу (), так как ![]() :
:
![]()
![]()
рН=8.33.
За первой точкой эвкивалентности. Раствор представляет собой смесь неоттитрованного
гчдрокарбонат-иона и образующейся угольной кислоты (буферную смесь), поэтому
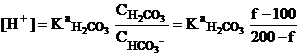
Например, при добавлении 75.0 мл
титранта (f = l50%):
![]()
pH=6.35.
Во второй точке эквивалентности. Раствор содержит угольную кислоту. Учитывая, что
максимальная растворимость углекислого газа составляет 4.5 • 10-2
концентрация угольной кислоты не может превышать 4.5 • 10-2 М:
![]()
рН=3.85
За второй точкой эквивалентности величина рН определяется концентрацией титранта
![]()
По данным табл. 5 построена
кривая титрования (рис. 5).
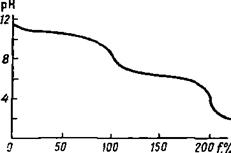
Рис.5.
Кривая титрования 0.1000 М раствора карбоната натрия 0.1000 М раствором соляной кислоты