Редоксиметрия,
ее варианты. Пример расчета кривой титрования. Основные особенности.
Окислительно-восстановительное
титрование.
В основе данного метода лежат реакции окисления-
восстановления. В качестве титранта могут применяться растворы окислителя или
восстановителя.
Особенности
окислительно-восстановительного титрования:
1. Сравнительно низкие скорости реакций.
2. Сложный механизм протекания реакций.
3. Критерий применимости реакции для титрования: DE0 = E0ок - E0восст
не менее 0,2В, в этом случае константа равновесия оказывается достаточно высокой.
В окислительно-восстановительном титровании используют
индикаторы двух типов:
1. Дающие окрашенные соединения с окисленной или
восстановленной формой.
2. Редоксиндикаторы, изменяющие окраску при изменении
потенциала системы (слабые окислители
или восстановители, имеющие различную окраску окисленной и воссстановленной
формы).
Также используют безиндикаторное титрование, если одна
из форм (или обе) имеют окраску.
По
применяемому в
окислительно-восстановительном титровании титранту
различают:
1. Перманганатометрию;
2. Иодометрию;
3. Хроматометрию;
4. Броматометрию;
5. Цериметрию;
6. Ванадатометрию.
Построение кривых окислительно-восстановительного
титрования.
При окислительно-восстановительном титровании в растворе
протекают полуреакции
![]()
Любой участник этих полуреакций
может быть как титрантом, так и титруемым веществом. Так, если титрантом
является Ох1, то титруемое вещество – Red2 если титрант Ох2,
титруемое вещество – Red1. И наоборот, в качестве
титрантов могут выступать Red1, или Red2, а титруемыми веществами будут
Ох2 и Ох1 соответственно.
Для каждой полуреакции в
соответствии с уравнением Нернста (влиянием ионной силы пренебрегаем)
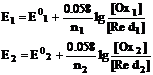
При титровании между титрантом и
титруемым веществом протекает реакция
![]()
После добавления каждой порции
титранта в растворе устанавливается равновесие и 'встема приобретает потенциал
Е, зависящий от соотношения концентраций исходных веществ и продуктов. Поэтому
логично в качестве изменяющегося параметра при построении кривых титрования
использовать потенциал системы. При равновесии потенциалы полуреакций равны E = E1 = E2 поэтому для расчета Е можно
использовать и уравнение (I), и уравнение (II). При выборе уравнения руководствуются
соображениями удобства и простоты вычислений. До точки эквивалентности удобно использован
уравнение для полуреакции с участием титруемого вещества, после точки
эквивалентности - уравнение полуреакции с участием титранта. Действительно, до
точки эквивалентности весь
добавленный титрант превращен в сопряженную форму, поэтому для расчета
потенциала сначала необходимо вычислить константу равновесия, чтобы найти
равновесную концентрацию титранта. Расчет упрощается, можно
воспользоваться полуреакцией с участием
титруемого вещества, поскольку концентрации окисленной и восстановленной форм
его найти легко: количество сопряженной формы титруемого вещества,
образовавшейся при титровании, г количеству добавленного титранта. За точкой
эквивалентности картина обратная: все титруемое вещество превращено в сопряженную
форму и равновесная концентрация исходной формы ничтожно мала. Чтобы найти ее,
опять необходим константу равновесия реакции. Поэтому удобнее воспользоваться полуреакцией
с участием титранта, концентрацией окисленной и восстановленной форм которого
найти легко: в результате титрования образуется столько же сопряженной формы
титранта, сколько же вещества сдержалось в исходном растворе.
При построении кривых
окислительно-восстановительного титрования потенциал до начала титрования не
рассчитывают, поскольку в исходном растворе известна концентрация только одной
из сопряженных форм титруемого вещества.
До точки эквивалентности. Пусть
титруемое вещество - восстановитель, тогда
![]()
Если титруемое вещество -
окислитель, то
![]()
За точкой эквивалентности. Если
титруемое вещество восстановитель, а титрант – окислитель, то
![]()
в случае, если титрант –
восстановитель,
![]()
В точке эквивалентности неудобно
рассчитывать потенциал ни полуреакции титранта, ни полуреакции титруемого
вещества, поскольку в обоих случаях концентрация одной из сопряженных форм
исчезающе мала. Чтобы не прибегать к громоздким вычислениям с использованием
константы равновесия (хотя это и возможно), используем следующий несложный
прием. Запишем уравнение Нернста в точке эквивалентности для каждой полуреакции
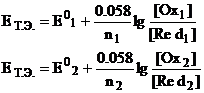
Сложим оба уравнения,
предварительно умножив их на n1, и n2 соответственно
![]()
Обратим внимание на выражение
под знаком логарифма. В точке эквивалентности концентрации реагирующих веществ
находятся в стехиометрических отношениях:
![]()
другими словами,
![]()
Следовательно, величина под
знаком логарифма равна 1 и
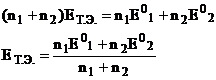
Как видно, во все уравнения для
расчета Е входят величины стандартных потенциалов. Если в процессе титрования
возможно протекание конкурирующей реакции или нельзя пренебречь ионной силой,
стандартные потенциалы следует заменить формальными.
На величину скачка на кривой
окислительно-восстановительного титрования влияет ряд факторов.
Природа титруемого вещества и
титранта. Чем больше разница стандартных потенциалов титруемого вещества и
титранта, тем больше скачок титрования.
Величина рН. Если в полуреакциях
окисления-восстановления участвуют ионы водорода, их концентрация входит в
уравнение Нернста и, следовательно, или величину скачка титрования. В этом
случае вместо стандартного потенциала испод формальный
![]()
где m - стехиометрический коэффициент
при H+
Конкурирующие реакции
комппексообразования с участием окисленной или восстановленной форм. В этом
случае, также как и в предыдущем, при расчете кривых титрования следует
пользоваться формальными потенциалами вместо стандартных.
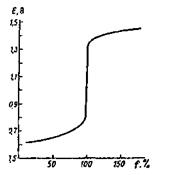
Пример1 . Постройте кривую титрования 100.0 мл 0.1000 М
раствора сульфата железа(П) 0.1000 М раствором сульфата церия (IV) в 1 М серной
кислоте.
Решение. В справочных таблицах есть
формальные потенциалы пар Fe(III)/Fe(II) и Ce(IV)/Ce(III) в 1 М
растворе серной кислоты:![]() ;
; ![]()
Воспользуемся ими для расчета
кривой титрования. В данном случае титруемое вещество - восстановитель, титрант
- окислитель.
До точки эквивалентности
![]()
В точке эквивалентности
![]()
За точкой эквивалентности ![]()

Величина
скачка увеличивается:
1.
При увеличении
концентрации реагирующих веществ.
2.
При увеличении
разности стандартных потенциалов редокс-пар.
3.
При увеличении
температуры титрования.
4.
Величина скачка
зависит от концентрации ионов гидроксония в соответствии с уравнением Нернста.
Если разность потенциалов редокс-пар более 0,5 В, то
возможно дифференцированное титрование смеси окислителей или восстановителей.