Химическое
равновесие. Общее термодинамическое условие равновесия и их выражения через характеристические
функции. Работа химической реакции. Три способа ее определения. Третий закон термодинамики. Абсолютная энтропия и вычисления
энтропии твердых, жидких и газообразных тел. Изотерма Вант-Гоффа.
Состояние системы, которое характеризуется
равенством скоростей прямой и обратной реакции и постоянством концентрации всех
веществ называется химическим равновесием.
mA + nB = pC +
qD
![]()
Константа равновесия зависит от природы веществ и
температуры и не зависит от исходных концентраций. В небольших количествах (1 –
2 атм) давление на константу равновесия не влияет.
DGo = – RTln(Kравн.)
Изменение константы равновесия с температурой
определяется изменения энтальпии. Если DН < 0, то с
увеличением температуры константа равновесия уменьшается. Если DН > 0, то с увеличением температуры константа
равновесия увеличивается.
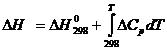
![]()
Смещение
равновесия.
Смещение равновесия – переход системы из одного
равновесного состояния в другое при изменении внешних условий.
Принцип Ле-Шателье.
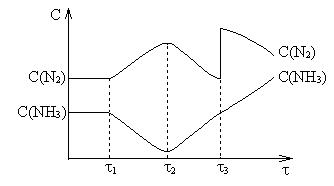
Если изменить одно из условий, при которых система
находится в равновесии, то в системе усилится та реакция которая
противодействует производственному изменению. На конденсированные системы давление
существенного влияния не оказывает.
N2 + 3H2 = 2NH3
Будем
рассматривать гетерогенные системы, много-компонентные, в которых протекают
химические процессы.
С
термодинамической точки зрения существуют системы изометрий закрытые. В
изомерных массообменах термическая и барическая связь отсутствует. Критерием
самопроизвольно протекающих процессов изомерных систем может служить изменение
энтропии, как было показано, этот критерий для закрытых систем не годится, так
как в закрытых системах массообмена нет, но существует термическая и барическая
связь. В таких системах V, Р, С являются
контролируемыми величинами, и в качестве критерия самопроизвольности процесса
обычно пользуются термодинамическим потенциалом F, G.
![]() ;
;
![]()
В случае
протекания химического процесса изучение системы начинают с его фазового
состояния – правило фаз Гиббса. По этому правилу определяют число степеней
свободы – число параметров, которые можно
изменить, чтобы число фаз не изменялось. Это число свободы не контролируется в
ходе процесса.
В связи с тем,
что в ходе химического процесса фазовое равновесие и фазовое состояние не
нарушается, такие понятия как активность и летучесть можно использовать и при
рассмотрении химического равновесия.
Обычно для
грубой оценки возможности простого химического процесса используются величины
теплового эффекта. Однако такая оценка является в большинстве случаев не совсем
точной, так как известно много реакций идущих с поглощением тепла, поэтому
наиболее правильно следует в качестве критерия считать ![]() ,
, ![]() .
.
![]() ;
; ![]() (1)
(1)
Самопроизвольный
процесс возможен, если ![]() и
и![]() . Когда эти величины больше нуля: 1.
. Когда эти величины больше нуля: 1. ![]() ;
; ![]() , т.е. в случае экзотермического процесса; 2.
, т.е. в случае экзотермического процесса; 2. ![]() ,
, ![]() ,
, ![]() ,
, ![]() , т.е. реакция будет идти за счет энтропийного члена.
, т.е. реакция будет идти за счет энтропийного члена.
![]()
![]()
Это может иметь
место в том случае, если ![]() , т.е. когда будет иметь место расширение в процессе реакции.
, т.е. когда будет иметь место расширение в процессе реакции.
Вывод: в общем случае
не могут величины тепла процессов являться критериями самопроизвольности процессов.
Чтобы ответить
на вопрос, при каких условиях энтропийным членом мoжно
пренебречь, надо рассмотреть уравнение (1).
![]() можно пренебречь, если
тепловой эффект будет очень велик; при малых Т, если реакция будет протекать в
твердой или жидкой фазе.
можно пренебречь, если
тепловой эффект будет очень велик; при малых Т, если реакция будет протекать в
твердой или жидкой фазе.
Раскроем смысл
всех величин уравнения (1):
![]() ;
;![]() ;
;![]()
Т.о., для
нахождения ![]() необходимо знать
тепловой эффект реакции данной Т, саму Т, найти
необходимо знать
тепловой эффект реакции данной Т, саму Т, найти ![]() .
.
Существуют три
способа нахождения ![]() .
.
![]()
1.
Исходим из сотоношения (1) и третьего
начала термодинамики.
2.
Основан на уравнениях изотермы, изобары и изохоры Вант-Гоффа.
3.
Базируется на определении ЭДС гальванических элементов.
Она состоит из
теоремы Нерста и постулатов Планка.
Теорема:
согласно теореме, при![]() ,
, ![]() ,
, ![]() .
.
Постулаты: при![]() , само значение
, само значение ![]() , т.е. энтропия правильного
кристаллического вещества при Т абсолютном
, т.е. энтропия правильного
кристаллического вещества при Т абсолютном ![]() = 0.
= 0.
Постулаты Планка
не распространяются на все твердые вещества.
Неправильно
построенные и аморфные тела не дают нулевой энтропии, однако энтропия их при
абсолютном нуле не невелика, т.о. абсолютное значение величины ![]() ни при каких условиях
нам неизвестны, известно только их изменение, в то время как можно определить
абсолютное значение
ни при каких условиях
нам неизвестны, известно только их изменение, в то время как можно определить
абсолютное значение ![]() . Это происходит потому, что нет точек отсчета для нахождения
этих термодинамических величин. Величина S
для индивидуальных веществ может быть найдена при Т = 0.
. Это происходит потому, что нет точек отсчета для нахождения
этих термодинамических величин. Величина S
для индивидуальных веществ может быть найдена при Т = 0. ![]() "0" – обозначает, что данное значение энтропии
абсолютное и отсчитанное от 0, индекс Т
показывает температуру, существует специальная
таблица с абсолютными значениями энтропии
"0" – обозначает, что данное значение энтропии
абсолютное и отсчитанное от 0, индекс Т
показывает температуру, существует специальная
таблица с абсолютными значениями энтропии ![]() .
.
Чтобы
использовать соотношение (1) ![]() ; находим
; находим ![]() :
:
![]()
абсолютное
значение энтропии было найдено следующим образом:
Известно, что:
![]() ;
; ![]() ;
; ![]() ;
; 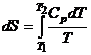
но, в
соответствии с третьем началом термодинамики, последнее уравнение можно
преобразовать для идеально твердого тела, если принять ![]() = 0.
= 0.
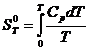
Это уравнение
дает возможность рассчитать абсолютное значение энтропии.
Зная энтропию
для твердого тела, можно найти энтропию для жидких и газообразных веществ. Это
практически делается так:
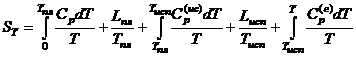
1 2
3 4 5
1 – обозначат энтропию твердого вещества,
далее, при переходе веществ в жидкое состояние, энтропия возрастает на величину
приведенной теплоты, появляется 2 член.
В
подинтегральную величину входит теплоемкость – С; затем идет испарение жидкости при Р = const.
Делается это
следующим образом:
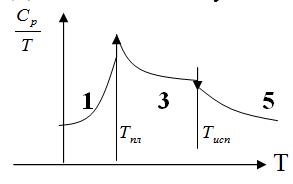
такие зависимости
строятся для каждого вещества, участвующего в реакции. ![]()
|
|
45,1 |
|
|
16,7 |
|
|
31,2 |
|
С
алм |
0,58 |
|
С
граф |
1,36 |
По выше
приведенной форме находят энтропию, зная абсолютное значение энтропии на ![]() :
:
![]() .
. ![]() рассчитано по абсолютному
значению S.
рассчитано по абсолютному
значению S.
Недостатком
этого метода является то, что необходимо знать значение С всех участвующих в
реакции веществ до абсолютного нуля.
Второй способ
основан на уравнениях изотермы Вант-Гоффа.
![]()
Для такой
реакции необходимо вычислить ![]() реакции,
реакции, ![]() = -
= -![]() .
.
Изменения
изобарного потенциала реакции при условии постоянства Р , Т определяется, как известно, следующим равенством:
![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
;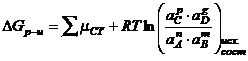
Это
не исходные вещества, а активности всех веществ до начала реакций. В начальный
момент все вещества берутся в произвольных концетрациях. Если реакция
закончившаяся, то наступило состояние химического равновесия, то активности и
концентрации всех веществ будут другими, отвечающие, этому состоянию равновесия.
В состояния равновесия ![]() = 0.
= 0.
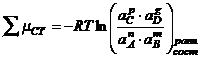 тогда
тогда
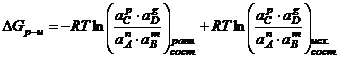
![]()
Это уравнение
называется уравнением изотермы Вант-Гоффа. Это уравнение, позволяет определить
максимально полезную работу при какой-то постоянной Т, если известны
активности, концентрация, и Р всех веществ до начала реакции и после нее.
![]() – это работа или энергия, следовательно
каждый член в правой части есть А или энергия. 1 член указывает энергию или A в равновесном состоянии;2 член указывает в исходном состоянии. Если реакция находится в равновесии,
то для члена такой системы
– это работа или энергия, следовательно
каждый член в правой части есть А или энергия. 1 член указывает энергию или A в равновесном состоянии;2 член указывает в исходном состоянии. Если реакция находится в равновесии,
то для члена такой системы ![]() = 0, эти два члена равна между собой.
Если
= 0, эти два члена равна между собой.
Если ![]() >0, то
>0, то ![]() , следовательно прямой процесс невозможен, возможен обратный
процесс;
, следовательно прямой процесс невозможен, возможен обратный
процесс; ![]() – прямой процесс возможен.
– прямой процесс возможен.
Чтобы сравнить
друг с другом различные реакции, необходимо исходное состояние выбрать
одинаковое. За стандартное состояние выбрали, когда активности всех участвующих
веществ в реакции равно1.
![]()
это стандартная
изотерма Вант-Гоффа.
В нашем примере ![]() равновесия выражается через активность, но она
может быть выражена через концентрацию
равновесия выражается через активность, но она
может быть выражена через концентрацию ![]() ,
, ![]() ,
, ![]() . Покажем связи между ними.
. Покажем связи между ними.
Согл-о ![]() ,
, ![]() ,
, ![]() ,
, 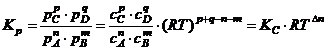 ;
;
Покажем связь ![]() и
и ![]() :
: ![]() (2);
(2); 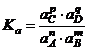 ; с учетом уравнения (2):
; с учетом уравнения (2):
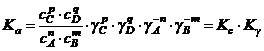 .
.
Выразим
![]() (константа мольной
доли). Выразим мольную долю для каждого вещества.
(константа мольной
доли). Выразим мольную долю для каждого вещества.
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; 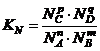
Как
выразить ![]() (константу выраженную через
давление)? Чтобы найти связь между
(константу выраженную через
давление)? Чтобы найти связь между ![]() и
и ![]() выразим константу
мольной доли.
выразим константу
мольной доли.
Р – общее давление в системе.
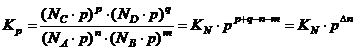
в случае ![]() ,
, ![]() :
:
![]() .
.
Если
рассматриваем сложную систему, в которой участвуют жидкие, твердые и газообразные
вещества, то как правило: для твердых
веществ используются активности, для веществ в растворе – концентрации, для газов – летучесть и постоянное давление.
Зависимость ![]() и константы равновесия от температуры.
и константы равновесия от температуры.
Очень часто
возникает необходимость расчета ![]() и константы равновесия при каких-то больших температурах,
зная
и константы равновесия при каких-то больших температурах,
зная ![]() и константу равновесия
при определенной температуре.
и константу равновесия
при определенной температуре.
Эта зависимость
дается уравнениями Гиббса-Гельмгольца изобарно-изотермического Вант-Гоффа.
![]() ;
; 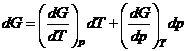 .
.
С другой стороны
согласно четвёртому объединенному уравнению: ![]() ;
; ![]() по определению
по определению ![]() – уравнение Гиббса-Гельмгольца
– уравнение Гиббса-Гельмгольца
Это уравнение
позволяет найти зависимость ![]() от температуры.
от температуры.
![]() – является
температурным коэффициентом полезной работы.
– является
температурным коэффициентом полезной работы.
Выведем
уравнение изобары Вант-Гоффа,
для этого уравнения Гиббса-Гельмгольца рассмотрим в таком виде: ![]() , поделим левую и правую
часть на
, поделим левую и правую
часть на ![]() :
:
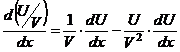 ;
; 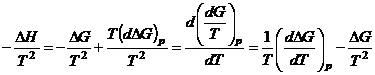 .
.
![]() – подставим в
последнее уравнение.
– подставим в
последнее уравнение.
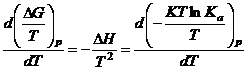 ;
;
 – изобара Вант-Гоффа.
– изобара Вант-Гоффа.
Если исходишь из
уравнения изохорно-изотермического потенциала то можно прийти к изохоре
Вант-Гоффа.
![]() – третье объединенное уравнение.
– третье объединенное уравнение.
Чтобы найти
зависимость константы от Т, уравнение Вант-Гоффа нужно проинтегрировать.
Если подставить
в эту производное значения V,U,H,F,G то мы получим
пропорциональные мольные величины.
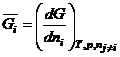
рассмотренных
термодинамических параметров. Мы знакомы с первой парциальной мольной величиной,
а именно с химическим потенциалом ![]() – есть парциальная
мольная величина. Покажем это.
– есть парциальная
мольная величина. Покажем это.
Мы знаем, ![]() ,
, ![]() – функция состояния,
поэтому
– функция состояния,
поэтому
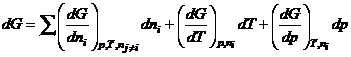 ;
;
при Р, Т = const: 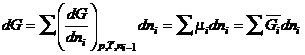 .
.
В данном случае
понятие химического потенциала и парциальной мольной величины совпало.
Физический смысл
химического потенциала есть парциально мольная величина
изобарно-изотермического потенциала.
Пусть мы имеем
смесь, которая содержит большее количество молей вещества; прибавим 1 моль
вещества, это существенно не изменит ни Р, С, V,
будет происходить только изменение изобарно-изотермического потенциала, который
будет равняться пропорциональному молю данного вещества в смеси. Это изменение и
является химическим потенциалом смеси.
Химический
потенциал, выражающийся через другие термодинамические функции, не является
парциальной мольной величиной.
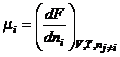
Не всякая
частная производная по компоненту является парциальной мольной величиной.
1
случай.
![]() , следовательно левая часть меньше нуля, это значит, что
, следовательно левая часть меньше нуля, это значит, что ![]() с увеличением Т
уменьшается, а чем меньше константа
с увеличением Т
уменьшается, а чем меньше константа ![]() , тем меньше концентрация продуктов реакции , т.е. при увеличении Т, когда
, тем меньше концентрация продуктов реакции , т.е. при увеличении Т, когда ![]() равновесии реакции
сдвигается в сторону исходных веществ. Это находится в соответствии с принципом
Ле-Шателье.
равновесии реакции
сдвигается в сторону исходных веществ. Это находится в соответствии с принципом
Ле-Шателье.
По законам
кинетики с повышением Т, повышается скорость реакции, и приходится выбирать
оптимальный режим работы, чтобы выход продуктов был максимальный и скорость
достаточной.
2
случай.
![]() , левая часть меньше
нуля, следовательно
, левая часть меньше
нуля, следовательно ![]() растет с увеличением
Т.
растет с увеличением
Т. ![]() увеличивается,
увеличивается концентрация продуктов, т.е. равновесие смещается в сторону
прямой реакции. В данном случае влияние на Т, кинетику и термодинамику
одинаково.
увеличивается,
увеличивается концентрация продуктов, т.е. равновесие смещается в сторону
прямой реакции. В данном случае влияние на Т, кинетику и термодинамику
одинаково.
Приближенное и
точное интегрирование изобары Вант-Гоффа.
При приближенном
интегрировании Т невелика, ![]() величина постоянная и не зависит от Т.
величина постоянная и не зависит от Т.
![]() ;
;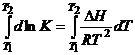 ;
; 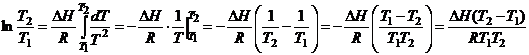
Зная К при
какой-то ![]() можно определить К при
какой то температуре
можно определить К при
какой то температуре ![]() .
.
Мы нашли
определенный интеграл ,найдем
неопределенный.
![]() ;
; ![]() ;
; ![]() .
.
Точное
интегрирование.
При точном
интегрировании в широком интервале Т, необходимо учитывать зависимость
теплового эффекта (зависимость дается уравнение Кирхгофа).
![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
;![]() ;
;![]()
Константа
интегрирования находится следующим образом, взяв ![]() при Т = 298
при Т = 298![]() из таблицы, подставим затем в последнюю формулу и определим
из таблицы, подставим затем в последнюю формулу и определим ![]() при любой температуре, затем подставляем значение
при любой температуре, затем подставляем значение ![]() при этой температуре в
уравнение изобары вант-Гоффа
при этой температуре в
уравнение изобары вант-Гоффа
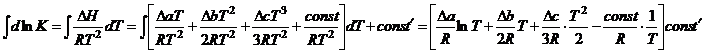 Константа находится так, как показано выше. Константа
Константа находится так, как показано выше. Константа ![]() находится аналогичным
способом – сначала подставляем const при Т = 298
находится аналогичным
способом – сначала подставляем const при Т = 298![]() . Затем К находят при
нужной Т. Зная константу при нужной Т,
можно найти зависимость изобарно-изотермического потенциала при любой Т.
. Затем К находят при
нужной Т. Зная константу при нужной Т,
можно найти зависимость изобарно-изотермического потенциала при любой Т.
![]()
![]() позволяет определить
зависимость
позволяет определить
зависимость ![]() от какой-то Т.
от какой-то Т.
Зная эту
зависимость, можно найти зависимость максимально полезной А от Т.
![]()
Достоинства.
Может применятся
к любым реакциям. Позволяет рассчитать ![]() при любых температурах, даже очень высоких.
при любых температурах, даже очень высоких.
Может оказаться,
что влияние Т во многих случаях настолько больше, что может меняться К, ![]() ,но и знак этих величин, т.е. процесс может изменить направление.
,но и знак этих величин, т.е. процесс может изменить направление.
Недостатки.
Необходимо
знание константы интегрирования и значение ![]() , К при температуре 298
, К при температуре 298![]() .
.