Алканы,
их свойства.
Все атомы углерода в алканах находятся в sp3
– состоянии. Предельные углеводороды образуют гомологический ряд,
характеризующийся общей формулой СnН2n+2. Родоначальником
этого ряда является метан.
Начиная с этана, алканы способны образовывать
конформеры, которым соответствует заторможенная конформация.
Природные
источники и методы получения алканов.
1. Фракционная перегонка природного газа или
бензиновой фракции нефти. Таким способом можно выделять индивидуальные
алканы до 11 углеродных атомов.
2. Гидрирование угля. Процесс проводят в
присутствии катализаторов (оксиды и сульфиды молибдена, вольфрама, никеля) при
450-470оС и давлениях до 30 Мпа. Уголь и катализатор растирают в
порошок и в суспензированном виде гидрируют, борботируя водород через
суспензию. Получающиеся смеси алканов и цикла алканов используют в качестве
моторного топлива.
3. Гидрирование СО и СО2.
СО + Н2 ® алканы
СО2 + Н2 ® алканы
В качестве катализаторов этих реакций используют Со,
Fe, и др. d - элементы.
4. Гидрирование алкенов и алкинов.
В качестве катализаторов используют Ni, Pt, Pd.
5. Металлоорганический синтез.
а) Синтез Вюрца.
2RHal + 2Na ® R¾R + 2NaHal
Этот синтез малопригоден, если в качестве органических
реагентов используют два разных галогеналкана.
б) Протолиз реактивов Гриньяра.
RHal + Mg ® RMgHal
RMgHal + HOH ® RH +
Mg(OH)Hal
6. Электролиз солей карбоновых кислот (синтез
Кольбе).
2RCOONa + 2H2O
® R¾R + 2CO2 + 2NaOH +
H2
7. Сплавление солей карбоновых кислот со щелочами.
t
RCOONa + NaOH ® RH + Na2CO3
Реакция используется для синтеза низших алканов.
б) Галогеналканы. Каталитический гидрогенолиз.
RHal + H2 RH + HHal
В качестве катализаторов используют Ni, Pt, Pd.
Физические
свойства алканов.
Алканы представляют собой бесцветные вещества, в обычных условиях газообразные
или жидкие. Алканы с большим числом углеродных атомов (nC>15) – твердые вещества. Жидкие и твердые алканы
намного легче воды.
Молекулы алканов представляют собой совокупность s-связей
(С-Н и С-С), характеризующихся высокой прочностью,
низкими полярностью и поляризуемостью.
Химические
свойства алканов.
Высокая прочность С-С и С-Н связей в алканах обусловливают их высокую
инертность, а низкая полярность и поляризуемость – склонность к гомолитическим
реакциям. По этим причинам большинство реакций алканов имеет радикальный
характер, а для успеха их протекания требуется внешнее энергетическое воздействие
(например, температура, фотолиз, катализ).
Свободнорадикальные реакции алканов.
1. Галогенирование.
Алканы очень активно взаимодействуют с фтором, реакция
с хлором происходит при освещении и нагревании, взаимодействие с бромом
осуществляют при совместном освещении и нагревании. Такие различия обусловлены
различной энергетикой реакций галогенирования.
Механизм развития цепей этих реакций можно представить
двумя последовательными стадиями.
X· + RH ® HX + R· (1)
R· + X2 ® RX + X· (2)
2. Сульфохлорирование
RH + SO2 + Cl2 ® RSO2Cl + HCl
3. Нитрование алканов
Нитрование алканов – типичная
реакция свободнорадикального замещения. В качестве нитрующих агентов выступают
оксиды азота или азотная кислота (10-25%)
RH + HONO2
® RNO2 + H2O
(1)
Реакция осуществляется в жидкой фазе при температурах
140-150оС под давлением (реакция Коновалова).
Свободные радикалы образующиеся в результате
термического гомолиза азотной кислоты.
4. Реакции окисления.
Реакции окисления алканов осуществляет в газовой и жидкой фазах. Из газофазных
реакций практическое значение имеет окисление метана. Окисление метана имеет последовательно–параллельный
характер в соответствии со схемой:
CH4 CH3OH CH2O
HCOOH H2O +
CO2
5. Реакции крекинга.
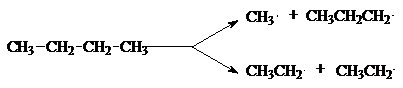
При нагревании выше 500оС алканы
подвергаются пиролитическому разложению с образованием сложных смеси продуктов,
состав и соотношение которых зависит от температуры и времени реакции типичный
свободнорадикальный процесс, инициируемый гомолитическим распадом
углерод-углеродных связей исходных алканов. Механизм этого процесса может быть
представлен на примере крекинга н-бутана.
Алкены,
их свойства.
Алкены (олефины) - углеводороды, в молекулах которых
содержится одна двойная углерод-углеродная связь >C=C<, а все
остальные атомы углерода находятся в sp3 - состояния.
Алкены образуют гомологический ряд соединений, состав
которых выражается эмпирической формулой CnH2n.
Изомерия и номенклатура алкенов.
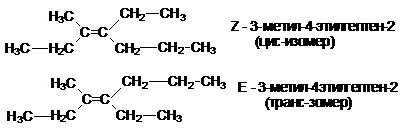
Старшинство углеводородных заместителей увеличивается
в ряду:
Чтобы отнести изомер к Z- или Е- ряду необходимо среди четырех заместителей у
двойной связи найти два самых старших. Если оба старших заместителя расположены
по одну сторону плоскости, в которой лежит двойная связь, изомер относится к Z-ряду, в противном случае к Е-ряду. (см. пример
названий выше).
Методы получения алкенов.
1. Дегидрирование
и крекинг алканов.
CH3CH2CH2CH3 CH3CH=CH-CH3 + H2
При более высоких температурах происходит также разрыв
связей С-С и получаются смеси различных алканов и алкенов, у которых
молекулярная масса меньше, чем у исходных алканов (крекинг).
Эти методы имеют промышленное значение.
2.
Дегидратация спиртов.
R-CH2CH2OH
R-CH=CH2
+ H2O
Особенностью этих реакций
является порядок отщепления воды, определяемый правилом Зайцева: при отщеплении
воды наиболее легко отщепляется водород от соседнего наименее гидрированного
атома углерода.
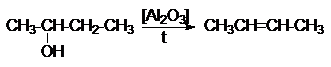
3.
Дегидрогалогенирование галогеналканов.
Эта реакция может осуществляться в двух вариантах:
а) щелочное дегидрогалогенирование
CH3CH2Br
+ KOH CH2=CH2
+ KBr + H2O
Порядок отщепления галогеноводорода в этих реакциях
также определяется правилом Зайцева: при отщепление HHal наиболее легко отщепляется водород от наименее
гидрированного атома углерода.
4. Отщепление галогенов от вицинальных дигалогеналканов металлическим
цинком.
R-CHBr-CHBr-R' + Zn
R-CH=CH-R' + ZnBr2
5. Селективное гидрирование диенов и алкинов.
CH2=CH-CH=CH2
+ H2 CH3-CH=CH-CH3
R-CºC-R' + H2
R-CH=CH-R'
7. Реакция Гофмана – расщепление четвертичных аммониевых солей под действием
оснований.
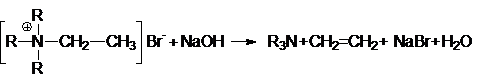
Физические свойства алкенов.
Алкены С2-С4 – газы, следующие
за ними члены гомологического ряда – бесцветные жидкости или кристаллические
вещества.
Плотность алкенов выше по сравнению с алканами с тем
же числом углеродных атомов. Это обусловлено более сильными межмолекулярными
взаимодействиями в алкенах причиной которых являются высокая поляризуемость
двойной связи: так RC-C=1,29 a RC=C=4,17.
![]()
Высокая поляризуемость двойной связи обусловливает ее
значительное поляризацию под действием полярных групп.
Введение алкильных групп у двойной связи увеличивает
стабильность молекул алкенов. Это можно проиллюстрировать различием в теплотах
гидрирования соответствующих алкенов.
Электронографическое изучение этилена показало, что
геометрия молекулы резко отличается от пространственного строения алканов.
Молекула этилена плоская. Углы между связями близки к 120о, связь
С=С намного короче связи С-С. Потенциал ионизации в алкенах на 1-1,5 эв меньше,
чем у соответствующих алканов, что свидетельствует об электронодонорных
свойствах двойной связи.
Химические свойства.
Химические свойства алкенов определяются рядом
факторов: относительно слабой p-связью в двойной связи, поляризуемостью последней, электронодонорными
свойствами двойной связи, способностью ее к сопряжению с реакционным центром,
возникающим при a-углеродном атоме.
Поэтому естественными реакциями алкенов являются
реакции присоединения, среди которых наиболее представительными являются
реакции электрофильного присоединения, а также реакции замещения, в которых
подвижными являются атомы и группы при a-углеродном атоме по отношению к двойной связи.
1. Реакция гидрирования.
Реакции гидрирования алкенов
являются иллюстрацией ненасыщенного характера алкенов в силу отмеченной выше
слабости p-связи. Последняя легко
рвется под действием гидрирующего агента и по освобождающимся валентностям присоединяются
атомы водорода.
RCH=CH2
+ H2 R-CH2-CH3
В качестве катализаторов используют Pd, Pt, Ni, нанесенные на пористые носители: g-AI2O3, SiO2, алюмосиликаты,
активированный уголь.
Присоединение водорода происходит в цис-положение.
Такой характер присоединения обусловлен геометрией активированного комплекса на
реакции гидрирования на поверхности катализатора:

2. Реакции электрофильного присоединения
по двойной связи алкенов.
а) Реакции галогенирования.
Алкены легко реагируют в обычных условиях с растворами
CI2 или Br2 в инертном
растворителе (например, CCI4) согласно стехиометрическому уравнению:
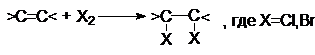
J2 в этих
реакциях значительно менее активен.
Механизм реакций галогенирования может быть
представлен последовательностью стадий (1) – (5), предполагающей образование p-комплексов между молекулами галогена и кратной связью
алкена с последующим его переходом в s-комплекс (I) и
(или) неклассический катион (II). Заключительными
стадиями являются реакции (4) и (5), представляющие собой быструю нуклеофильную
атаку интермедиатов I и II с образованием продукта галогенирования.
Скорость – определяющей стадией в этих реакциях
является переход p- комплекса в s-комплекс.
Аргументами в пользу этого являются:
-
кинетическое
уравнение реакций галогенирования двойных связей
r =
k[>C=C<][Br2]
-
ускорение реакций
сильно сольватирующими растворителями
-
ряд реакционной
способности алкенов в реакциях галогенирования:
(CH3)2C=CH2
> CH3-CH=CH2 > CH2=CH2
соответствующий ряду стабильности соответствующих s-комплексов:
Å Å Å
(CH3)2C-CH2Cl
> CH3-CH-CH2-Cl > CH2-CH2Cl
В общем случае повышение реакционной способности алкенов обусловлено наличием
при углеродных атомах кратных связей электронодонорных заместителей.
б) Взаимодействие с Н-электрофилами.
В качестве Н-электрофилов в этих реакциях могут
выступать протонные кислоты, вода, сероводород, спирты, тиоспирты и др.
Присоединения Н-электрофилов к алкенам характеризуется
стехиометрическим уравнением
R-CH=CH2
+ HX ® R-CHX-CH3
В общем виде механизм этих реакций может быть проиллюстрирован последовательностью стадий:
Характер скорость-определяющей стадии дает обоснование
реакционной способности реагентов в этой реакции
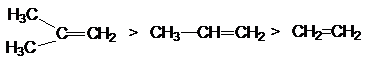
определяемой рядом стабильности карбкатионов
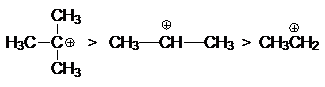
С другой стороны, ряд реакционной
способности галогеноводородов:
HI > HBr >
HCl > HF
определяется
кислотностью этих реагентов. Действительно, из рассмотрения скорость-определяющей
стадии можно видеть, что при образовании s-комплексов реализуется кислотность этих реагентов.
Порядок присоединения Н-электрофилов определяется
правилом Марковникова, согласно которому водород Н-электрофила присоединяется к
наиболее гидрированному атому. Причиной такого характера присоединения является
большая энергетическая стабильность карбокатиона, образующегося при
присоединении протона к более гидрированному углеродному атому двойной связи.
Можно видеть, что дилемма образования карбокатионов в рассмотренном примере решается
в пользу первого, стабилизированного индуктивным эффектом алкильных групп и
эффектом снятия стерических напряжений. Соответственно, более предпочтительное
образование карбокатиона R-CHÅ-CH3 обусловливает образование продукта R-CHX-CH3.
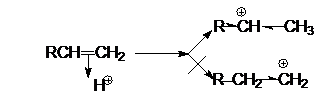
3. Взаимодействие с катионами металлов.
Алкены образуют p-комплексы с катионами металлов, содержащих незаполненные
орбитали, например:
![]() CH2=CH2
+ PdCl2 « CH2==CH2
CH2=CH2
+ PdCl2 « CH2==CH2
PdCl2
Образование таких комплексов объясняется
донорноакцепторной взаимодействием, где алкен выступает в роли донора
электрона, а ион металла в качестве акцептора.
4. Гидроборирование алкенов.
При взаимодействии диборана или замещенных диборанов с
алкенами образуются триалкилпроизводные бора
6RCH=CH2
+ B2H6 ® 2[RCH2CH2]3B
4RCH=CH2
+ B2H4(C2H5)2 ® 2(RCH2CH2)2B(C2H5)
6. Реакции циклоприсоединения.
a) Циклоприсоединение [2+1].
К этому типу относятся реакции алкенов с карбенами.

б) Циклоприсоединение [2+2].
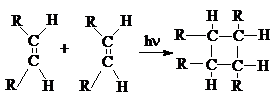
в) Циклоприсоединение [2+4].
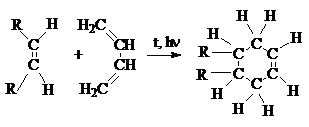
7. Реакции окисления алкенов.
а) Окисление разбавленными растворами KMnO4 в
слабощелочной среде (окисление по Вагнеру).
R-CH=CHR R-CH(OH)-CH(OH)-R
б) Окисление концентрированными растворами
окислителей.
При действии этих окислителей происходит разрыв
молекулы алкена по месту двойной связи с образованием кетонов и кислот.
(CH3)2C=CH-CH3
(CH3)2C=O
+ CH3COOH
CH3CH=CH-CH2CH3
CH3COOH
+ HOOC-CH2CH3
Эта реакция широко используется для определения
строения алкенов.
в) Озонолиз.
Озонолиз представляет собой комбинацию
последовательных реакций озонирования и гидролиза:
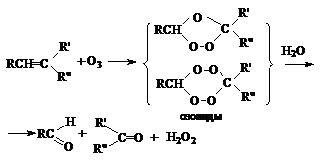
Озонолиз используют для установления строения алкена,
так как его результаты является селективное расщепление молекулы алкена по
месту двойной связи.
г) Окисление пероксикислотами и гидропероксидами
(реакция Прилежаева).
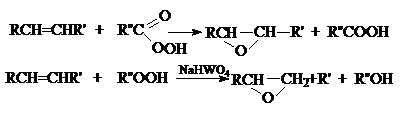
Результатом этих реакций является синтез
эпоксидов, соединений, содержащих трехчленный оксидный цикл.
Промышленный вариант реакции эпоксидирования связан с
каталитическим окислением этилена кислородом или воздухом на нанесенных серебряных
катализаторах.
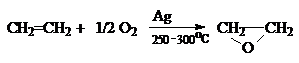
д) Окисление алкенов в присутствии PdCI2.
CH2=CH2
+ 1/2O2 CH3CHO ацетальдегид
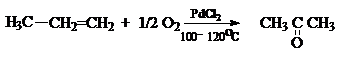
9. Гидроформилирование или оксосинтез
Этим способом в промышленности получают альдегиды,
которые затем перерабатывают в спирты
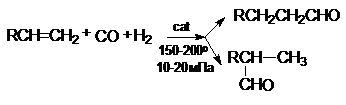
В качестве катализатора этой реакции используют
комплексное соединение – гидрокарбонил кобальта HCo(Co)4.
10. Радикальные реакции алкенов.
Выше уже упоминались радикальные реакции алкенов,
такие как гидробромирование в присутствие пероксидов и радикальная
полимеризация. Другими радикальными реакциями с участием алкенов являются:
а) теломеризация
Теломеризация – олигомеризация алкенов в присутствии
веществ – передатчиков цепи (телогенов). В результате реакции образуется смесь
олигомеров (теломеров), концевые группы которых представляют собой части телогена.
Например, в реакции CCl4 с этиленом телогеном является CCl4.
CCl4 +
nCH2=CH2 ® Cl(CH2CH2)4CCl3
б) Присоединение H2S и RSH
в присутствии инициаторов радикальных реакций.
RCH=CH2
+ H2S RCH2CH2SH
RCH=CH2
+ RSH RCH2CH2SR
Можно видеть, что такое присоединение идет против
правила Марковникова. Обоснование такого порядка присоединения такое же, как и
в случае свободнорадикального гидробромирования алкенов. (см. выше)
в) Галогенирование кратной связи.
Cl2 и Br2 могут
присоединяться по двойной связи алкена по свободноразикальному механизму. Эти
реакции протекают гораздо быстрее, чем реакции ионного галогенирования, но
требуют химического или фотохимического инициирования.
г) Аллильное замещение галогенами.
В условиях высоких температур (300-400оС)
пропен и другие алкилзамещенные алкены хлорируются в паровой фазе в аллильное
положение.
CH2=CH-CH3
+ Cl2 CH2=CH-CH2Cl
+ HCl
Такое направление хлорирования связано со
стабильностью аллильного радикала, образующегося при реализации радикально-цепного
процесса:
Аллильное бромирование можно провести в лабораторных
условиях, используя N-бромсукцинимид и инициатор
свободнорадикальных реакций
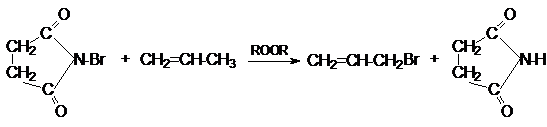
Алкадиены,
их свойства.
Углеводороды с открытой цепью, содержащие две двойные
связи, называются алкадиенами. В зависимости от взаимного расположения двойных
связей различают следующие типы алкадиенов. Если двойные связи располагаются у
одного атома углерода, то они называются алкадиенами – 1,2 или алленами, например:
СН2=С=СН2 пропадиен – 1,2, аллен
Методы синтеза 1,3-алкадиенов.
1. Дегидрирование алканов
а) дегидрирование бутан-бутеновой фракции
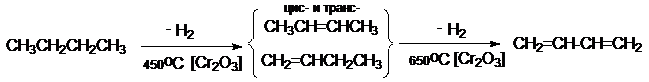
б) Дегидрирование изопентан-изопентеновой фракции
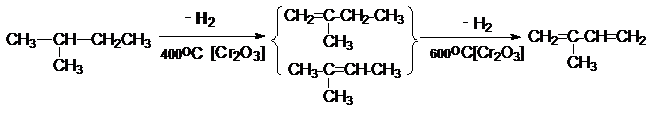
Рассмотренные методы имеют промышленное значение
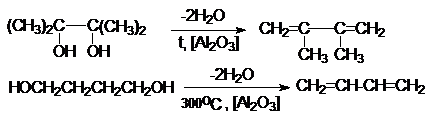
2. Дегидратация гликолей
3.Дегидратация ненасыщенных спиртов
4. Реакции сочетания винилгалогенидов
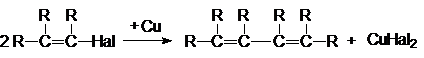
Винилгалогениды вступают также в реакцию сочетания под
действием Cu2Cl2, Zn в присутствии NiCl2,
н-бутиллития в присутствии MnCl2.
5. Димеризация ацетилена с последующим селективным
гидрированием
[Cu2Cl2] +H2
НС º СН +
HC º CH ––––® CH º C – CH = CH2 –––® CH2 = CH – CH = CH2
6. Метод C.В. Лебедева
450oC
2C2H5OH ––––® CH2 = CH – CH = CH2 + 2H2O + H2
[Al2O3,
ZnO]
Этот метод был первым процессом получения
бутадиена-1,3, освоенным в промышленном масштабе. В настоящее время он
вытесняется более прогрессивным методом дегидрирования бутан-бутеновой фракции.
7. Расщепление 4,4-диметил-1,3диоксана, который
получают конденсацией изобутена и формальдегида:
Физические свойства и строение алкадиенов–1,3.
Алкадиены–1,3 являются бесцветными веществами. Первые
члены гомологического ряда - газы или низкокипящие жидкости. Для алкадиенов
–1,3 характерна повышенная молекулярная рефракция. В расчете на одну кратную
связь она оказывается Rc=c=6,33, т.е. больше, чем у тройной связи. Это характерно
для систем сопряженных связей.
Теплота гидрирования алкадиенов–1,3 на 13-16 кДж
меньше, чем теплота гидрирования отдельных двойных связей. Это свидетельствует
о большей стабильности сопряженных систем на величину энергии сопряжения.
Структурные исследования молекулы бутадиена–1,3
методом электронографии показывает, что все ее атомы лежат в одной плоскости.
Наиболее энергетически выгодным и поэтому наиболее вероятным является расположение
двойных связей в транс-конформации по отношению к одинарной связи. Длина связей
С–С (0,146 нм) отличается от длины связи С=С в этилене (0,133 нм) и С–С в этане
(0,154 нм). Эти данные являются дополнительным аргументом в пользу сопряжения
двух p-связей в алкадиенах-1,3.
Важные выводы о строении сопряженной системы дают
результаты квантово-химических расчетов.
В молекуле бутадиена наибольшие электронные плотности
во фронтальных орбиталях находятся на концевых атомах углерода. Это означает,
что атака как электрофильных, так и нуклеофильных реагентов начинается с концевых
(С1 и С4) атомов углерода.
Порядок p-связей свидетельствует, что для бутадиена характерны
значительно выравненные (делокализованные) связи. Это подтверждается их длиной.
Энергия возбуждения p-связей в сопряженных диенах DЕ=ЕВЗСМО – ЕНСМО. Сравнение с
этиленом показывает, что для сопряженных систем DЕ меньше, чем для несопряженных, поэтому УФ-поглощения
наблюдается при больших длинах волн – СН2= СН2 – 180-200
нм; СН2=СН–СН= СН2 – 217-220 нм.
Химические свойства алкадиенов–1,3.
Характерными реакциями всех алкадиенов являются
реакции присоединения. Наиболее важными среди них являются:
1. Реакции гидрирования.
Эти реакции имеют ступенчатый характер. Варьируя
соотношение реагентов, может получать либо алкен, либо алкан в соответствии со
схемой
![]()
![]()
![]() CH2=CH-CH2CH3
CH2=CH-CH2CH3
CH2=CH-CH=CH2
CH3CH2CH2CH3
CH3CH=CH-CH3
Катализаторами этих реакций являются Ni, Pt, Pd. Особенностью
этих реакций является конкуренция 1,4– и 1,2–присоединения. Это связано с наличием
двух реакционных центров у поверхностного интермедиата, образующегося в
2. Реакции электрофильного присоединения
а)
Галогенирование
При реализации этой реакции образуется смесь продуктов
1,2– и 1,4–присоединения, например:
BrCH2CHBrCH=CH2
20% (40oC) 80% (-80 oC)
CH2=CHCH=CH2
+ Br2 ® BrCH2CH=CHCH2Br
80% (40oC) 20% (-80 oC)
Изменение состава продуктов первичного галогенирования
при изменении температуры обусловлено изменением характера факторов,
определяющих соотношение продуктов. Так, в области высоких температур конкурирующие
реакции быстро достигают положения равновесия, и состав продуктов будет
определяться соотношением их равновесных концентраций. Таким образом, в
области высоких температур осуществляется термодинамический контроль состава
продуктов. В области низких температур из-за высокой экзотермичности каждой из
конкурирующих реакций их равновесия существенно смещены в сторону продуктов, а
скорости их слишком малы, чтобы заметно приблизиться к состоянию равновесия.
Поэтому обе реакции протекают в условиях практической необратимости, когда
состав продуктов определяется соотношением их скоростей. Это область кинетического
контроля состава продуктов.
б) Реакции
гидрогалогенирования.
При реализации этих реакций образуются продукты
конкурентного галогенирования:
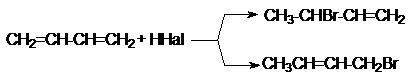
в)
Полимеризация
Стехиометрически полимеризация сопряженных алкадиенов
описывается следующими уравнениями
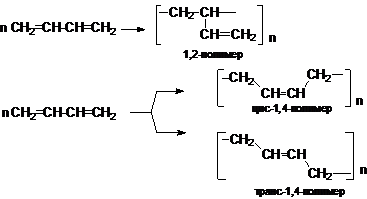
Полимеризация сопряженных алкадиенов имеет важное
практическое значение для синтеза каучуков. Реакция может осуществляться по
свободнорадикальному, карбанионному и
карбкатионному механизмам в зависимости от типа инициирующей системы. В
промышленной практике наиболее широко реализуется стереорегулярная
полимеризация под действием катализаторов Циглера-Натта.
Механизм радикальной полимеризации может быть
представлен на примере 1,4–присоединения.
Полимеризация по Циглеру-Натта приводит к образованию
стереорегулярного каучука, причем в основном образуются цис-полиалкадиены.
Натуральный каучук представляет собой эластичную при
низких температурах, пластичную и клейкую при более высоких температурах массу,
которую получают при нагревании млечного сока растений – каучуконосов, таких
как гевея. Первое практическое применение натурального каучука нашел Макинтош
(1823) – при пропитывании тканей раствором каучука он получил водонепроницаемый
материал. Наибольшее значение для широкого использования каучука имело открытие
Гудьира (1839). Он обнаружил, что при обработке каучука серой или серосодержащими
соединениями получается материал с превосходными механическими свойствами. Так
была впервые получена резина. Сера, реагируя по аллильному водороду и двойной
связи образует мостики, связывающие между собой полимерные цепи.
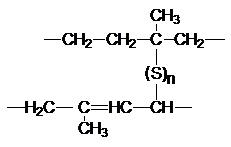
Этот процесс называется вулканизацией. При
исследовании строения натурального каучука было показано, что он является
полимером изопрена. Позже на основе рентгеноструктурного анализа было
установлено, что натуральный каучук имеет строение цис-полиизопрена. В природе
встречается также транс-полиизопрен, называемый гуттаперчей, который является
твердым хрупким материалом и поэтому не находит широкого практического применения.
3. Реакции диенового синтеза
Алкадиены–1,3 могут присоединяться к двойной (или
тройной) связи с образованием циклического продукта (циклоприсоединение [2+4]).

Условием успешного протекания реакции является такая
геометрия реагентов, при которой оба конца диена ориентированы на углеродные
атомы кратной связи диенофила. При этом происходит согласованный процесс
образования новых и разрыва старых связей с синхронным перемещением всех p-электронов циклической системы
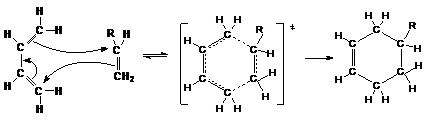

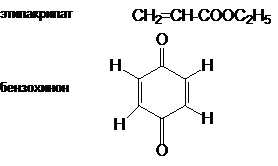
Поскольку комплементарная электронная природа обоих
реагентов является главным условием протекания реакции циклоприсоединения, то
наиболее реакционноспособными диенами в реакциях с перечисленными диенофилами
являются диены, содержащие при двойных связях электронодонорные группы.
Аллены,
их свойства.
Способы получения.
1. Дегалогенирование вицинальных дигалогеналкенов
цинком
СH2 = C – CH2Br + Zn СH2 = C = CH2 + ZnBr2
½
Br
2. Изомеризация алкинов
![]() CH3 – CH
– C º CH (CH3)2C
= C = CH2
CH3 – CH
– C º CH (CH3)2C
= C = CH2
CH3
Физические свойства и структура алленов.
Аллены – бесцветные газы (С3, С4)
или жидкости со слабым запахом.
Углеродные
атомы в молекуле аллена находятся в различных состояниях гибридизации:
средний атом углерода – в sp–состоянии, два кратных – в sp2–состоянии.
Поэтому p-связи, образуемые этими
атомами с центральным находятся во взаимно перпендикулярных плоскостях.
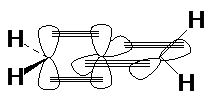
Благодаря такому строению все три атома углерода
находятся на одной прямой, а заместители при крайних атомах углерода находятся
во взаимно перпендикулярных плоскостях. В случае двузамещенных алленов для них
возможны стереоизомеры.
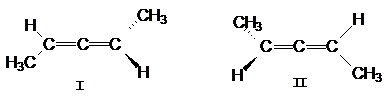
Можно видеть, что структура II является зеркальным
отражением структуры I.
Реакции алленов.
Аллены активны в различных реакциях, особенно в
реакциях присоединения и полимеризации, однако они более реакционноспособны,
чем алкены из-за напряжения, связанного с наличием двух двойных связей при
центральном углеродном атоме. Наиболее типичными реакциями алленов являются.
1. Каталитическое гидрирование
CH2 = C
= CH2 CH3CH =
CH2
Cat: Ni, Pt, Pd
2. Изомеризация
CH2 = C
= CH2 CH3C º CH
3. Циклизация
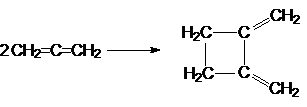
4. Реакции электрофильного присоединения
В этих реакциях
центром электрофильной атаки является один из крайних атомов углерода
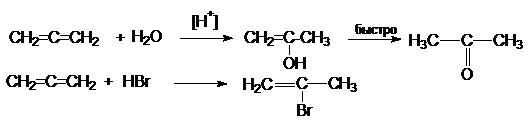
5. Реакции карбонилирования
![]() CH2 = C = CH2 + CO CH2 = C – COOH
CH2 = C = CH2 + CO CH2 = C – COOH
CH3
метакриловая кислота
![]() CH2 = C
= CH2 + CO CH2 = C
– COOCH3
CH2 = C
= CH2 + CO CH2 = C
– COOCH3
CH3
метилметакрилат
![]() CH2 = C
= CH2 + CO CH2 = C
– CONH2
CH2 = C
= CH2 + CO CH2 = C
– CONH2
CH3
метакриламид
Получаемые при этом продукты используются в качестве
мономеров при получении химических волокон и пластмасс.
Алкадиены с изолированными связями.
Для алкадиенов этого типа характерны те же свойства,
что и для алкенов, поскольку взаимное влияние двойных связей на расстоянии,
более чем две С–С-связи пренебрежимо на фоне влияния ближнего структурного окружения
двойной связи.
Алкины, их свойства.
Алкины – углеводороды ациклического ряда, содержащие в своей структуре
два атома углерода, связанные между собой тремя связями, а оставшиеся
валентности этих атомов могут быть затрачены на образование связей с другими
атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений,
выраженных общей формулой СnH2n-2. Первый
член гомологического ряда – этин или ацетилен.
Методы
синтеза алкинов.
1.
Реакции пиролиза метана или этана
2CH4 ![]() C2H2 + 3H2
C2H2 + 3H2
CH3 - CH3
C2H2 +
2H2
При
пиролизе метана необходимо строго выдерживать время реакции. Для этого
используется «закалка» - быстрый ввод на выходе реакционной зоны воды.
2.
Карбидный метод
CaC2 + 2H2O
® C2H2
+ Ca(OH)2
Аналогично реагируют карбиды стронция и бария SrC2, BaC2.
Карбид магния с
водой образует пропин
Mg2C3
+4 H2O ® CH3C º CH + 2Mg(OH)2
3.
Реакции нуклеофильного отщепления дигалогеналканов и
моногалогеналкенов.
CH3-CHBr-CH2Br
+ 2NaOH CH3-CºCH + 2NaBr + 2H2O
CH3-BrC=CH2
+ NaOH CH3-CºCH + NaBr + H2O
4.
Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
a)
R-CºCH + NaNH2 ® R-CºC-Na+
+ NH3
R-CºCNa + R'Hal ® RCºCR' + NaHal
b)
R-CºC-H +CH3-MgHal ® R-CºC-MgHal + CH4
R-CºC-MgHal + R’Hal ® R-CºC-R’ + MgHal2
Физические
свойства алкинов и природа связей.
Алкины представляют собой бесцветные газы или
жидкости. Начиная с С17 алкины являются кристаллическими веществами.
Тройная связь представляет собой одну s-связь С-С и две p-связи. При переходе от двойной к тройной связи
средняя энергия p-связи снижается. Это означает, что тройная связь менее стабильна, чем
двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному
взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что
обусловлено sp-состоянием атомов углерода.
Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах
RCºC=5,96; RC=C=4,17.
По сравнению с алкенами алкины характеризуются большими значениями потенциалов ионизации.
Это означает, что электрон на ВЗМО у ацетилена связан прочнее чем у этилена.
Это обусловливает более высокую электрофильность алкенов по сравнению с
алкинами. Потенциал ионизации алкинов резко снижается при введении в них алкильных
групп.
Химические свойства алкинов.
Высокая степень ненасыщенности алкинов обусловливает их склонность к
реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению
с алкенами, несмотря на то что энергия p-связей у последних выше. Это обусловлено более
высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический
характер, например, каталитическое гидрирование, большую реакционную способность
обнаруживают алкены.
1.
Реакция
гидрирования.
Реакция имеет ступенчатый характер:
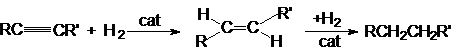
Сat:
металлические Ni, Pl, Pd.
Реакции электрофильного присоединения.
1.
Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам,
участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в
том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:
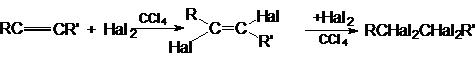
Промежуточный дигалогенид может быть получен
присоединением одной молекулы галогена к алкину при низких температурах, причем
реакция протекает преимущественно как транс.
2.
Присоединение галогеноводородов к алкинам.
Присоединение хлоро- и
бромоводорода к алкинам протекает также, как и к алкенам. Реакция имеет ступенчатый
характер.
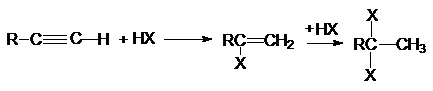
Обе реакции идут по правилу Марковникова. Показано, что
присоединение галогеноводородов к алкинам идет как транс-присоединение.
Поскольку реакционная способность тройной связи меньше чем у алкенов,
используют катализ: например HgCl2.
3. Реакция
гидратации (Реакция Кучерова)
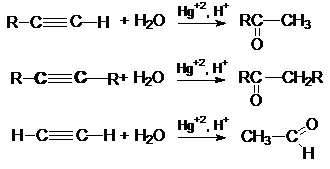
4.
Присоединение HCN.
HCºCH + HCN CH2=CHCN акрилонитрил
5.
Присоединение спиртов.
HCºCH + ROH CH2=CH-OR
виниловый эфир
Кислотные
свойства ацетилена и алкинов с терминальной тройной связью.
Соединения этого типа являются С-Н – кислотами. Атом
водорода, находящийся при углероде тройной связи обладает большей кислотностью,
чем атом водорода алкенов и алканов. Объясняется это тем, что атомы Сº обладают большим s-характером и поэтому сильнее притягивают электроны, поэтому
С-Н связи поляризованы и электроположительные атомы водорода в них проявляют
большую кислотность. Кислотность ацетилена и a-алкинов проявляется в следующих реакциях:
RCºCH + K+NH RCºC-K+
+ NH3
Амид-анион обладает высокой основностью, что
обусловливает сдвиг равновесия в сторону образования ацетиленида.
Натриевые, калиевые и другие ацетилениды щелочных
металлов являются истинными солями, состоящие из катиона металла и
ацетиленид-анионов. Соли ацетиленов с тяжелыми металлами (Ag, Cu, Hg) – не в полном смысле соли. Это ковалентно-построенные
соединения, нерастворимые в воде. Они осаждаются из водного раствора.
Осаждением ацетиленида серебра определяют наличие
тройной связи или отделяют терминальные ацетилены от дизамещенных:
RCºCH + [Ag(NH3)2]NO3
® RCºCAg + NH4NO3
+ NH3
RCºCR' + [Ag(NH3)2]NO3 ® реакция не идет
Ацетилениды магния (реактив ) имеют важное
синтетическое значение. Их получают действием терминального алкина на магний
органические соединения с предельными радикалами:
RCºCH + CH3MgI
® CH4 + RCºC-MgI
карбоновая кислота
Подобные синтезы можно
осуществлять путем конденсации ацетилена или терминальных алкинов с альдегидами
и кетонами (Фаворский)
Механизм:
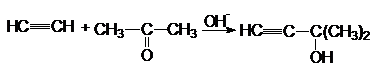
Конденсация ацетилена с альдегидами в
присутствии щелочей не дает желаемого результата из-за побочной реакции
альдольной конденсации. В.Реппе осуществил ее разработав новый катализатор на
основе ацетиленида меди, стабилизированного соединениями висмута:
СHºCH + CH2O ® CHºCH-CH2OH HO-CH2-CºC-CH2-OH
(бутиндиол-1,4)
Изомеризация
алкинов.
Алкины способны к
изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды.
Под действие щелочных металлов тройная связь переходит
на конец молекулы, полученного ацетиленида. Действие спиртовых щелочей
способствует переходу тройной связи с конца молекулы в центр. Промежуточными
продуктами в этих превращениях являются алленовые углеводороды (Фаворский)
CH3CH2CºCH CH3CºCCH3
Окисление
RCºCR' + KMnO4
RCOOH + R'COOH
RCºCH RCOOH + CO2
RCºCR' RCOOH + R'COOH
Окислительная конденсация терминальных алкинов.
2RCºCH RCºC-CºCR
Полимеризация
1)
Реакция
Зелинского:
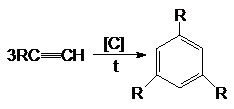
2)
Димеризация:
2HCºCH HCºC-CH=CH2
H2C=CH-CºC-CH=CH2
винилацетилен дивинилацетилен
Карбонилирование (Реппе)
CHºCH + CO + H2O
® CH2=CH-COOH
акриловая кислота
CHºCH + CO + ROH ® CH2=CH-COOR
эфир акриловой кислоты
CHºCH + CO + NH3
® CH2=CH-CONH2
амид акриловой кислоты
Катализаторами этих реакций являются карбонилы никеля
и кобальта.