Гетероциклические соединения. Пятичленные и
шестичленные ароматические гетероциклы с одним гетероатомом их получение и свойства.
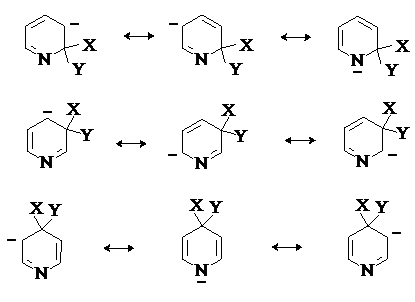
Гетероциклическими называют соединения, молекулы
которых содержат циклы, включающие наряду с атомами углерода один или несколько
гетероатомов. Гетероциклы –
самый многочисленный класс органических соединений, включающий около 2/3 всех
известных природных и синтетических органических веществ.
Классификация.
Гетероциклы классифицируют по следующим основным признакам:
-
по природе и числу
гетероатомов;
-
по размеру цикла;
-
по степени ненасыщенности.
Наибольшее распространение
имеют пяти- и шестичленные гетероциклы,
содержащие в качестве гетероатомов азот, кислород и серу.
По степени ненасыщенности различают насыщенные и ненасыщенные, в том
числе ароматические гетероциклы. Гетероциклы
неароматического характера по своим свойствам сходны с
соответствующими ациклическими соединениями (аминами, амидами, простыми и
сложными эфирами и т.д.). Ароматические гетероциклические соединения по
свойствам близки к бензолу. Для них, как и для бензоидных
систем, наиболее характерны реакции замещения. При этом гетероатом
выполняет роль «внутренней функции», определяющей
скорость и направление реакций замещения.
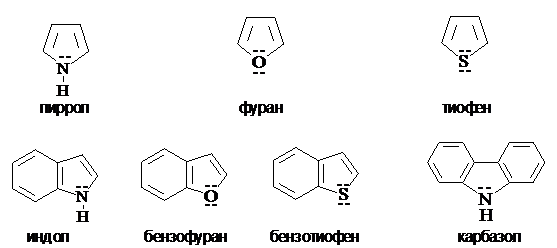
Систематическая номенклатура гетероциклов сложна. Для многих гетероциклических соединений сохраняются тривиальные названия. Ниже приведены некоторые группы ароматических гетероциклических соединений и их тривиальные названия.
Пятичленные ароматические
гетероциклы с одним гетероатомом
Пятичленные ароматические гетероциклы
с двумя гетероатомами

Шестичленные ароматические гетероциклы
с одним гетероатомом

Шестичленые ароматические гетероциклы с двумя гетероатомами
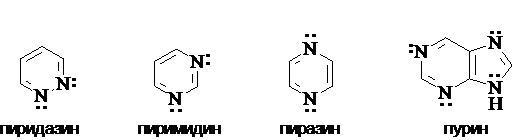
Далее будут рассмотрены
пяти- и шестичленные ароматические гетероциклы с
одним гетероатомом.
Пятичленные
ароматические гетероциклы с одним гетероатомом.
При составлении названий производных пиррола, фурана и
тиофена атомы цикла нумеруют, начиная с гетероатома.
Положение заместителя в кольце может быть указано также буквами греческого
алфавита.
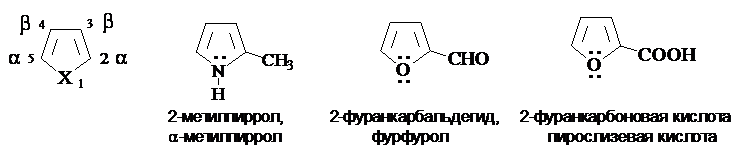
1)
Синтез из 1,4-дикарбонильных соединений по Паалю-Кнорру.

При нагревании 1,4—дикарбонильных
соединений с такими нуклеофильными реагентами, как аммиак или сульфиды,
образуются соответственно производные пиррола и тиофена. Нагревание 1,4—дикарбонильных соединений в присутствии кислотного
катализатора дает производные фурана.
2)
Синтез пирролов по Кнорру.
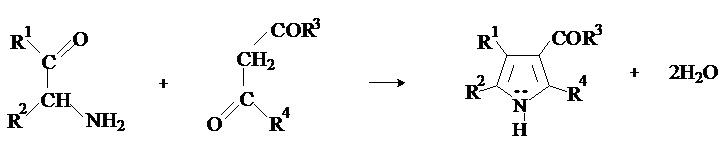
Метод состоит в конденсации a-аминокетонов с b-дикарбонильными соединениями в присутствии
кислотного или основного катализатора.
3)
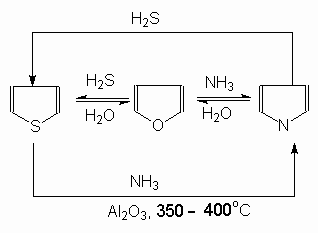
Взаимные превращения (реакция Юрьева).
При нагревании (~4000С) над катализатором Al2O3 происходят превращения фурана, пиррола и тиофена друг
в друга. Практическое значение имеют получение пиррола и тиофена из фурана.
Физические свойства и строение.
Пиррол, фуран и тиофен – бесцветные жидкости с
приятным запахом. Температура кипения пиррола (130-1310С)
значительно превышает температуры кипения фурана (320С) и тиофена
(840С), что обусловлено его ассоциацией за счет образования
водородных связей.
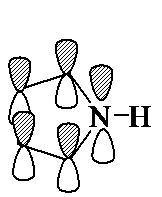
Пиррол, фуран и тиофен могут быть отнесены к
ароматическим соединениям, так как их молекулы содержат циклическую сопряженную
систему, включающую 6 p-электронов. Они являются электронными аналогами ароматического карбоцикла – циклопентадиенил-аниона
(см. лек. №16). В молекуле пиррола атом азота находится в состоянии sp2-гибридизации
и образует три s-связи,
лежащие в плоскости кольца. р-Орбиталь атома азота со
свободной парой электронов взаимодействует с четырьмя р-орбиталями атомов
углерода с образованием циклической p-системы, содержащей секстет p-электронов.
p-МО пиррола качественно похожи на орбитали
циклопентадиенил-аниона. Возмущение, вызванное
введением гетероатома, выражается в расщеплении уровней
p2 и p3, которые
в циклопентадиенил-анионе являются вырожденными
(имеют одинаковую энергию). Более низкую энергию имеет орбиталь
p2, которая имеет больший коэффициент на атоме азота.
Такое расщепление уровней является отражением частичной локализации неподеленной пары электронов на атоме азота. Ниже приведена
схема p-МО пиррола. Диаметр кружка пропорционален коэффициенту данной атомной орбитали в молекулярной орбитали,
а наличие или отсутствие штриховки соответствует знаку волновой функции.
Атом азота в пирроле действует как электронодонор
по мезомерному механизму, поэтому p-электронная плотность на атомах углерода пиррола повышена
по сравнению с бензолом. Такие гетероциклы называют p-избыточными
(на пять атомов приходится шесть p-электронов).
Гетероциклы фуран и тиофен имеют аналогичную p-систему, в которой одна из неподеленных
пар электронов кислорода и серы соответственно участвуют в образовании
ароматического секстета. Фуран и тиофен также относятся к p-избыточными гетероциклическим соединениям.
Подтверждением ароматического характера пиррола, фурана
и тиофена является их плоское строение и длины связей, которые имеют промежуточные
значения между обычными простыми и двойными связями С-С,
C-N, C-O и C-S. Эмпирические
оценки и квантово-механические расчеты показывают, что пятичленные гетероциклы стабилизированы за счет делокализации
p-электронов, однако
энергия делокализации у них ниже, чем у бензола. В наименьшей
степени стабилизирован фуран, который, таким образом, обладает меньшей
ароматичностью, чем пиррол и тиофен.
Молекулы пиррола, фурана и тиофена полярны.
У пиррола дипольный момент направлен от атома азота на цикл. У фурана и тиофена
отрицательный конец диполя, напротив, находится на гетероатоме.
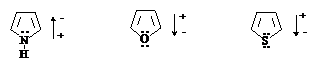
m=1,75D m=1,95D
Пиррол, фуран и тиофен являются электронодонорными
соединениями с энергиями ионизации соответственно 8,2; 8,9 и 9,0 эВ, что ниже,
чем у бензола (9,24 эВ).
1)
Основные
свойства
Пиррол является чрезвычайно слабым основанием. Протонирование по атому азота означает нарушение стабильной p-системы и потерю ароматичности. В действительности присоединение протона происходит по атомам углерода пиррольного кольца, преимущественно по a-положению. Образующаяся таким образом сопряженная кислота атакует молекулу пиррола, в результате чего происходит полимеризация.
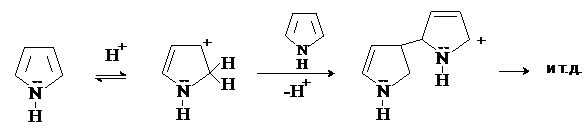
Фуран также полимеризуется
под действием кислот. Поэтому пиррол и фуран называют ацидофобными соединениями. Введение электроноакцепторных групп снижает ацидофобность. Например, фурфурол и пирослизевая кислота устойчивы к действию кислот.
Тиофен, в отличие от пиррола и фурана, неацидофобен.
2)
Кислотные
свойства пиррола
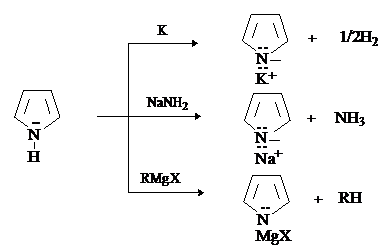
Пиррол является слабой NH-кислотой (рКа=17,5). По кислотности он превосходит
амины и близок к спиртам. Соли пиррола получают взаимодействием пиррола с
металлами, амидами металлов, металлоорганическим соединениями.
3)
Реакции электрофильного замещения
Пиррол, фуран и тиофен являются электронодонорными
соединениями и проявляют высокую реакционную способность по отношению к электрофилам. Реакционная способность в реакциях электрофильного замещения возрастает в ряду бензол<тиофен<фуран<пиррол.
Электрофильное замещение идет преимущественно в положение 2, что вытекает
из сравнения стабильности s-коплексов,
ведущих к продуктам 2- и 3-замещения.
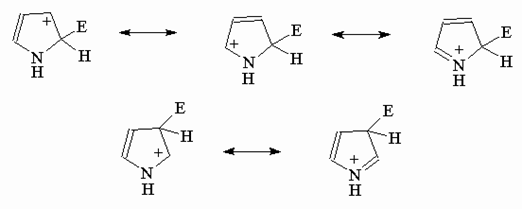
Как видно из приведенной
выше для пиррола схемы, в s-коплексе
(I) достигается более эффективная делокализации
положительного заряда (три резонансные структуры), чем в s-коплексе (II) (две резонансные структуры).
Взаимодействие гетероциклов
с электрофилами может привести и к образованию
продуктов присоединения (см. кислотные свойства).
Склонность к такого рода превращениям
убывает в ряду фуран>пиррол>тиофен,
что соответствует степени стабилизации их ароматических систем.
Пиррол по реакционной способности по отношению к электрофилам напоминает активированные ароматические
субстраты (фенол или ароматические амины). Из-за ацидифобности
пиррола при проведении реакций электрофильного замещения необходимо избегать сильно кислых сред. Основные SE-реакции пиррола суммированы на схеме.
Нитрование и сульфирование
пиррола возможны только в том случае, если исключена
сильнокислая среда. Нитрование проводят действием ацетилнитрата
при низких температурах. Для сульфирование используют
связанный в комплекс SO3, например, пиридинсульфотриоксид.
Галогенирование протекает без катализатора и дает тетрагалогенпирролы.
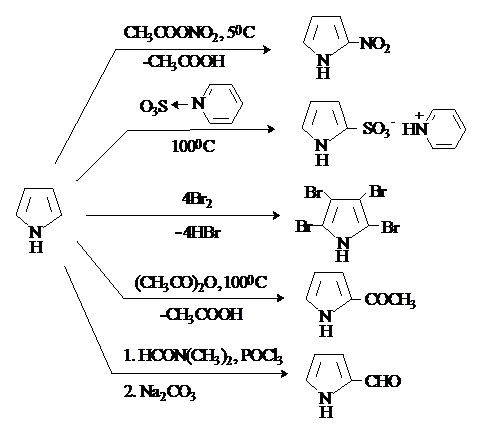
Пиррол ацилируется
ангидридами кислот в отсутствие катализатора. Как активированный субстрат
пиррол вступает в реакции формилирования. Наиболее общим
методом формилирования пирролов является реакция Вильсмейера-Хаака.
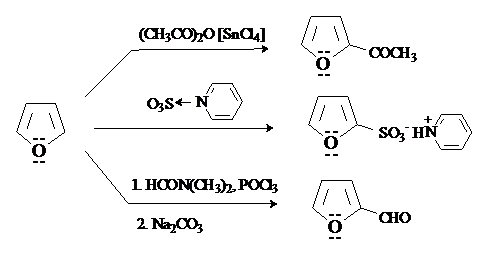
Фуран, как и пиррол, ацидофобен, поэтому реакции с электрофилами проводят в отсутствие сильных кислот. Фуран ацилируется ангидридами кислот в присутствии мягких кислот Льюиса, сульфируется пиридинсульфотриоксидом, формилируется по реакции Вильсмейера-Хаака. Фуран реагирует более селективно, чем пиррол. Во всех случаях образуются исключительно продукты замещения по положению 2.
Фуран в большей степени, чем пиррол, склонен к образованию с электрофилами продуктов не замещения, а присоединения. Даже реакции, результатом которых является замещение, могут происходить через промежуточное образование продуктов присоединения (по механизму присоединения-отщепления). При нитровании фурана ацетилнитратом можно выделить продукт 2,5-присоединения, который под действием пиридина (Py), подвергается элиминированию с образованием в конечном итоге продукта замещения.
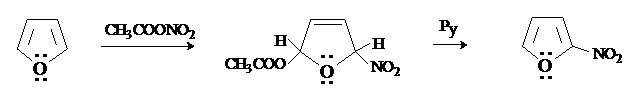
Тиофен, в
отличие от пиррола и фурана, неацидофобен, поэтому
реакции электрофильного замещения можно проводить с
обычными электрофильными агентами, в том числе с
использованием водных растворов минеральных кислот или в присутствии кислот
Льюиса. Реакции электрофильного замещения превалируют
над процессами присоединения.

4)
Реакции
присоединения
Гидрирование.
Пиррол, фуран и тиофен присоединяют водород в условиях каталитического гидрирования с образованием тетрагидропроизводных.
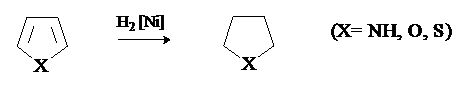
Труднее других гидрируется тиофен, который отравляет катализатор. Особенностью
химии тиофена является восстановительная десульфуризация,
которая используется в синтетических целях для получения соединений, трудно доступных другими методами.
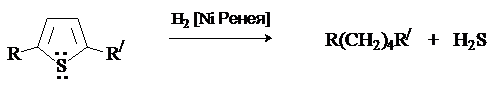
Реакция Дильса-Альдера
Реакции циклоприсоединения
характерны для фурана, который в большей степени, чем пиррол и тиофен,
проявляет свойства сопряженного диена. Например, он вступает при комнатной
температуре в реакцию диенового синтеза с таким активным диенофилом,
как малеиновый ангидрид.

Индол содержит конденсированные бензольный и пиррольный циклы (является бензологом пиррола). Ниже приведены нумерация циклов и примеры систематической и тривиальной номенклатуры производных индола.

Синтез
индолов по Фишеру.
Метод состоит в циклизации фенилгидразонов
в присутствии кислотного катализатора (H2SO4, ZnCl2).
Механизм реакции:
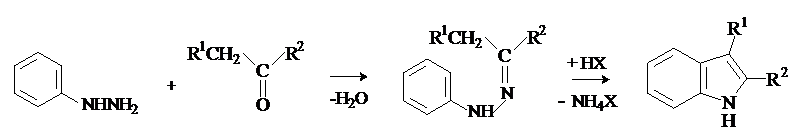
В присутствии кислот
происходит изомеризация гидразонов в гидразины с последующей
сигматропной перегруппировкой и замыканием пиррольного цикла. Ключевой стадией процесса является
разрыв слабой связи N-N и образование прочной связи С-С.
Это согласованный процесс, аналогичный перегруппировке Кляйзена
аллилфениловых эфиров.
Физические
свойства и строение.
Индол и его гомологи – бесцветные кристаллические
вещества с неприятным запахом.
Индол содержит плоскую циклическую сопряженную
систему, включающую 10 p-электронов, в том числе неподеленную пару
электронов атома азота. Таким образом, индол
может быть отнесен к ароматическим p-избыточным
гетероциклическим соединениям. Атом азота выступает как электронодонор,
повышая электронную плотность на атомах углерода.
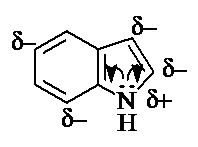
Индол является электронодонорным
соединением (ЭИ 7,8 эВ).
1)
Основные
свойства
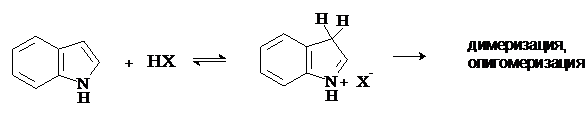
Индол является очень слабым основанием. Протонирование происходит по положению 3, далее протекает олигомеризация.
Таким образом, индол, как и пиррол, является ацидофобным соединением.
2)
Реакции электрофильного замещения
Все реакции электрофильного замещения в индоле идут по пиррольному кольцу. Существенным отличием от пиррола
является ориентация электрофильного замещения в
положение 3, что обусловлено более эффективной стабилизацией промежуточно образующегося катиона.
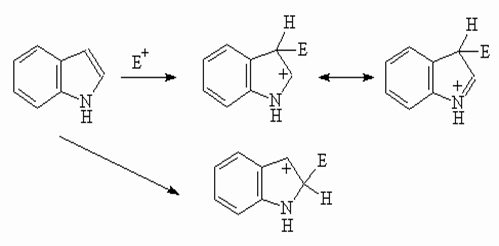
Катион (I), образующийся при атаке электрофилом
по положению 3, эффективно стабилизирован с участием атома азота, тогда как для
изомерного катиона (II) невозможна стабилизация без
нарушения ароматичности бензольного кольца.

Из-за ацидофобности
индола выбор условий электрофильного замещения требует
тех же самых предосторожностей, что и в случае пиррола.
3) Кислотные свойства
Индол представляет собой
слабую NH-кислоту (рКа=17) и образует соли при действии сильных оснований,
например:
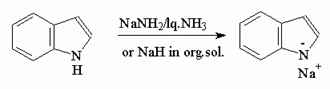
Шестичленные ароматические
гетероциклы с одним гетероатомом.
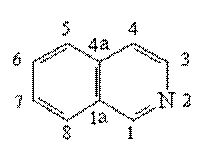
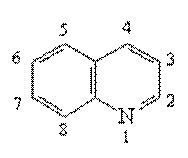
Пиридин,
хинолин, изохинолин.
Образуя названия производных пиридина и его бензологов, используют нумерацию цикла. В случае пиридина используют также буквы греческого алфавита. Некоторые производные имеют тривиальные названия.
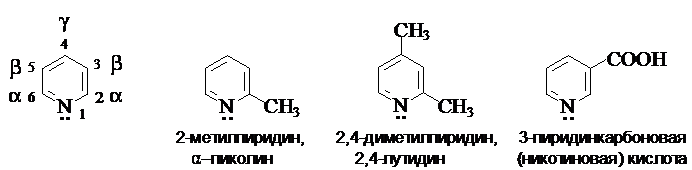
|
|
|
|
Хинолин |
изохинолин |

Синтез хинолина по Скраупу.
Метод состоит во взаимодействии первичных
ароматических аминов с глицерином в присутствии дегидратирующего
реагента и окислителя. Классический синтез Скраупа
может быть выражен следующей схемой.
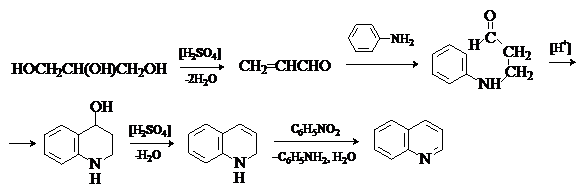
На первой стадии происходит катализируемая серной
кислотой дегидратация глицерина с образованием a,b-непредельного альдегида, акролеина. Второй стадия - сопряженное
присоединение анилина к акролеину. Третья стадия – замыкание цикла путем электрофильной атаки карбонильной группы по ароматическому
кольцу. На заключительных стадиях происходит дегидратация и окисление образующегося 1,2-дигидрохинолина в хинолин. В качестве
окислителя удобно использовать нитросоединение, соответствующее исходному амину. Для снижения экзотермичности реакции, которая протекает очень бурно, в
реакционную смесь добавляют FeSO4.
Синтез хинолина по Дебнеру-Миллеру.
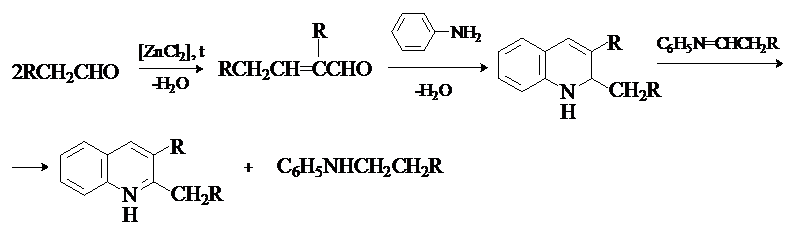
Этот метод, как и реакция Скраупа,
основан на взаимодействии ароматических аминов с a,b-непредельными карбонильными соединениями. Ненасыщенные карбонильные
соединения получают непосредственно в реакционной смеси из альдегидов и кетонов
путем кротоновой конденсации. Окислителями промежуточно образующихся
1,2-дигидрохинолинов являются альдимины, образующиеся
при взаимодействии исходных карбонильных соединения с ароматическим амином.
Физические свойства и строение.
Пиридин – бесцветная жидкость с неприятным запахом,
растворим в воде. Хинолин и изохинолин – бесцветные
жидкости, малорастворимы в воде.
Пиридин представляет собой ароматическую 6p-электронную систему, подобную ароматической системе бензола. Все
атомы цикла, в то числе и атом азота, находятся в состоянии sp2-гибридизации
и предоставляют р-орбитали
для образования замкнутой сопряженной -системы.
Неподеленная пара электронов атома азота лежит в
плоскости, перпендикулярной плоскости p-системы
кольца, и не принимает участия в создании ароматического секстета.

p-МО пиридина подобны орбиталям
бензола, но имеются следующие отличия. Во-первых, p-орбитали
пиридина имеют более низкую энергию, что обусловлено большей электроотрицательностью атома азота по сравнению с атомом
углерода. Во-вторых, высшие занятые молекулярные орбитали (ВЗМО) p2 и p3 у бензола
вырождены, а соответствующие орбитали пиридина имеют
разную энергию. Орбиталь p2 со значительным
коэффициентом на атоме азота ниже по энергии, чем орбиталь
p3 с нулевым коэффициентом на атоме азота.
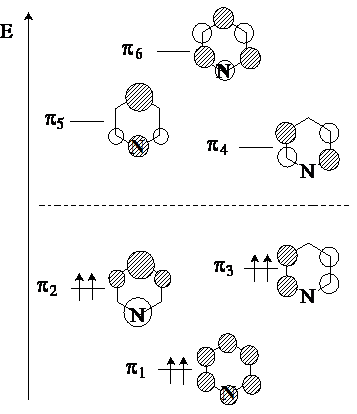
Атом азота действует как акцептор по индуктивному
механизму, что приводит к снижению электронной плотности на атомах углерода пиридиниевого кольца по сравнению с бензолом. Поэтому
пиридин относят к p-дефицитным гетероциклам.
Пиридин обладает значительной энергией делокализации, сравнимой с энергией делокализации
бензола. Это свидетельствует о высокой стабильности циклической системы
пиридина, в чем он превосходит пятичленные ароматические гетероциклы
– пиррол,фуран и тиофен.
Хинолин и изохинолин являются электронными аналогами нафталина. Они содержат
p-электронную систему из 10
p-электронов и могут быть
к отнесены к ароматическим гетероциклам. Присутствие
атома азота снижает электронную плотность главным образом на атомах углерода пиридиниевого цикла.
1)
Реакции по
атому азота.
Наличие у атома азота пиридина и его бензологов свободной пары электронов, не участвующей в
сопряженной системе, обусловливает их основные и нуклеофильные свойства.
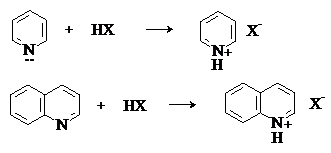
Пиридин и хинолин являются слабыми основаниями и с
сильными кислотами образуют соли пиридиния и хинолиния.
По основности пиридин и его бензологи уступают алифатическим и алициклическим аминам и близки к ароматическим аминам.
p![]() 11,25 5,23 5,14
4,94 4,58
11,25 5,23 5,14
4,94 4,58
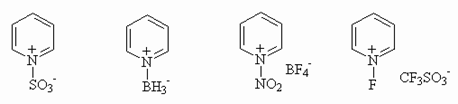
Для пиридина и его бензологов характерно образование комплексов с кислотами
Льюиса, которые в большинстве своем служат мягкими электрофильными
агентами, например:
|
|
|||
|
сульфирующий агент |
мягкий восстановитель |
мягкий нитрующий агент |
фторирующий агент |
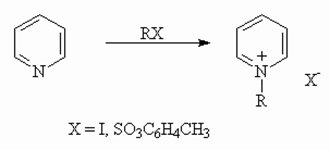
Нуклеофильность атома азота проявляется в его способности к алкилированию. При алкилировании
образуются устойчивые соли алкилпиридиния и алкилхинолиния:
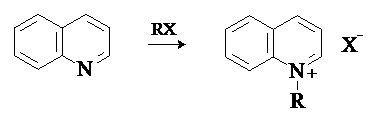
2) Реакции электрофильного
замещения.
Пиридин.
Реакции электрофильного
замещения в пиридине идут с большим
трудом, что обусловлено p-дефицитностью
ядра и способностью атома азота образовывать соли с протонными кислотами и
комплексы с кислотами Льюиса, что еще больше уменьшает нуклеофильность
ядра. По реакционной способности к электрофильному
замещению пиридин напоминает нитробензол. Замещение идет по положению 3, что
вытекает из рассмотрения резонансных структур s-комплексов,
ведущих к продуктам замещения в положения 2, 3 и 4.
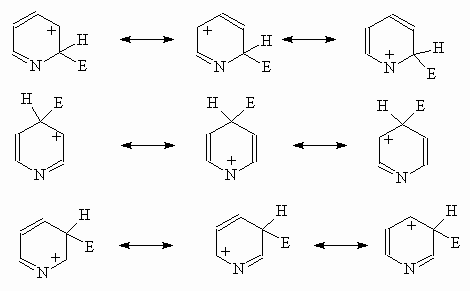
Несмотря на то, что в
резонансной стабилизации промежуточного катиона при электрофильной
атаке как при замещении по положению 3, так и по положениям 2 и 4, участвует
одинаковое число мезомерных структур, в последних
двух случаях катионы с положительным зарядом на иминном
атоме азота крайне невыгодны.

Пиридин нитруется, сульфируется и галогенируются
в очень жестких условиях. Только процессы галогенирования и сульфирования идут
с удовлетворительными выходами. Алкилирование и ацилирование в кольцо провести не удается.
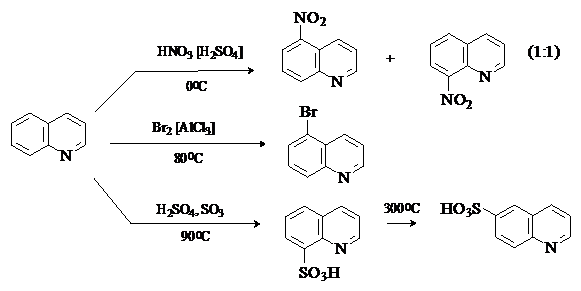
Хинолин.
Реакции электрофильного
замещения идут по наименее электронодефицитному бензольному кольцу преимущественно в положения 5 и 8. В условиях
термодинамического контроля, например, при сульфировании выше 3000С,
основным продуктом будет более стабильный 6-изомер.
3) Реакции нуклеофильного замещения.
Реакции нуклеофильного
замещения для пиридиниевого цикла наиболее характерны.
Пиридиниевый атом азота оказывает на ядро активирующее
действие, подобно нитрогруппе в бензольном кольце.
Нуклеофильное замещение протекает по механизму присоединения-отщепления (SNAr). Наиболее активированными являются положения 2 и 4.
При атаке нуклеофила по этим положениям образуются наиболее
стабильные анионные интермедиаты,
в которых атом азота участвует в делокализации
отрицательного заряда.
В хинолине к нуклеофильному
замещению также активированы положения 2 и 4.
Под действием таких сильных нуклеофилов, как амиды металлов и металлоорганические
соединения, в пиридине и хинолине возможно замещение гидрид-иона. Аминирование
пиридина и хинолина амидами металлов носит название реакции Чичибабина. Процесс проводят путем нагревания реагентов в
инертном растворителе. Механизм реакции – присоединение –отщепление.
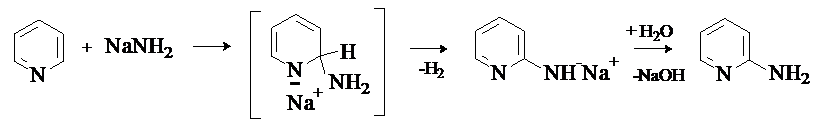
Аналогично реагирует хинолин
с образованием 2-аминохинолина.
При действии на пиридин и
хинолин фениллития водород в положении 2 замещается
на фенильную группу.
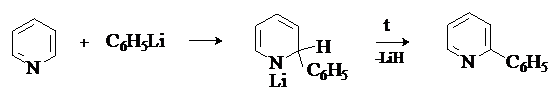
4) Восстановление
Каталитическое гидрирование пиридина дает пиперидин.
При гидрирование хинолина в первую очередь восстанавливается пиридиниевый цикл и образуется 1,2,3,4-тетрагидрохинолин.
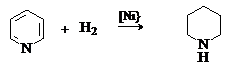
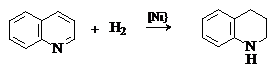
5) Окисление
Ядро пиридина устойчиво к действию окислителей. Алкилпиридины
могут быть окислены до пиридинкарбоновых килот. 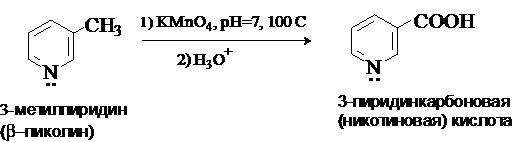
При окислении хинолина и изохинолина в первую очередь, как правило, разрушается бензольное кольцо.
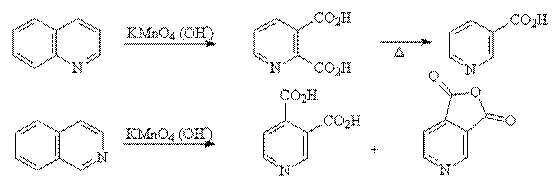
Окисление пиридина и хинолина пероксидом
водорода и надкислотами приводит к N-оксидам.

6) Реакции N-оксидов пиридина и хинолина
Образование N-оксида облегчает электрофильное замещение и меняет его ориентацию. Нитрование N-оксида пиридина идет в положение 4, так как образующийся при атаке электрофилом по этому положению интермедиат стабилизирован с участием атома кислорода. Если учесть возможность последующей дезоксигенации N-оксидов действием PCl3 или NO, то такой синтетический подход очень удобен для получения пиридинов, содержащих заместители в g-положении:
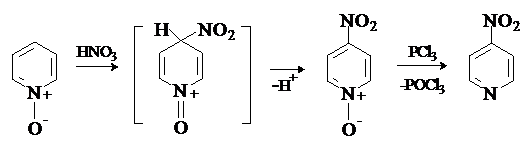
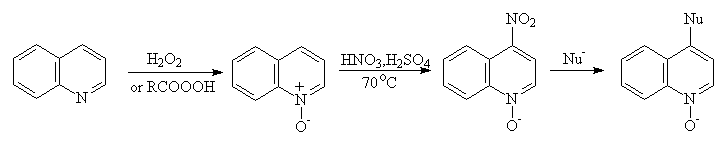
N-оксид хинолина также легко
нитруется в положение 4. N-Оксидная группировка способствует и нуклеофильному
замещению, что дает возможность легко замещать введенную таким образом
нитрогруппу на различные нуклеофилы:
7) Реакции метилпиридинов
Атом азота в пиридиниевом кольце оказывает влияние на подвижность a-водородных атомов в алкилпиридинах. Метилпиридины обладают большей СН-кислотностью, чем толуол. СН-кислотность атомов водорода метильных групп в 2- и 4-метилпиридинах сравнима с кислотностью метилкетонов. Повышенная протонная подвижность водорода метильных групп в 2- и 4- метилпиридинах может быть объяснена стабилизацией сопряженных оснований с участием атома азота, что следует из рассмотрения их резонансных структур.
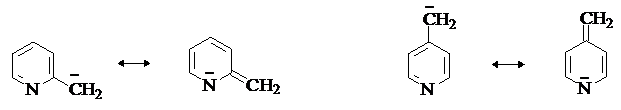
В этом отношении анионы метилпиридинов
пободны енолят-анионам. В
присутствии оснований 2- и 4- метилпиридины выступают
в реакции альдольно-кротоновой конденсации в роли
метиленовые компоненты.
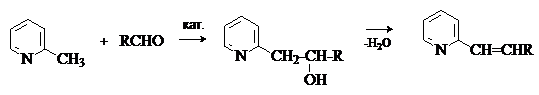
Аналогичными свойствами обладают 2- и 4- метилхинолины.