Белки и их основные признаки.
В результате работ Фишера стало ясно,
что белки представляют собой линейные полимеры a-аминокислот,
соединенных друг с другом амидной (пептидной) связью, а все многообразие
представителей этого класса соединений могло быть объяснено различиями аминокислотного
состава и порядка чередования разных аминокислот в цепи полимера.
Первые исследования белков проводились
со сложными белковыми смесями, например: с сывороткой крови, яичным белком,
экстрактами растительных и животных тканей. Позже были разработаны методы
выделения и очистки белков, такие как
осаждение, диализ, хроматография на целлюлозных и других гидрофильных
ионообменниках, гель-фильтрация, электрофорез. Более подробно рассмотрим эти
методы на лабораторной работе и семинарском занятии.
На современном этапе основными
направлениями изучения белков являются следующие:
¨ изучение
пространственной структуры индивидуальных белков;
¨ изучение
биологических функций разных белков;
¨ изучение
механизмов функционирования индивидуальных белков (на уровне отдельных атомов,
атомных групп молекулы белка).
Все эти этапы
взаимосвязаны, ведь одна из основных задач биохимии как раз и состоит в том,
чтобы понять, каким образом аминокислотные последовательности разных белков
дают им возможность выполнять различные функции.
Биологические
функции белков
Ферменты
-
это биологические катализаторы, самый многообразный, многочисленный класс
белков. Почти все химические реакции, в которых участвуют присутствующие в
клетке органические биомолекулы, катализируются
ферментами. Настоящему времени открыто более 2000 различных ферментов.
Транспортные
белки
- Транспортные белки плазмы крови связывают и переносят специфические молекулы
или ионы из одного органа в другой. Например, гемоглобин, содержащийся в
эритроцитах, при прохождении через легкие связывает кислород и доставляет его к
периферическим тканям, где кислород освобождается. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени
в другие органы. В клеточных мембранах присутствует еще один клеточный тип
транспортных белков, способных связывать определенные молекулы (напр., глюкозу)
и переносить их через мембрану внутрь клетки.
Пищевые
и запасные белки. Наиболее известными примерами таких белков
служат белки семян пшеницы, кукурузы, риса. К пищевым белкам относится яичный
альбумин - основной компонент яичного белка, казеин - главный белок
молока.
Сократительные
и двигательные белки. Актин
и миозин - белки, функционирующие в сократительной системе скелетной
мышцы, а также во многих немышечных тканях.
Структурные
белки.
Коллаген - главный компонент хрящей и сухожилий. Этот белок имеет очень
высокую прочность на разрыв. Связки содержат эластин - структурный
белок, способный растягиваться в двух измерениях. Волосы, ногти состоят почти
исключительно из прочного нерастворимого белка - кератина. Главным
компонентом шелковых нитей и паутины служит белок фиброин.
Защитные
белки.
Иммуноглобулины или антитела - это специализированные клетки,
вырабатываемые в лимфоцитах. Они обладают способностью распознавать проникшие в
организм бактерии вирусы или чужеродные молекулы, а затем запускать систему их
нейтрализации. Фибриноген и тромбин - белки, участвующие в
процессе свертывания крови, они предохраняют организм от потери крови при повреждении
сосудистой системы.
Регуляторные
белки.
Некоторые белки участвуют в регуляции клеточной активности. К ним относятся
многие гормоны, такие как инсулин (регулирует обмен глюкозы).
Аминокислотный
состав белков
Для определения аминокислотного состава
белки подвергают гидролизу.
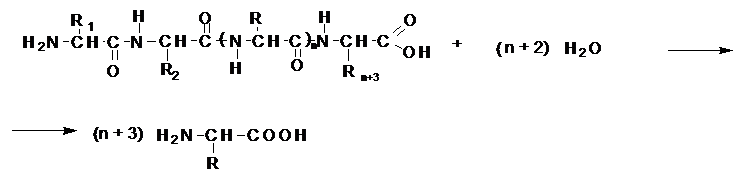
В состав белков
входят 20 L-a-аминокислот:
глицин, аланин, валин,
лейцин, серин, глутаминовая
кислота, глутамин, лизин, аргинин, пролин, аспарагиновая кислота, аспарагин, изолейцин, треонин, фенилаланин, тирозин,
цистеин, метионин, гистидин, триптофан и некоторые производные этих
аминокислот, образующиеся в белковой молекуле после матричного синтеза полипептидной
цепи.
Частота, с какой аминокислоты
встречаются в белках, неодинакова. Например, глицин обнаруживается в 10 раз
чаще, чем триптофан. По частоте нахождения аминокислот в белках можно составить
такой ряд: ала » вал » лей » сер > глу » глн » лиз » арг » про > асп » асн » изо » тре » фен > тир » цис » мет » гис.
Большинство белков по аминокислотному
составу отличаются не очень резко. Но некоторые белки с особыми свойствами
отличаются и аминокислотным составом. Так, белок соединительной ткани коллаген
на 1/3 построен из остатков глицина, около 1/5 на ост.
пролина и оксипролина. Именно
такой состав аминокислот позволяет готовой молекуле белка образовывать прочные олигомерные структуры - фибриллы. Фибриллы коллагена
превосходят по прочности стальную проволоку равного поперечного сечения. При
кипячении в воде нерастворимый коллаген превращается в желатину - растворимую
смесь полипептидов. Необычный аминокислотный состав коллагена определяет его
низкую питательную ценность. В состав связок и соединительной ткани стенок
сосуда входит белок - эластин. Эластин богат остатками лизина. Четыре боковые
группы лизина сближаются друг с другом и
ферментативным путем превращаются в десмозин.
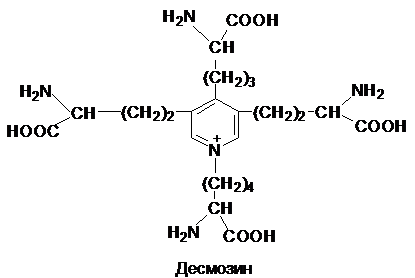
Таким путем полипептидные цепи эластина могут
объединяться в системы, способные обратимо растягиваться во всех направлениях.
В
хромосомах содержатся положительно заряженные белки гистоны, примерно на 1/3
построенные из остатков лизина и аргинина. Положительный заряд молекулы белка
позволяет образовывать прочные комплексы с отрицательно заряженными молекулами
нуклеиновых кислот.
Классификация
белков
по растворимости
Альбумины. Растворимы в воде и солевых растворах.
Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах.
Проламины. Растворимы в 70-80%
этаноле, нерастворимы в воде и абсолютном спирте. Богаты
аргинином.
Гистоны. Растворимы в солевых растворах.
Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание
глицина, аланина, пролина.
по форме молекул
Если исходить из отношения осей
(продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков отношение составляет
меньше 10 и в большинстве случаев не превышает 3-4. Они характеризуются
компактной упаковкой полипептидных цепей. Примеры глобулярных белков: многие
ферменты, инсулин, глобулин, белки плазмы крови, гемоглобин.
Фибриллярные
белки,
у которых отношение осей превышает 10, состоят из пучков полипептидных цепей,
спирально навитых друг на друга и связанных между собой поперечными
ковалентными или водородными связями (кератин, миозин, коллаген, фибрин).
Физические
свойства белков
На физических свойствах белков, таких
как ионизация, гидратация, растворимость основаны различные методы выделения и очистки
белков.
Так как белки содержат ионогенные, т.е. способные к ионизации аминокислотные
остатки (аргинин, лизин, глутаминовая кислота и
т.д.), следовательно, они представляют собой полиэлектролиты. При подкислении
степень ионизации анионных групп снижается, а катионных - повышается, при
подщелачивании наблюдается обратная закономерность. При определенном
рН число отрицательно
и положительно заряженных частиц становится одинаковым, такое состояние
называется изоэлектрическим
(суммарный заряд молекулы равен нулю). Значение рН,
при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают рI.
На различной ионизации белков при определенном значении рН
основан один из методов их разделения - метод электрофореза.
Полярные группы белков (ионогенные и неионогенные) способны взаимодействовать с
водой, гидратироваться. Количество воды, связанное с
белком достигает 30-50 г на 100 г белка. Гидрофильных групп больше на поверхности
белка. Растворимость зависит от количества гидрофильных групп в белке, от
размеров и формы молекул, от величины суммарного заряда. Совокупность всех этих
физических свойств белка позволяет использовать метод молекулярных сит или гель-фильтрацию
для разделения белков. Метод диализа
используется для очистки белков от низкомолекулярных примесей и основан на
больших размерах молекул белка.
Растворимость белков зависит и от
наличия других растворенных веществ, например, нейтральных солей. При высоких
концентрациях нейтральных солей белки выпадают в осадок, причем для осаждения (высаливания)
разных белков требуется разная концентрация соли. Это связано с тем, что
заряженные молекулы белка адсорбируют ионы противоположного заряда. В
результате частицы теряют свои заряды и электростатическое отталкивание, в
результате происходит осаждение белка. Методом высаливания
можно фракционировать белки.
Структурная
организация белковых молекул.
Белки - очень
крупные молекулы, молярная масса белков колеблется от 6ооо до 1 млн. грамм/моль
(см. таблицу).
Некоторые белки
в своем составе могут иметь химические группы небелковой природы. Такие белки
называют сложными или холопротеинами. Неаминокислотную
часть белков называют простетической
группой, белковую часть - апоферментом. Сложные белки
классифицируются по простетической группе. Например, липопротеины это белки, содержащие в своем составе группу -
липид; металлопротеины содержат в своем составе ионы
металла; в состав хромопротеинов входит хромофор, окрашенная группа небелковой
природы. Частный случай, когда
хромофором является гем. К таким белкам
относятся гемоглобин и цитохромы. Простетические
группы играют важную роль при функционировании сложного белка.
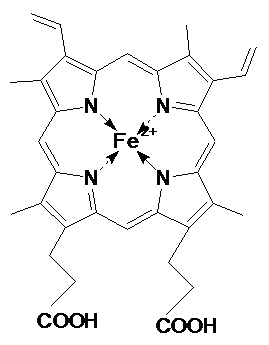
Простые белки
можно классифицировать по форме молекул и по способности растворяться в воде на глобулярные и фибриллярные. Глобулярные белки имеют
форму глобулы и, как правило, растворимы
в воде. Фибриллярные белки имеют
форму вытянутого волокна - фибриллы и нерастворимы в воде. Фибриллярные белки
выполняют главным образом опорные функции, обеспечивая прочность тканей;
глобулярные белки более разнообразны по функциям.
Первичной
структурой белка называют состав
и последовательность аминокислотных остатков в белковой молекуле. Аминокислоты
в белке связаны пептидными связями.
Все молекулы
данного индивидуального белка идентичны по аминокислотному составу,
последовательности аминокислотных остатков и длине полипептидной цепи.
Установление последовательности аминокислотной последовательности белков -
трудоемкая задача. Более подробно на эту тему мы поговорим на семинаре. Инсулин
был первым белком, для которого установили аминокислотную последовательность.
Бычий инсулин имеет молярную массу около 5700. Его молекула состоит из двух
полипептидных цепей: А-цепи, содержащей 21 а.к., и
В-цепи, содержащей 30 а.к., эти две цепи соединены
двумя дисульфидными ( -S-S-) связями. Даже
небольшие изменения первичной структуры могут значительно изменять свойства
белка. Болезнь серповидноклеточная анемия является
результатом изменения всего 1 аминокислоты в b-цепи гемоглобина
(Glu ® Val).
Видовая специфичность первичной структуры
При изучении
аминокислотных последовательностей гомологичных
белков, выделенных из разных видов, было сделано несколько важных выводов. К
гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые
функции. Примером может служить гемоглобин: у всех позвоночных он осуществляет
одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки
разных видов обычно имеют полипептидные цепи одинаковой или почти одинаковой
длины. В аминокислотных последовательностях гомологичных белков во многих
положениях всегда находятся одни и те же аминокислоты - их называют инвариантными остатками. Вместе с тем в
других положениях белков наблюдаются значительные различия: в этих положениях
аминокислоты варьируются от вида к виду; такие аминокислотные остатки
называются вариабельными. Всю
совокупность сходных черт в аминокислотных последовательностях гомологичных
белков объединяют в понятие гомология
последовательностей. Наличие
такой гомологии предполагает, что животные, из которых были выделены
гомологичные белки, имеют общее эволюционное происхождение. Интересным примером
является сложный белок - цитохром с - митохондриальный
белок, учавствующий в качестве переносчика электронов
в процессах биологического окисления. М » 12500, содержит
»100
а.к. Были установлены а.к.
последовательности для 60 видов. 27 а.к. - одинаковы,
это указывает на то, что все эти остатки играют важную роль в определении
биологической активности цитохрома с.
Второй важный вывод, сделанный на основе анализа аминокислотных последовательностей,
состоит в том, что число остатков, по которым различаются цитохромы
с любых двух видов, пропорционально филогенетическому различию между данными
видами. Например, молекулы цитохрома с лошади и
дрожжей различаются по 48 а.к., у утки и курицы - по 2 а.к.,
у курицы и индейки не различаются. Сведения с числе различий
в аминокислотных последовательностях гомологичных белков из разных видов
используют для построения эволюционных карт, отражающих последовательные этапы
возникновения и развития различных видов животных и растений в процессе
эволюции.
Пространственное
расположение полипептидных цепей (Конформация пептидных цепей в белках)
Термин конформация используют для описания пространственного
расположения в органической
молекулы замещающих групп, способных свободно изменять свое положение в
пространстве без разрыва каких бы то ни было связей.
Пептидная цепь
обладает значительной гибкостью. В результате внутри цепочечных взаимодействий
она приобретает определенную пространственную структуру (конформацию).
В белках различают два уровня пространственной организации для одной
полипептидной цепи: вторичную и третичную структуры белка. Для белков,
содержащих несколько полипептидных цепей, возможно, рассматривают
пространственную укладку этих цепей относительно друг друга - четвертичную
структуру белка.
Вторичная
структура белков – это укладка белковой молекулы в пространстве без учета
влияния боковых заместителей. Выделяют два типа вторичной структуры: a-спираль и b- структуру
(складчатый слой). Остановимся более подробно на рассмотрении каждого типа
вторичной структуры.
a-Спираль представляет из
себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. a-Спираль
стабилизируется внутримолекулярными водородными связями, возникающими между
атомами водорода одной пептидной связи и атомами кислорода четвертой по счету
пептидной связи.
![]()
Боковые
заместители расположены перпендикулярно плоскости a-спирали.
Т.о. свойства
данного белка определяются свойствами боковых групп аминокислотных остатков:
входящих в состав того или иного белка. Если боковые заместители гидрофобны, то и белок, имеющий структуру a-спираль гидрофобен. Примером такого белка является белок кератин,
из которого состоят волосы.
В результате
получается, что a- спираль пронизана водородными
связями и является очень устойчивой структурой. При образовании такой спирали
работают две тенденции:
¨ молекула стремится
к минимуму энергии, т.е. к образованию наибольшего числа водородных связей;
¨ из-за жесткости
пептидной связи сблизиться в пространстве могут лишь первая и четвертая пептидные
связи.
В складчатом слое пептидные цепи
располагаются параллельно друг другу, образуя фигуру, подобную листу,
сложенному гармошкой. Пептидных цепей, взаимодействующих между собой
водородными связями, может быть большое количество. Расположены цепи антипараллельно.
Чем больше
пептидных цепей входит в состав складчатого слоя, тем прочнее молекула белка.
Сравним свойства
белковых материалов шерсти и шелка и
объясним различие в свойствах этих материалов с точки зрения строения белков,
из которых они состоят.
Кератин - белок
шерсти - имеет вторичную структуру a-спираль. Шерстяная
нить не такая прочная, как шелковая, легко растягивается в мокром состоянии.
Это свойство объясняется тем, что при приложении нагрузки водородные связи
рвутся и спираль растягивается.
Фиброин - белок
шелка - имеет вторичную b-структуру.
Шелковая нить не вытягивается и является очень прочной на разрыв. Это свойство
объясняется тем, что в складчатом слое взаимодействуют между собой водородными
связями много пептидных цепей, что делает эту структуру очень прочной.
Аминокислоты
различаются по способности участвовать в образовании a-спиралей и b-структур. Редко
встречаются в a-спиралях глицин,
аспаргин, тирозин. Пролин
дестабилизирует a-спиральную
структуру. Объясните, почему? В состав b-структур входит
глицин, почти не встречаются пролин, глютаминовая кислота,
аспаргин, гистидин, лизин, серин.
В структуре
одного белка могут находиться участки b-структур, a-спиралей и
нерегулярные участки. На нерегулярных участках пептидная цепь может сравнительно
легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой
достаточно жесткие структуры. Содержание b-структур и a-спиралей в
разных белках неодинаково.
Третичная
структура белков определяется
взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков
трудно выделить общие закономерности в образовании третичных структур. Что
касается глобулярных белков, то такие закономерности существуют, и мы их
рассмотрим. Третичная структура глобулярных белков образуется путем
дополнительного складывания пептидной цепи, содержащей b-структуры, a-спирали и
нерегулярные участки, так , что гидрофильные боковые группы аминокислотных остатков
оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны
вглубь глобулы, иногда образуют гидрофобный карман.
Силы, стабилизирующие третичную структуру белка.
Электростатическое взаимодействие между разно
заряженными группами, крайний случай - ионные взаимодействия.
Водородные связи, возникающие между боковыми
группами полипептидной цепи.
Гидрофобные взаимодействия.
Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с
образованием цистина).
Образование дисульфидных связей приводит к тому, что
удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется
для химической завивки волос, которые почти полностью представляют собой белок
кератин, пронизанный дисульфидными связями.
Характер
пространственной укладки определяется аминокислотным составом и чередованием
аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый
белок имеет только одну пространственную структуру, соответствующую его первичной
структуре. Небольшие изменения конформации белковых
молекул происходят при взаимодействии с другими молекулами. Эти изменения порой
играют огромную роль при функционировании белковых молекул. Так, при
присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного
взаимодействия при присоединении остальных трех молекул кислорода. Такое
изменение конформации в лежит в основе теории индуцирующего соответствия при
объяснении групповой специфичности некоторых ферментов.
Кроме
ковалентной дисульфидной все остальные связи,
стабилизирующие третичную структуру, являются по своей природе слабыми и легко
разрушаются.
При разрыве большого числа связей, стабилизирующих пространственную структуру
белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется
биологическая активность белка. Такое изменение в пространственном строении
называется денатурацией.
Способность к
специфическим взаимодействиям как основа биологической активности белков
В основе
функционирования белка лежит его способность к взаимодействию с каким-либо
другим веществом - лигандом. Лигандом
может быть как низкомолекулярное вещество, так и макромолекула, в том числе и
другой белок. Лиганд присоединяется к определенному
участку глобулярной молекулы - активному
центру. Активный центр формируется в
ходе образования третичной структуры белка, поэтому при денатурации белка
(когда разрушается его третичная структура) белки теряют свою активность.
Специфичность взаимодействия белка и лиганда
объясняется комплиментарностью пространственной
структуры активного центра и молекулы лиганда. Взаимодействие между белком P и лигандом L описывается уравнениями:
P + L Û PL
Ксв определяет
сродство белка к данному лиганда,
чем больше Ксв, тем больше сродство.
На специфичности взаимодействия белков и лигандов основан методов разделения
белков - аффинная хроматография.
Ингибиторы
функций белков
Учитывая, что различные лиганды отличаются Ксв, всегда можно подобрать вещество, похожее по
структуре на природный лиганд, но имеющий большее
значение Ксв с данным белком. Например, СО
имеет Ксв в 100 раз больше, чем О2 с гемоглобином, поэтому достаточно 0,1% СО в
воздухе, чтобы заблокировать большое количество молекул гемоглобина. По такому
же принципу действуют многие лекарства. Например, дитилин.
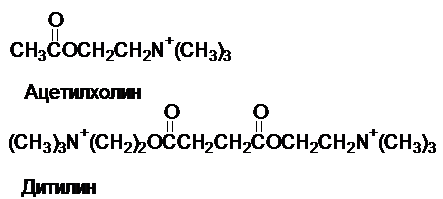
Ацетилхолин -
медиатор передачи нервных импульсов на мышцу. Дитилин
блокирует белок-рецептор, с которым связывается ацетилхолин и создает эффект парализации.
Связь
структуры белков с их функциями на примере гемоглобина и миоглобина
Четвертичная структура белка.
Под четвертичной
структурой белка подразумевают способ укладки в пространстве отдельных
полипептидных цепей, обладающих первичной, вторичной и третичной структурой и
формирование единого в структурном и функциональном отношении макромолекулярного
образования. Каждая отдельная полипептидная
(протомер или субъединица) не обладают
биологической активностью, а образовавшаяся молекула - олигомер обладает
биологической активностью. Четвертичная структура белка уникальна, как и другие
уровни организации. Четвертичная структура поддерживается нековалентными
взаимодействиями между контактными площадками протомеров.
Четвертичная
структура белков - еще один пример удивительной мудрости природы. Докажем это
на примере функционирования двух белков: миоглобина, обладающего только третичной
структурой и гемоглобина, обладающего четвертичной структурой. Гемоглобины
представляют собой тетрамерные белки, молекулы
которых образованы различными типами полипептидных цепей (a, b, g, d, S). В состав молекулы входит по две цепи двух разных
видов. Длина a- и b-цепей примерно
одинакова (a-
141 а.к., b- 146 а.к.). Наиболее распространенные гемоглобины имеют
следующую тетрамерную структуру: HbA (нормальный гемоглобин взрослого
человека) - a2b2,; HbF (фетальный гемоглобин) -a2g2; HbS (гемоглобин при серповидноклеточной
анемии) - a2S2; HbA2 (минорный гемоглобин человека) -
a2d2.
Четвертичная
структура наделяет гемоглобин дополнительными важными особенностями, которые
способствуют выполнению гемоглобином уникальной биологической функцией и
обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от греч.
- аллос - другой, стерос - пространство). На его примере можно лучше понять
свойства других аллостерических белков, поэтому
рассмотрим работу гемоглобина подробнее.
Миоглобин
способен запасать кислород, а гемоглобин обеспечивает его транспорт. Вторичная
и третичная структуры миоглобина и протомеров
гемоглобина очень сходны. Простетической группой этих
белков является гем. Гем расположен в гидрофобном кармане пептидной цепи каждого протомера, т.е. окружен неполярными остатками, за
исключением 2-х остатков гистидина, расположенных по обе стороны плоскости гема. С одним из них (проксимальным гистидином) Fe2+ связано координационно
по 5 координационному положению. Второй (дистальный) гистидин расположен почти
напротив проксимального, но несколько дальше, поэтому
6-ое координационное положение Fe2+ остается
свободным. В неоксигенированном
миоглобине или протомере гемоглобина атом железа
выступает из плоскости кольца в направлении проксимального гистидина на 0,03
нм. В оксигенированном миоглобине (протомере гемоглобина) кислород занимает 6-ое координационное
положение атома железа, при этом Fe2+ не меняет
степени окисления. Такого эффекта позволяет достичь
гидрофобное белковое окружение гема, которое не
позволяет кислороду слишком сблизиться с железом, чтобы его окислить. Железо, координируя О2,
выступает из плоскости кольца лишь на 0,01 нм. Т.о., оксигенирование
миоглобина сопровождается смещением атома железа и, следовательно,
проксимального гистидина и ковалентно связанных с ним
аминокислотных остатков в направлении плоскости кольца. В результате белковая
глобула меняет конформацию. Эти изменения приводят в
гемоглобине сопровождаются разрывом солевых связей между протомерами,
что облегчает связывание следующих молекул О2.
Тем самым проявляется эффект кооперативного связывания.
Кинетика оксигенирования
миоглобина и гемоглобина
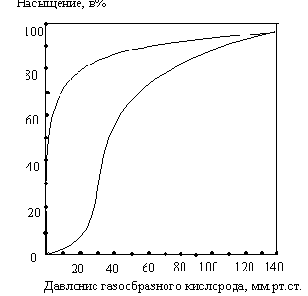
Почему миоглобин
не способен транспортировать кислород, но зато активно его запасает? Для
миоглобина изотерма адсорбции кислорода имеет форму гиперболы. Давление О2 в ткани, окружающей легочные капилляры,
составляет 100 мм рт.ст., поэтому миоглобин в легких
мог бы весьма эффективно насыщаться кислородом. В венозной крови Р О2 равно 40 мм рт.
ст., а в активно работающей мышце - 20 мм рт.ст. Но
даже при парциальном давлении 20 мм рт. ст. степень
насыщения миоглобина кислородом будет весьма значительна, и поэтому миоглобин
не может служить транспортной молекулой для доставки О2 от легких к периферическим
тканям. Однако при кислородном голодании, которым сопровождается тяжелая
физическая работа, парциальное давление О2
в тканях может понизиться и до 5 мм рт.ст.; при столь
низком давлении миоглобин легко отдает кислород, обеспечивая тем самым
окислительный синтез АТФ в митохондриях мышечных клеток.
Кинетика оксигенирования гемоглобина коренным образом отличается от
кинетики оксигенирования миоглобина. Кривая насыщения
гемоглобина О2 имеет сигмоидальную
форму. Т.о., способность гемоглобина связывать О2
зависит от того, содержатся ли в данном тетрамере
другие молекулы О2. Если да, то последующие молекулы О2 присоединяются легче. Для гемоглобина
характерна кинетика кооперативного связывания, благодаря которой он связывает
максимальное количество О2 в легких и отдает максимальное количество
О2 при тех значениях Р О2 , которые
имеют место в периферических тканях.
Сродство
гемоглобинов к О2 характеризуется величиной
Р50- значением парциального давления О2, при котором
наблюдается полунасыщение гемоглобина кислородом.
Например, для HbA Р50
= 26 мм рт.ст., а для HbF - 20 мм рт.
ст. Благодаря этой разнице гемоглобин F отбирает
кислород у HbA, находящегося в
плацентарной крови.
Транспорт двуокиси углерода
Гемоглобин не
только переносит кислород от легких к периферическим тканям, но и ускоряет
транспорт СО2 от тканей к легким. Гемоглобин
связывает СО2 сразу после освобождения
кислорода (»
15 % всего СО2). В эритроцитах происходит ферментативный процесс образования
угольной кислоты из СО2, поступающего из
тканей: СО2 + Н2О = Н2СО3.
Угольная кислота быстро диссоциирует
на НСО3- и Н+. Для предотвращения опасного
повышения кислотности должна существовать буферная система, способная поглощать
избыток протонов. Гемоглобин связывает два протона на каждые четыре
освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких
идет обратный процесс. Высвобождающиеся протоны связываются с бикарбонат- ионом с образованием угольной кислоты, которая под
действием фермента превращается в СО2 и воду, СО2
выдыхается. Т.о., связывание О2 тесно
сопряжено с выдыханием СО2. Это обратимое явление известно как эффект Бора. У миоглобина эффекта Бора
не обнаруживается.
Молекулярная основа эффекта Бора
Протоны,
ответственные за эффект Бора, высвобождаются в результате разрушения солевых
мостиков, которым сопровождается связывание О2, они отсоединяются от
остатков His (146) в b-цепях
гемоглобина. Наоборот, при высвобождении кислорода вновь формируется структура
с солевыми мостиками, при образовании которых происходит присоединение протонов
к остаткам His.
Регуляция 2,3-бисфосфоглицератом
Недостаток О2 в тканях приводит к накоплению
2,3-бисфосфоглицерата. Это соединение образуется из 1,3-бисфосфоглицерата, промежуточного
продукта гликолиза. Тетрамер гемоглобина связывает
одну молекулу ДФГ, которая размещается в центральной области, выстланной
остатками все 4-х субъединиц. Объем этой полости достаточен только в том
случае, когда разрушены солевые мостики между тетрамерами.
ДФГ стабилизирует неоксигенированную форму Hb. С фетальным гемоглобином ДФГ
связывается менее прочно, поэтому HbF обладает большим сродством к О2, чем гемоглобин взрослого человека.

При увеличении
концентрации ДФГ в эритроцитах (например, при снижении парциального давления
кислорода), снижается сродство О2 к
гемоглобину, этим и обуславливается регулирующее действие ДФГ.
Кооперативные
изменения конформации олигомерных
белков составляют основу механизма регуляции функциональной активности не
только Hb, но и большого
числа других белков, в том числе аллостерических
ферментов.
Изофункциональные белки
Белок,
выполняющий определенную функцию в клетке, может быть представлен несколькими
формами - изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются,
константой связывания, что приводит к некоторым различиям в функциональном
отношении. Например, в эритроцитах человека обнаружено несколько форм
гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все
гемоглобины представляют собой тетрамеры, построенные
из протомеров a, b, g, d (HbA -a2b2, HbF - a2g2, HbA2 - a2d2). Все протомеры
сходны между собой по первичной структуре, и очень большое сходство
наблюдается по вторичной и третичной
структурам. Все формы гемоглобинов предназначены для переноса кислорода в
клетки тканей, но HbF, например,
имеет большее сродство к кислороду, чем HbA. HbF характерен для
эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение
кислородом плода.
Изобелки - это результат
наличия более чем одного структурного гена в генофонде вида.
Ферменты
Ферменты - это
биокатализаторы, образующиеся в клетке, и представляющие собой простые или
сложные белки. Слово фермент
происходит от латинского - fermentum -закваска; другое название ферментов - энзимы - происходит от греческого- enzyme - в дрожжах. В 30-х годах XX века некоторые ферменты были выделены в
высокоочищенном кристаллическом состоянии. По химической природе кристаллы
оказались белковыми.
Ферменты - это
белки, и подобно всем белкам, они могут избирательно присоединять определенные
вещества - лиганды. Лиганд,
подвергающийся химическому превращению под действием фермента, называют субстратом (S),
продукты (P) реакции освобождаются в раствор.
Ферменты являются наиболее изученным классом белков. Это объясняется той важной
ролью, которую играют ферменты: любое химическое превращение в организме
происходит с их участием. К тому же, ферменты, в отличие от других белков, сравнительно
легко обнаруживать и измерять их
количество по катализируемой реакции.
Особенности
ферментов как биокатализаторов.
Ферменты как
катализаторы имеют ряд особенностей:
Высокоэффективные
катализаторы - ускоряют реакцию в 1010раз:
1 моль каталазы
при 00 С
обеспечивает разложение за 1 мин 5 млн. H2O2, в то время как 1 моль Pt катализирует
только 250- 2000 молекул H2O2.
Высокоспецифичны - катализируют,
как правило, реакцию одного типа
или воздействуют на один субстрат. Это
наиболее важное свойство ферментов.
Эффективно
работают в мягких условиях.
Синтез аммиака
по реакции: N2 + 3H2 = 2NH3 проводят при t = 500-5500C,
p = 107-108Па, ферменты,
содержащиеся в бобовых культурах обеспечивают протекание подобного процесса при
обычных условиях.
Ферменты - это
катализаторы, работу которых можно регулировать.
Классификации
ферментов и номенклатура.
Классификация ферментов по строению

по уровню организации белковых молекул
могут иметь
только третичную структуру (одну полипептидную цепь) и четвертичную структуру
(несколько полипептидных цепей). Последние - аллостерические
ферменты.
по типу катализируемой реакции и номенклатура ферментов
В номенклатуре
ферментов, введенной Международным биохимическим союзом (IUB) используется принцип классификации ферментов по
типу катализируемой реакции и ее механизму. Основные принципы номенклатуры
следующие:
Выделяют 6
классов ферментов, катализирующих 6 типов реакций:
Оксидоредуктазы.
Трансферазы.
Гидролазы.
Лиазы
Изомеразы.
Лигазы.
В каждом из 6 классов
имеется несколько подклассов (от 4 до 13).
Систематическое
название фермента состоит из 2-х частей: названия субстрата, типа
катализируемой реакции и части слова -аза.
Дополнительная
информация, если она необходима для уточнения, заключается в скобках.
Например:
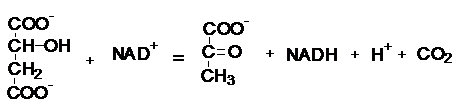
L-малат пируват
Фермент L-малат:NAD+оксидоредуктаза (декарбоксилаза)
Каждый фермент
обозначается специальным шифром, указывающим номер класса, подкласса, подподкласса и номер фермента в подподклассе.
Например: 2.6.1.2 - аланин:оксоглутарат-аминотрасфераза.
Помимо
систематического названия указывается рабочее
название фермента.
Принципы построения рабочего названия фермента
Оксидоредуктазы - ферменты,
катализирующие реакции окисления-восстановления.
Окисление может
осуществляться двумя путями:
а) Отщепление от
субстрата атомов водорода.
В этом случае
рабочее название там, где это, возможно, включает
термин дегидрогеназа.
Например:

Название
фермента включает название донора водорода и термин - дегидрогеназа:
лактатдегидрогеназа.
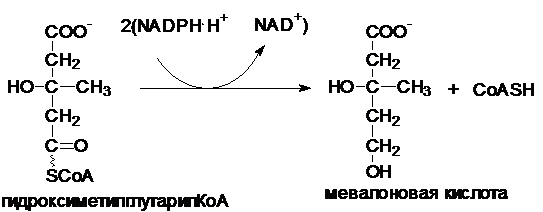
Альтернативой
этому может быть использование термина - редуктаза. Название редуктаз складывается из
названия акцептора атомов водорода и термина - редуктаза.Например:
Гидроксиметилглутарил-СоА-редуктаза
Термин оксидаза употребляется, когда акцептором
водорода является кислород. Например, цитохромоксидаза.
б) Включение в
молекулу субстрата кислорода.
Ферменты,
катализирующие данную реакцию, называются оксигеназами
(монооксигеназами или диоксигеназами,
в зависимости от количества атомов кислорода, включенных в молекулу субстрата).
Пример:
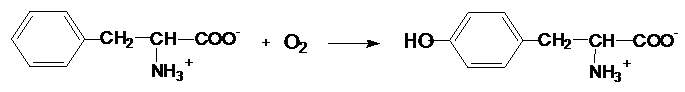
Фенилаланинмонооксигеназа
Трансферазы катализируют
реакции переноса различных групп от одного субстрата, который является донором,
к другому - акцептору. В зависимости от переносимых групп ферменты носят
названия метилтрансферазы, аминотрансферазы,
ацетилтрансферазы и т.д.
Рабочее название
трасфераз обычно строится по типу: акцептор - переносимая
группа - термин трансфераза.
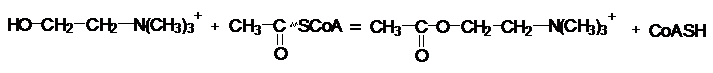
Холинацетилтрансфераза
Реже название
фермента складывается по типу: донор - переносимая группа - трансфераза. такой тип названия
характерен для аминотрансфераз.
Аланинаминотрансфераза (т.к.
2-оксоглутарат-универсальный сборщик аминогрупп).
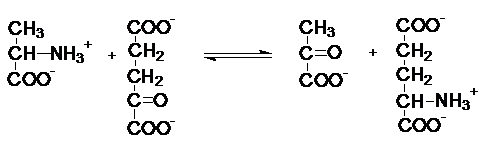
В ряде случаев
используются специальные термины, например: киназа переносит фосфатные группы от АТФ на какой-либо акцептор. Название
складывается из названия акцептора и термина
киназа.
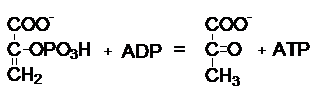
фосфоенолпируват
Фермент - пируваткиназа.
Гидролазы катализируют разрыв связей в молекуле за
счет присоединения молекул воды. Название складывается из названия субстрата + окончание
аза.
Фермент - аргиназа.
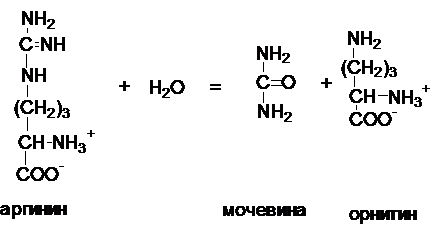
Некоторые
ферменты этого класса имеют название, в состав которого не входит окончание аза.
Например, ацетоацетилкофермент А
Фермент - ацетоацетилКоАгидролаза.
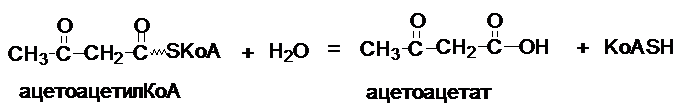
К гидролазам
относятся все пищевые ферменты, а также ферменты, входящие в состав лизосом - амилолитические, протеолитические, липолитические,
нуклеазы, фосфотазы.
Лиазы катализируют разрыв связи в молекуле или
отрыв фрагмента с образованием двойной связи. Для ферментов этого класса часто
употребляется термины декарбоксилаза, карбоксилаза, дегидратаза,
гидратаза, альдолаза.
Название строится из названия субстрата + соответствующий термин.
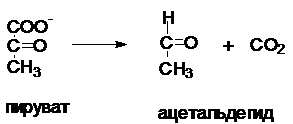
Фермент - пируватдекарбоксилаза.
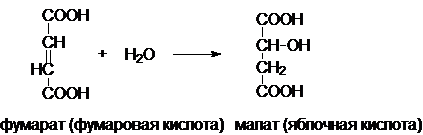
Фермент - фумаратгидратаза
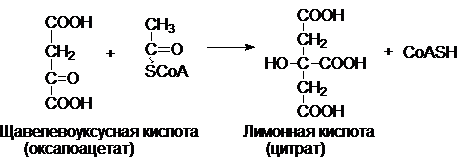
Фермент - цитратсинтаза.
Изомеразы катализируют превращения в пределах
одной молекулы, т.е. катализируют реакции внутримолекулярной перестройки. Название
ферментов зависит от типа реакции изомеризации.
Например:
D-аланин Û L-аланин (фермент - аланинрацемаза)
глюкозо-6-фосфат Û фруктозо-6-фосфат (фермент - глюкозофосфатизомераза).
Лигазы (синтетазы) катализируют
присоединение молекул друг к другу за счет энергии макроэргических
фосфодиэфирных связей молекулы АТФ. Название складывается следующим образом:
конечный продукт реакции + термин «синтетаза»

Фермент - глутаминсинтетаза.
В качестве
источников энергии могут выступать и другие нуклеотиды (ГТФ).
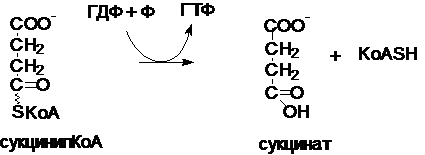
Фермент - СукцинилКоАсинтетаза.
В реакциях, где
одним из исходных соединений является СО2
используют термин карбоксилаза.
Название фермента: название субстрата + термин «карбоксилаза».

Фермент - пируваткарбоксилаза.
Механизм
действия ферментов.
Активный центр
ферментов.
Ферменты (с
точки зрения строения) – это глобулярные белки, которые имеют в глобуле полость
или щель определенных размеров – активный
центр фермента.
4.1.1 Общие
черты активного центра фермента:
а.ц.ф. – небольшая
часть белковой молекулы;
а.ц.ф. – имеет строго
определенную трехмерную структуру и размеры;
а.ц.ф. – формируется
из аминокислотных остатков, удаленных в первичной структуре, но сближенных в
третичной структуре;
а.ц.ф. – состоит из связывающего и каталитического участков.
Если белок сложный, то простетическая группа
входит в состав а.ц. фермента.
Вся белковая
молекула укладывается определенным образом в пространстве, образуя единственно
возможный (термодинамически
устойчивый) вариант третичной структуры данного белка, а
следовательно и уникальный активный центр данного фермента.
Механизм действия ферментов (на примере фермента холинэстеразы).
Субстрат данного фермента:
ацетилхолин – медиатор передачи нервного импульса.
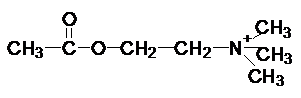
В ответ на выделение окончанием нервного волокна ацетилхолина, следует
ответная реакция возбуждения нервной клетки. Чтобы этот процесс протекал непрерывно,
после каждого акта передачи нервного импульса вызвавшая возбуждение порция
ацетилхолина должна быть гидролизована. Скорость гидролиза:
1-2 мкг (порция) за 0,1-0,2 мс.
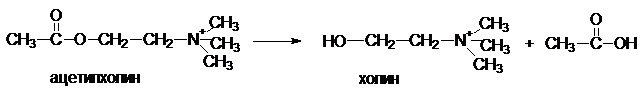
Активный центр фермента состоит из двух функционально важных и пространственно
разделенных участков:
связывающего, куда входит карбоксильная группа -COO- , электростатически взаимодействующая с заряженным азотом N+ субстрата;
каталитического, ответственного за
эстеразную активность фермента, в состав
которого входят остатки Ser, His,Tir.
В процессе реакции атом водорода гидроксильной группы Tir активного центра связывается с атомом кислорода
ацетилхолина (будущая спиртовая группа продукта реакции – холина). В результате
увеличивается положительный заряд на углеродном атоме ацетильной группы
субстрата, который атакуется отрицательно заряженным атомом кислорода серина. Отрицательный заряд на атоме кислорода серина возникает в результате образования водородной связи
между атомом Н серина и атомом N гистидина. Связь между С (ацетила) и О (холина) разрывается с
образованием в качестве промежуточного
соединения ацетилсерина. Отщепляющийся от серина протон связывается кислородным атомом тирозина, и
первоначальное состояние тирозина восстанавливается. Гидролиз ацетилсерина начинается с диссоциации молекулы воды за счет
взаимодействия протона с атомом N гистидина.
Освободившийся гидроксил атакует сложноэфирную связь ацетилсерина.
Результатом гидролиза является освобождение уксусной кислоты. Ион водорода (Н+),
временно связанный с гистидином, освобождается и связывается с кислородом серина. Образовавшиеся холин и уксусная кислота
освобождаются из активного центра за счет диффузии.
Все описанные выше процессы более или менее одновременно. Гидролиз ацетилхолина
происходит благодаря согласованному действию всех функциональных групп
активного центра.
Причины высокой каталитической
активности.
Фермент поддерживает микроокружение субстрата в
активном центре в состоянии отличном от его состояния в водной среде.
Располагает реагирующие атомы в правильной ориентации
и на необходимом расстоянии друг от друга, чтобы обеспечить оптимальное
протекание реакции.
За счет кооперативного взаимодействия субстрата и
нескольких остатков аминокислот в активном центре фермент снижает энергию активации
данной реакции.
Специфичность
ферментов
Субстратная
специфичность
Структура активного центра фермента комплементарна
структуре субстрата, т.е. соответствует ему по 1) форме, 2) размерам и 3) способности
взаимодействовать. Это является
причинами высокой специфичности ферментов.
Первоначально модель активного центра, предложенная Э.Фишером, трактовала взаимодействие
субстрата и фермента по аналогии с
системой «ключ-замок» – модель «жесткой матрицы». Однако эта модель объясняла
лишь абсолютную субстратную
специфичность. Фермент с абсолютной специфичностью катализирует превращение
какого-либо одного субстрата. Например, фумараза
катализирует только реакцию фумаровой кислоты с
водой:
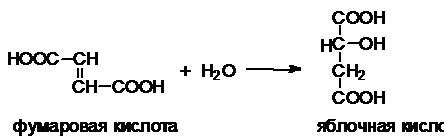
Кошланд
предложил модель индуцированного
соответствия. Главная черта этой модели – гибкость каталитического центра.
В модели Фишера каталитический центр считается заранее подготовленным под форму
молекулы-субстрата. В модели Кошланда субстрат индуцирует
конформационные изменения фермента, и лишь в
результате этих аминокислотные остатки и другие группы фермента принимают
пространственную ориентацию, необходимую для связи с субстратом и катализа. Эта
модель позволяет объяснить относительную
специфичность фермента.
Активный центр фермента имеет трехмерную структуру, поэтому ферменты
проявляют в большинстве случаев абсолютную
оптическую специфичность за исключением эпимераз
(рацемаз), которые катализируют взаимопревращение оптических
изомеров.
Кроме того, большинство субстратов образуют, как правило, не меньше
трех связей с ферментом. Благодаря такой «трехточечной
фиксации» симметричная молекула может проявлять асимметрию.
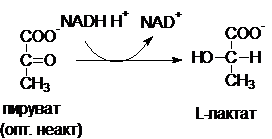
Химические изменения могут происходить только с группой 1, но не 2.
Специфичность
пути превращения
Каждый фермент катализирует не любые из
всех возможных путей превращения субстрата, а какое-либо одно. Это свойство
называется специфичностью пути
превращения. Например, у ферментов гистидазы и гистидиндекарбоксилазы один субстрат – гистидин, но катализируют
эти ферменты разные превращения гистидина.
Кинетика
ферментативных реакций
Зависимость скорости ферментативной реакции от концентрации субстрата.
Уравнение Михаэлиса-Ментен.
Любую ферментативную реакцию схематично можно описать следующим образом:
![]()
Поведение многих ферментов при изменении концентрации субстрата описывает уравнение Михаэлиса-Ментен:
![]() , где
, где
![]() - скорость
ферментативной реакции,
- скорость
ферментативной реакции,
![]() - максимальная скорость
ферментативной реакции при полном насыщении фермента субстратом,
- максимальная скорость
ферментативной реакции при полном насыщении фермента субстратом,
![]() – константа Михаэлиса,
– константа Михаэлиса,
![]() – концентрация
субстрата.
– концентрация
субстрата.
![]() - константа образования
фермент-субстратного комплекса ES,
- константа образования
фермент-субстратного комплекса ES,
![]() - константа диссоциации фермент-субстратного комплекса ES.
- константа диссоциации фермент-субстратного комплекса ES.
Влияние концентрации субстрата на скорость ферментативной реакции, описываемое
этим уравнением, можно изобразить графически:
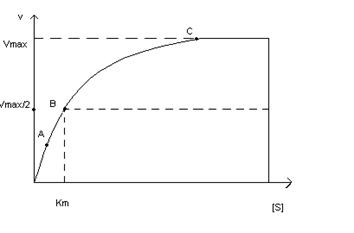
![]() равна концентрации субстрата при скорости ферментативной
реакции, равной половине максимальной скорости и характеризует сродство данного фермента к
тому или иному субстрату.
равна концентрации субстрата при скорости ферментативной
реакции, равной половине максимальной скорости и характеризует сродство данного фермента к
тому или иному субстрату.
Некоторые ферменты требуют высокой концентрации субстрата для
достижения скорости, равной максимальной, другие (например, гексокиназа)
достигают ![]() при очень низкой
концентрации субстрата.
при очень низкой
концентрации субстрата.
![]() - скорость реакции при 250С,
оптимальном значении рН, полном насыщении фермента
субстратом.
- скорость реакции при 250С,
оптимальном значении рН, полном насыщении фермента
субстратом.
![]() - число оборотов фермента, т.е. число молекул субстрата, которое превращает
одна молекула фермента за 1 минуту.
- число оборотов фермента, т.е. число молекул субстрата, которое превращает
одна молекула фермента за 1 минуту.
Линеризация уравнения Михаэлиса-Ментен.
Уравнение Михаэлиса-Ментен можно преобразить алгебраическим способом в
другие формы, более удобные для анализа экспериментальных данных:

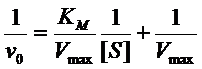
Зависимость скорости ферментативной реакции от температуры
В пределах физиологических условий зависимость скорости реакции от температуры
подчиняется законам химической кинетики, т.е. описывается уравнением Аррениуса.
Так при увеличении температуры тела с 360С до 390С
скорость биохимических процессов в организме увеличивается в 1,2 – 1,4 раза.
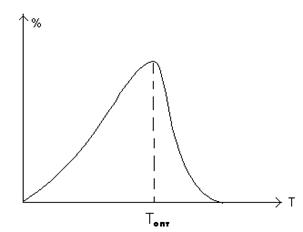
Выше определенной температуры начинается тепловая денатурация белковых
молекул, в том числе и ферментов, которые при этом теряют свою биологическую
активность.
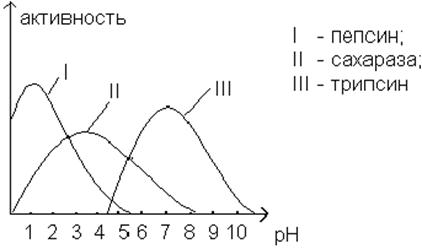
Зависимость скорости ферментативной реакции от рН.
Большинство ферментов характерным образом изменяют свою активность в зависимости
от рН. Оптимальной активности соответствует
определенная область рН, причем уменьшение и
увеличение рН приводит к снижению активности. Для
различных реакций значения оптимума рН колеблются в
широких пределах от сильно кислой среды (например, для пепсина) до сильно щелочной
(например, для щелочной фосфотазы). Поэтому
для работы с ферментами необходимо поддерживать рН с
помощью соответствующего буфера.
Зависимость ферментативной активности от рН
определяется значением рК ионогенных
групп белковой молекулы, особенно тех, которые находятся в активном центре
молекулы или вблизи него (и, возможно, играют роль в связывании кофермента), а
также групп, ответственных за изменение состояния активного центра путем конформационных изменений белковой молекулы. Кроме того, рН может влиять на степень ионизации или пространственную
организацию субстрата.
Влияние активаторов и ингибиторов на активность ферментов.
Активаторы - это молекулы или ионы, которые увеличивают
активность ферментов. Часто в качестве активаторов выступают ионы металлов (Mn2+, Mg2+, Zn2+, Co2+, K+) и хлорид-ион (Cl-). Механизм
активации ферментов под действием этих ионов может быть разным:
ионы являются коферментами и входят в состав активного
центра;
облегчают образование ES;
облегчают присоединение кофермента к апоферменту;
обеспечивают образование устойчивой четвертичной
структуры белков.
Ингибиторы - это молекулы или ионы, снижающие активность
ферментов.
Различают два больших класса ингибиторов ферментативной активности - на
основании того, ослабляется (конкурентное
ингибирование) или не ослабляется (неконкурентное
ингибирование) их ингибирующее действие при повышении концентрации
субстрата.
Другой способ классификации ингибиторов основывается на характере места
их связывания с ферментом в том же месте, что и субстрат (в активном центре), а
другие - на значительном расстоянии от активного центра.
Обратимое
конкурентное ингибирование аналогами субстрата.
Химическая структура ингибитора (I) сходна со структурой субстрата, поэтому связывание
ингибитора с ферментом происходит в активном центре фермента с образованием
комплекса E-I. Этот комплекс может диссоциировать.
Когда в реакционной смеси одновременно присутствуют и субстрат, и ингибитор, то
они конкурируют за один и тот же связывающий центр. При увеличении концентрации
субстрата происходит вытеснение ингибитора из активного центра фермента. Таким
образом, максимальная скорость ферментативной реакции в этом случае не
меняется, а константа Михаэлиса (Км)
уменьшается.
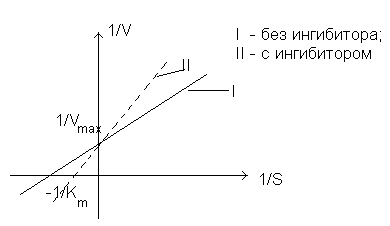
Примером такого ингибирования может быть ингибирование сукцинатдегидрогеназы малонатом.
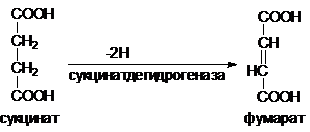
Малонат (HOOC-(CH2)2-COOH) способен связываться с дегидрогеназой,
образуя комплекс E-I, но отщепление атомов водорода от малоната
не происходит.
Многие лекарственные препараты, широко применяемые в клинике, действуют
как конкурентные ингибиторы очень важных ферментов.
Обратимое
неконкурентное ингибирование
В этом случае конкуренция между субстратом и ингибитором отсутствует.
При этом ингибитор ничем не напоминает субстрат и связывается не с активным центром
фермента. Обратимые неконкурентные ингибиторы понижают максимальную скорость,
но не влияют на KM.

Необратимое
ингибирование
Ферментативная активность может уменьшаться в присутствии многих
"ядов", таких как иодацетамид, диизопропилфторфосфат (нервно-паралитический яд), ионы тяжелых металлов (Ag+, Hg2+),
окисляющие агенты и т.д.
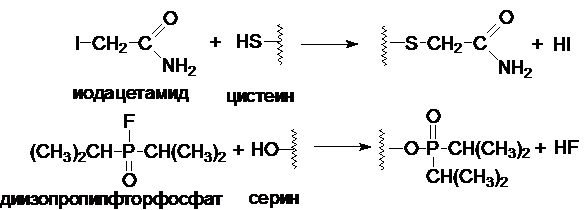
Многие инсектициды действуют по такому механизму.
Единицы ферментативной активности ферментов.
Ферменты обнаруживают по превращению их
субстратов, а количественно измеряют по величине каталитической активности, т.е. по скорости реакции, проходящей при
участии фермента. Для этого измеряют начальную скорость реакции, когда она
линейно зависит от концентрации фермента.
За единицу
активности (Е) фермента принимают такое его количество, которое
катализирует превращение 1 мкмоль субстрата за 1 мин
(международная единица активности фермента
- 1 катал = 1моль/1c).
Концентрацию
фермента
в растворе выражают в единицах на 1 мл (Е/мл) (международная единица - катал/л).
Часто бывает необходимо выражать
активность не в расчете на объем раствора, а в расчете на содержание белка. Удельная активность выражается в
единицах фермента на 1 мг белка (Е/мг) (международная единица -катал/г).
Для
сопоставления каталитической эффективности разных ферментов определяют молекулярную активность, которая
соответствует числу единиц в 1 мкмоль фермента (Е/мкмоль) или соответствует числу молекул субстрата,
превращаемых 1 молекулой фермента за 1 мин. Молекулярную активность можно
определить лишь в том случае, если известны молекулярная масса фермента и его молекулярная
концентрация в растворе.
Перед разработкой метода определения
активности любого фермента всегда изучается кинетика действия ферментов для
того, чтобы подобрать стандартные условия (насыщение концентрации субстрата,
оптимум температуры, ионный состав среды) для правильного определения
активности определенного фермента. Если эти условия не будут подобраны, то
активность фермента не будет соответствовать истинным величинам, что приведет к
ошибочному заключению при использовании методов определения ферментов в
диагностике заболеваний.
Регуляция
ферментативной активности.
Для нормального функционирования организма должна осуществляться точная
регуляция потока метаболитов по анаболическим и катаболическим
путям. Все биохимические процессы должны быть скоординированы и должны отвечать
на изменения во внешней среде (например, на поступление питательных веществ), а
также на периодически происходящие внутриклеточные события (например, репликацию
ДНК). Поток веществ, проходящий через ту или иную реакцию, можно регулировать,
изменяя следующие параметры: 1) абсолютное количество присутствующего фермента;
2) каталитическую эффективность фермента.
Регуляция количества фермента путем регуляции скорости его синтеза и
распада
Синтез и распад ферментов, как и других белков, происходит в организме
непрерывно. У взрослого здорового человека в условиях динамического равновесия
процессы синтеза и распада имеют одинаковую скорость, благодаря чему общее
содержание ферментов не изменяется во времени. Однако, для адаптации к изменениям
внешней среды или в ответ на внутриклеточные изменения, смещается равновесие
между процессами синтеза и распада ферментов. У всех живых организмов синтез
ферментов (из аминокислот) и распад (до аминокислот) представляют собой разные
процессы, которые катализируются разными ферментами. В этих условиях легко
осуществляется независимая регуляция скорости синтеза фермента и скорости его
распада.
Клетки могут синтезировать специфические ферменты в ответ на
присутствие специфических низкомолекулярных индукторов, т.е. веществ,
которые могут влиять на скорость синтеза фермента и оказывать существенное воздействие
на регуляцию обмена веществ путем соотношения ферментов в организме. Ферменты,
концентрация которых всегда постоянна и не зависит от условий, называются конститутивными.
Ферменты, концентрация которых может меняться, называются адаптивными.
В частности, известно, что введение некоторых лекарств
приводит к усилению синтеза ряда ферментов (эти лекарства действуют как
индукторы ферментов). Например, фенобарбитал приводит
к значительному (в 3-5 раз) увеличению содержания микросомального
фермента цитохрома Р-450, который играет центральную
роль в метаболизме самого фенобарбитала и многих
других лекарственных препаратов. Один из таких препаратов - варфарин,
препятствующий свертыванию крови. Если больной принимает варфарин,
а затем ему назначают фенобарбитал, то доза варфарина должна быть существенно увеличена, чтобы
компенсировать его разрушение под действием индуцированного цитохрома
Р-450.
Ферменты цикла мочевины, тирозинаминотрансфераза,
треониндегидраза - индуцируемые ферменты.
Репрессия
- это процесс, в результате
которого может быть приостановлен синтез фермента. Таким репрессором может быть
субстрат. У человека на уровень адаптивных ферментов в большей мере играют
эндокринные факторы (гормоны), чем промежуточные продукты обмена веществ. Так,
ферменты коры надпочечников стимулируют синтез ферментов, участвующих в
образовании глюкозы (гллюконеогенезе).
Превращение ферментов в активные формы
Ферментативная активность может регулироваться путем превращения неактивного профермента в активную форму. Чтобы перейти в такую форму, профермент должен подвергнуться ограниченному протеолизу, сопровождающемуся конформационными изменениями; при этом происходит либо открытие активного центра, либо его формирование.
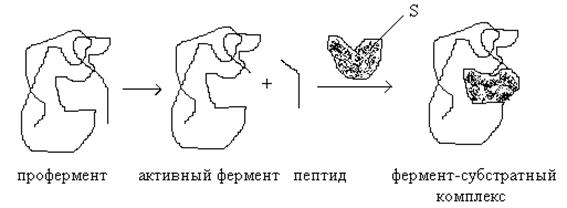
Синтез в форме проферментов характерен для пищеварительных ферментов, а
также ферментов системы свертывания крови и системы фибринолиза.
Регуляция активности ферментов путем их ковалентной модификации
Обратимое изменение каталитической активности ферментов может осуществляться
путем ковалентного присоединения фосфатной группы (преобладает у млекопитающих)
и ли нуклеотида (преобладает у бактерий). Ферменты, подверженные ковалентной
модификации, которая сопровождается изменением их активности, называют обратимо
модифицируемыми ферментами.
Обратимо модифицируемые ферменты могут находиться в двух состояниях, одно
из которых характеризуется высокой, а другое - низкой каталитической эффективностью.
В зависимости от конкретного случая более активным катализатором может быть
либо фосфо-,
либо дефосфофермент.
Фосфорилирование протекает соответственно по остаткам серина
и тирозина. Фосфорилирование и дефосфорилирование
катализируется протеинкиназами и протеинфосфотазами.
Активность протеинкиназ регулируется с помощью белковых
ингибиторов.
Регуляция белковыми ингибиторами.
Одним из важнейших примеров регуляции белковыми ингибиторами является
регуляция протеинкиназ - ферментов, фосфорилирующих белки. Протеинкиназа
в активной форме представляет собой белок, построенный из одной полипептидной
цепи (субъединица С). В клетке имеется белок (субъединица R), способный соединяться с белком С,
причем образуется тетрамерный комплекс R2C2. Этот комплекс не обладает ферментативной активностью.
Активация происходит при участии цАМФ, который связывается с субъединицей R. После связывания изменяется конформация
белка, и сродство субъединицы R к субъединице С уменьшается - происходит диссоциация комплекса:
R2C2 + 2цАМФ Û R2цАМФ2 + 2С
Повышение концентрации цАМФ в клетке ведет к
активации протеинкиназ.
Аллостерическая регуляция.
Последовательность реакций синтеза сложного природного соединения из простых
называется анаболическим путем, а последовательность реакций его распада -
катаболическим путем. Катаболические
и анаболические пути одного итого же вещества не совпадают полностью. Как
правило, биохимические реакции, различающиеся в катаболическом
и анаболическом путях, катализируются ключевыми аллостерическими ферментами, которые называют также регуляторными.
Благодаря существованию таких ферментов возможно независимое регулирование
процессов синтеза и распада.
Аллостерические ферменты помимо активного центра имеют еще специфический регуляторный
центр (аллостерический центр), с которым могут специфически
связываться некоторые соединения, способные активировать или ингибировать
ферменты (аллостерические модификаторы или эффекторы).
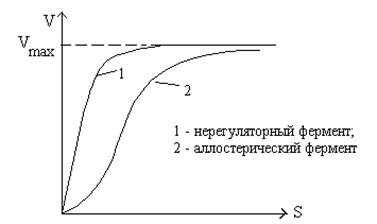
Аллостерические ферменты, как правило, состоят из 2-х или более субъединиц. Одна субъединица имеет активный (каталитический) центр, а другая - регуляторный. На рисунке представлена схема аллостерического ингибирования фермента:
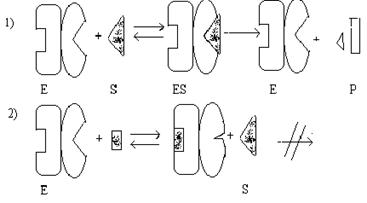
В отсутствии аллостерического ингибитора
субстрат присоединяется к активному
центру и происходит реакция. Если в среде есть аллостерический
ингибитор, то он присоединяется к регуляторному центру, что ведет к изменению конформации регуляторной субъединицы, а затем -
каталитической субъединицы. В результате активность фермента снижается.
Кинетика аллостерических ферментов не подчиняется
уравнению Михаэлиса-Ментен. Зависимость скорости
реакции от концентрации субстрата носит сигмоидальный
(S-образный) характер.
Ингибирование по принципу обратной связи
Ингибирование фермента, катализирующего одну из реакций в цепи,
конечным продуктом этой цепи называют ингибированием
по принципу обратной связи. В цепи реакций биосинтеза D из A, катализируемой ферментами Е1, Е2,
Е3, при высоких концентрациях D обычно наблюдается ингибирование превращения А в В. D действует как отрицательный аллостерический
эффектор фермента, или ингибитор, действующий по принципу обратной связи.

В кинетическом плане ингибирование по принципу обратной связи может
быть конкурентным, неконкурентным.
Очень часто ингибитор, действующий по принципу обратной связи, является
последней малой молекулой перед синтезом макромолекулы (например, нуклеотид в
синтезе нуклеиновых кислот). Регуляция по принципу обратной связи происходит на
первой функционально необратимой стадии, уникальной для данной цепи реакций
биосинтеза.
Такое ингибирование позволяет экономить метаболиты и энергию, прекращая
синтез продукта уже на первых стадиях.
Примером ингибирования по принципу обратной связи может быть регуляция
синтеза УТФ (уридинтрифосфата).
Метаболический путь синтеза УТФ включает
8 реакций. Первая катализируется реакцией карбамоилфосфатсинтетазой
II. Это аллостерический
фермент: конечный продукт метаболического пути - УТФ - является его аллостерическим ингибитором.
Распределение ферментов в организме.
Многие ферменты обнаруживаются почти во
всех клетках организма. Это ферменты, которые участвуют в процессах
жизнеобеспечения самой клетки (синтез нуклеиновых кислот, белков,
энергетический обмен и т.д.). С другой стороны, дифференцированные клетки,
выполняющие специфические функции, отличаются по ферментному составу. Например,
клетки печени содержат набор ферментов, необходимых для синтеза мочевины,
клетки коры надпочечников содержат ферменты, синтезирующие стероидные
гормоны. Некоторые ферменты обнаруживаются только в одном или двух органах.
Такие ферменты называются органоспецифическими ферментами.
Например, кислая фосфотаза есть преимущественно в предстательной железе.
Внутри клеток ферменты также
распределены неравномерно. Разные органеллы имеют специфический набор
ферментов, а, следовательно, различаются по метаболизму, т.е. наблюдается компартментализация метаболизма.
Изоферменты
Физически различимые формы ферментов,
катализирующие одну и ту же реакцию с одним и тем же субстратом, называются изоферментами.
Изоферменты отличаются по первичной структуре, но не слишком сильно, поэтому,
проявляя одинаковую биологическую активность, они могут различаться по ряду
свойств, например, по молекулярной активности, по способам регуляции, по
стабильности. Различные формы изоферментов могут присутствовать в разных тканях
организма. При заболеваниях какого-либо
органа происходит попадание специфических изоферментов в сыворотку крови.
Определение содержания изоферментов в сыворотке помогает поставить правильный
диагноз.
Приведем в качестве примера изоферменты гексокиназу и глюкокиназу. Обе
эти киназы катализируют превращение глюкозы в глюкозо-6-фосфат,
но различаются значением константы Михаэлиса (КМ
= 0,05 ммоль/л и 10 ммоль/л
соответственно) и локализацией в организме: глюкокиназа
- фермент печени, гексокиназа присутствует в печени,
мышцах и многих других тканях. Кроме того, продукт реакции глюкозо-6-фосфат
ингибирует гексокиназу, но не влияет на активность глюкокиназы.
Если фермент имеет олигомерную
структуру и построен из различных протомеров, то
изоферменты могут получаться в результате различных комбинаций протомеров.
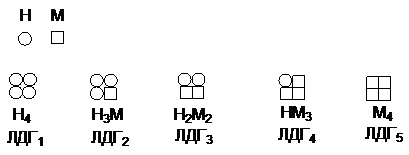
Например, фермент лактатдегидрогеназа - тетрамер,
состоящий из протомеров 2-х типов Н (сердечный) и М
(мышечный):
Лактатдегидрогеназа - фермент,
который катализирует обратимую реакцию:
![]()
Изомерные формы ЛДГ1
и ЛДГ2 обнаруживаются в
мозге, сердце, корковом веществе почек, т.е. в тканях с интенсивным снабжением
кислородом. Форма ЛДГ3 - в поджелудочной железе, ЛДГ4 и ЛДГ5 в скелетных
мышцах, печени, мозговом веществе почек, т.е. в тканях с менее интенсивным
снабжением кислородом. Все эти формы ферментов значительно различаются
максимальной скоростью реакции и константами Михаэлиса
для лактата и пирувата. ЛДГ5
быстро катализирует восстановление пирувата в лактат при низких концентрациях лактата.
ЛДГ1 катализирует быстрое окисление лактата в пируват в сердечной
мышце.
Определение содержания ЛДГ1 и ЛДГ2 в сыворотке крови служит
тестом при постановке диагноза - инфаркта-миокарда.