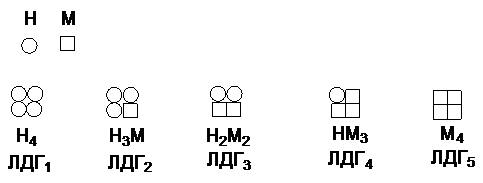ОБМЕН И ФУНКЦИИ
УГЛЕВОДОВ
Глюкоза как важнейший метаболит углеводного обмена.
В организме человека имеется несколько
десятков различных моносахаридов и очень много (тысячи) разных олиго- и
полисахаридов. Функции углеводов в организме заключаются в следующем.
Углеводы служат
источником энергии: за счет их окисления удовлетворяется примерно половина всей
потребности человека в энергии. В энергетическом обмене главная роль
принадлежит глюкозе и гликогену.
Углеводы входят
в состав структурно-функциональных компонентов клеток. К ним относятся пентозы
нуклеотидов и нуклеиновых кислот, углеводы гликолипидов и гликопротеинов,
гетерополисахариды межклеточного вещества.
Из углеводов в
организме могут синтезироваться соединения других классов, в частности липиды и
некоторые аминокислоты.
Таким образом, углеводы выполняют
разнообразные функции, но главная функция углеводов - энергетическая.

Наиболее распространенный углевод
животных - глюкоза. Именно в форме глюкозы поступает в кровь основная масса
углеводов пищи. В глюкозу превращаются углеводы в печени и из глюкозы могут
образовываться все остальные углеводы. Глюкоза используется как основной вид
топлива в тканях млекопитающих. Таким образом, она играет роль связующего между
энергетическими и пластическими функциями углеводов. Источником углеводов
организма служат углеводы пищи - главным образом крахмал, а также сахароза и
лактоза. Кроме того, глюкоза может образовываться в организме из аминокислот, а
также из глицерина, входящего в состав жира.
Переваривание углеводов.
Углеводы пищи в пищеварительном тракте
распадаются на мономеры при действии гликозидаз
- ферментов, катализирующих гидролиз гликозидных связей.
Переваривание крахмала начинается уже в
ротовой полости благодаря действию фермента амилазы
(a-1,4-гликозидазы),
выделяемого слюнными железами. Слюна имеет слабо кислую среду (рН 6,8). Амилаза
слюны гидролизует многие из a(1®4)-гликозидных
связей в крахмале и гликогене. При этом образуется смесь, состоящая из
мальтозы, глюкозы и олигосахаридов. Действие амилазы ограничено полостью рта и
пищевода. Переваривание крахмала, гликогена и других усвояемых полисахаридов
продолжается и завершается в тонком кишечнике главным образом под действием
фермента амилазы поджелудочной железы,
которая поступает в составе сока поджелудочной железы в верхний отдел тонкого
кишечника с наиболее высокой пищеварительной активностью - двенадцатиперстную
кишку. Амилаза не гидролизует гликозидную связь в дисахаридах, поэтому основным
продуктом действия этого фермента являются дисахариды мальтоза (4-a-D-глюкоприранозил-D-глюкопираноза)
и изомальтоза (6-a-D-глюкоприранозил-D-глюкопираноза).
Мальтоза, изомальтоза, сахароза, лактоза
гидролизуются специфическими гликозидазами - мальтазой, изомальтазой, сахаразой и лактазой. Эти ферменты
синтезируются в клетках кишечника и не выделяются в просвет кишечника. Они
локализованы в наружном крае эпителиальных клеток, выстилающих тонкий кишечник.
Продукты полного переваривания углеводов - глюкоза, галактоза, фруктоза -
через клетки кишечника поступают в кровь. При всасывании из кишечника в кровь
моносахариды проникают через клеточные мембраны путем облегченной диффузии, с
участием специальных переносчиков. Для переноса глюкозы и галактозы существует
еще один способ переноса через мембрану: активный транспорт по механизму
симтпорта за счет градиента концентраций ионов натрия, который создается Na, K-АТФазой. Этот механизм обеспечивает перенос
моносахаридов против градиента концентраций, и поэтому может функционировать
тогда, когда концентрация их в кишечнике невелика.
Транспорт
углеводов в клетки.
Поступающие из просвета кишечника
моносахариды с кровью воротной вены попадают в печень. Здесь часть глюкозы
задерживается, часть через общий кровоток попадает в клетки других тканей и
органов.
Транспорт глюкозы из крови в клетки
зависит от гормона поджелудочной железы - инсулина. При пищеварении
концентрация глюкозы в крови повышается (алиментарная,
или абсорбтивная, гипереглюкоземия) и
это стимулирует секрецию гормона в кровь. Инсулин увеличивает проницаемость
мембраны клеток для глюкозы, в результате чего ускоряется перенос глюкозы из
крови в клетки. Поступление глюкозы в клетки зависит от инсулина практически во
всех органах. Важными исключениями являются мозг и печень: скорость поступления
глюкозы в эти клетки определяется концентрацией глюкозы в крови.
Аэробный гликолиз.
В клетках глюкоза может превращаться в
жирные кислоты, аминокислоты, гликоген и окисляться в различных катаболических
путях.
Окисление глюкозы называют гликолизом. Глюкоза может окисляться до
лактата и до пирувата. В аэробных условиях главным продуктом является пируват,
такой путь называется аэробным гликолизом.
При недостатке кислорода преобладает продукт - лактат. Этот путь окисления
называется анаэробным гликолизом.
Процесс аэробного распада глюкозы можно
разделить на три части: специфические для
глюкоза превращения, завершающиеся образованием пирувата (аэробный гликолиз);
общий путь катаболизма (окислительное декарбоксилирование и ЦЛК); дыхательная
цепь.
В результате этих процессов глюкоза
распадается до CO2 и H2O, а освобождающаяся
энергия используется для синтеза АТФ.
Ферментативные
реакции.
Распад глюкозы до пирувата также можно
разделить на два этапа. Первый этап (глюкоза ®
глицеральдегидфосфат) требует энергии в форме АТФ (2 АТФ).
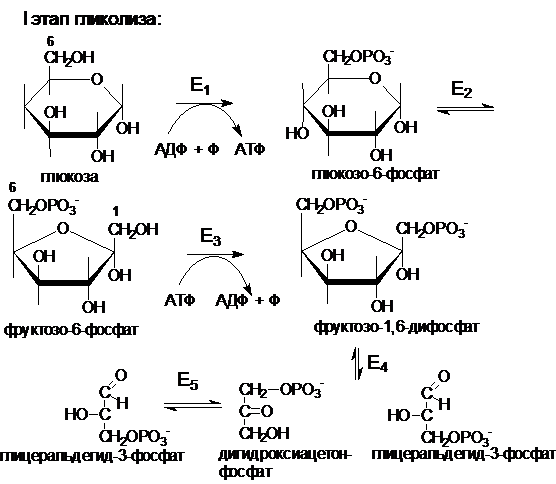
Е1 - гексокиназа
или глюкокиназа
Е2 - глюкозофосфатизомераза
Е3 - фосфофруктокиназа
Е4 - фруктозодифосфатальдолаза
Е5 - триозфосфатизомераза
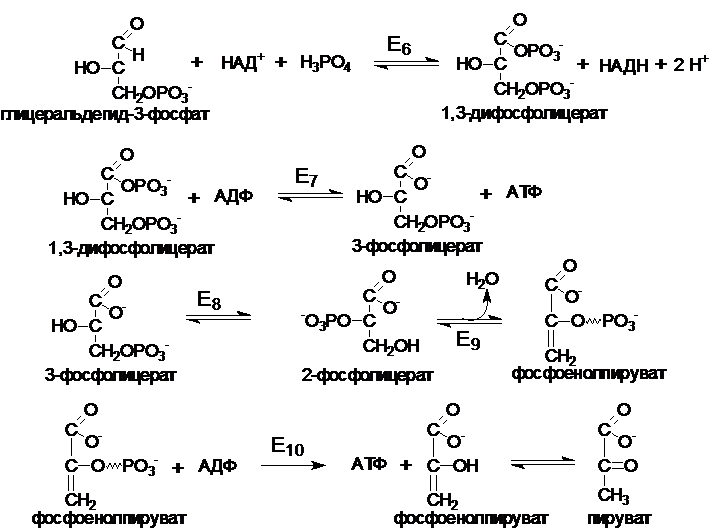
Второй этап (глицеральдегид ® пируват)
протекает с выходом энергии в виде АТФ и НАДН (4 АТФ и 2 НАДН).
Е6 - глицеральдегид-3-фофатдегидрогеназа
Е7 - фосфоглицераткиназа
Е8 - фосфоглицератфосфомутаза
Е9 - енолгидратаза
Е10 - прируваткиназа
Особенности
ферментов гликолиза.
На пути гликолиза три реакции являются
необратимыми (реакция 1 -глюкокиназная,
реакция 3 - фофофруктокиназная,
реакция 10 - пируваткиназная). Они
катализируются регуляторными ферментами и определяют скорость всего процесса гликолиза.
Кроме того, именно эти реакции отличаются от реакций обратного пути - синтеза
глюкозы (глюконеогенеза).
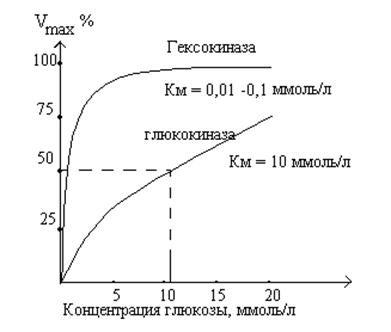
Гексокиназа и глюкокиназа
Глюкокиназная реакция - первая
АТФ-зависимая реакция гликолиза. Она катализируется тканеспецифическими
ферментами - гексокиназами. У человека
известно 4 изомера гексокиназ (типы I - IV). Изофермент IV
типа - глюкокиназа. Глюкокиназа находится только в печени и имеет высокое значение
Км к глюкозе. Это приводит к тому, что фермент насыщается субстратом
лишь при очень высоких концентрациях глюкозы. Гексокиназа катализирует
фосфорилирование глюкозы при любых (в том числе низких) концентрациях глюкозы и
ингибируется продуктом глюкозо-6-фосфатом. Глюкокиназа не ингибируется
глюкозо-6-фосфатом. При увеличении концентрации глюкозы после приема пищи
увеличивается скорость глюкокиназной реакции. Глюкозо-6-фосфат не проходит
через клеточные мембраны и задерживается в клетке, поэтому больше глюкозы задерживается
в печени. Таким образом, глюкокиназа является буфером глюкозы в крови. В тоже
время, в тканях, энергетический обмен которых зависит от глюкозы, локализован
изофермент с низким значением Км.
Глюкозофосфатизомераза
Фермент имеет почти равное значение Км
для глюкозо-6-фосфата и фруктозо-6-фосфата. Этот фермент по-другому называют
гексозофосфатизомераза. Катализирует реакции гликолиза и глюконеогенеза.
Фосфофруктокиназа
Этот фермент катализирует только прямую
реакцию, т.е. эта реакция гликолиза является необратимой и определяет скорость
всего процесса.
Фруктозодифосфатальдолаза катализирует
реакции гликолиза и глюконеогенеза.
Триофосфатизомераза катализирует
равновесную реакцию, и равновесие смещается в сторону гликолиза или
глюконеогенеза по принципу действия масс.
Глицеральдегид-3-фосфатдегидрогеназа катализирует
реакции гликолиза и глюконеогенеза.
Фосфоглицераткиназа катализирует
обратимую реакцию (гликолиза и глюконеогенеза). Эта реакция имеет большое
значение в эритроцитах, т.к. образующийся 1,3-дифосфоглицерат под действием
фермента дифосфоглицератмутазы превращается
в 2,3-дифосфоглицерат (ДФГ) - регулятор сродства Hb
к кислороду.
Фосфоглицератфосфомутаза и енолгидратаза катализируют
превращение относительно низкоэнергетической связи в 3-фосфоглицерате в высокоэнергетическую
форму, а затем в АТФ.
Пируваткиназа - регуляторный фермент, который катализирует необратимую реакцию, в
которой высокоэнергетический фосфат фосфоенолпирувата превращается в АТФ.
Пируват далее окисляется в митохондриях.
Распад глюкозы до пирувата протекает в цитоплазме, поэтому существует
специальный переносчик пирувата в митохондрии по механизму симпорта с Н+.
Образующийся НАДН также должен быть транспортирован в митоходрии для окисления
в цепи переноса электронов.
Суммарное уравнение гликолиза
Глюкоза
+ 2 АДФ + 2 НАД+ + 2 H3PO4 ® 2 Пируват + 2АТФ + 2 НАДН + 2 Н+
Челночные
механизмы.
Перенос водорода с цитозольного НАДН в
митохондрии происходит при участии специальных механизмов, называющихся челночными. Суть этих механизмов
сводится к тому, что НАДН в цитозоле восстанавливает некоторое соединение,
способное проникать в митохондрию; в митохондрии это соединение окисляется,
восстанавливая внутримитохондриальный НАД+, и вновь переходит в
цитозоль. Самая активная малат-аспартатная система, действующая в митохондриях
печени, почек и сердца. На каждую пару электронов цитозольной НАДН, переданную
на кислород по этой системе, образуется 3 молекулы АТФ.
В скелетных мышцах и мозге перенос
восстановительных эквивалентов от цитозольной НАДН осуществляет
глицеролфосфатная система. При этом восстановительные эквиваленты передаются в
цепь переноса электронов через комплекс II,
и поэтому синтезируется только 2 молекулы АТФ.
Выход АТФ при аэробном гликолизе.
Основное физиологическое значение
аэробного распада глюкозы заключается в использовании ее энергии для синтеза
АТФ.
В наибольшей зависимости от аэробного
гликолиза находится мозг. Он расходует 100 г глюкозы в сутки. В состоянии
основного обмена около 20% кислорода потребляется мозгом. Поэтому недостаток
глюкозы или кислорода проявляется, прежде всего, симптомами со стороны центральной
нервной системы - головокружением, потерей сознания, судорогами.
|
Этапы |
Соединения, в которых запасена энергия |
Выход АТФ |
|
В
ходе распада глюкозы до пирувата |
2
АТФ (субстратное фосфорилирование) + 2 НАДН |
2
АТФ + 6 (или 4) АТФ (в зависимости от челночного механизма) = 8 (или 6) АТФ |
|
При
окислительном декарбоксилировании пирувата |
2
´
(НАДН) |
6 АТФ |
|
В
цикле Кребса |
2
´
(ГТФ + 3 НАДН + 1 ФАДН2) |
24 АТФ |
|
Всего |
|
38 (или 36)
АТФ |
Анаэробный
гликолиз.
При аэробных условиях продуктом
гликолиза в тканях является пируват, а НАДН, образовавшийся в ходе окисления,
реокисляется за счет молекулярного кислорода. В анаэробных условиях, т. е. при
недостатке кислорода в тканях, например в напряженно работающих скелетных мышцах,
образовавшийся НАДН реокисляется не за
счет кислорода, а за счет пирувата, восстанавливающегося при этом в лактат
(молочную кислоту). Восстановление пирувата до лактата катализирует изофермент лактатдегидрогеназа.

Лактатдегидрогеназа представляет собой
тетрамер, содержащий протомеры двух типов - М (muscle)
и Н (heart). Известно 5 изоферментов, различающихся набором протомеров.
Изомерные формы ЛДГ1 и ЛДГ2 обнаруживаются в мозге, сердце, корковом веществе
почек, т.е. в тканях с интенсивным снабжением кислородом. Форма ЛДГ3
- в поджелудочной железе, ЛДГ4 и ЛДГ5 в скелетных мышцах,
печени, мозговом веществе почек, т.е. в тканях с менее интенсивным снабжением
кислородом. Все эти формы ферментов значительно различаются максимальной
скоростью реакции и константами Михаэлиса для лактата и пирувата. ЛДГ5
быстро катализирует восстановление пирувата в лактат при низких концентрациях
лактата. ЛДГ1 катализирует быстрое окисление лактата в пируват в
сердечной мышце.
Суммарное уравнение анаэробного гликолиза.
Глюкоза
+ 2 АДФ + 2 H3PO4 =
2 Лактат + 2 АТФ + 2 Н2О
В анаэробном гликолизе АТФ образуется
только за счет субстратного фосфорилирования (2 моль АТФ на 1моль глюкозы).
Значение анаэробного гликолиза особенно
велико для скелетных мышц. В интенсивно работающих скелетных мышцах мощность
механизма транспорта кислорода оказывается недостаточной для обеспечения энергетической
потребности, в этих условиях резко усиливается анаэробный гликолиз, и в мышцах
накапливается молочная кислота. Особое значение анаэробный гликолиз имеет при
кратковременной интенсивной работе. Так, бег в течение 30 с полностью
обеспечивается анаэробным гликолизом. Однако уже через 4-5 мин бега энергия поставляется
поровну анаэробным и аэробным процессами, а через 30 мин - почти целиком аэробным
процессом. При длительной работе в аэробном процессе используется не глюкоза, а
жирные кислоты.
Эритроциты вообще не имеют митохондрий,
поэтому их потребность в АТФ удовлетворяется только за счет анаэробного
гликолиза. Интенсивный гликолиз характерен также для злокачественных опухолей.
Цикл Кори (глюкозо-лактатный цикл) и
глюкозо-аланиновый цикл.
Молочная кислота не является конечным
продуктом обмена, но ее образование - тупиковый путь метаболизма: ее дальнейшее
использование связано опять с превращением в пируват. Из клеток, в которых
происходит гликолиз, образующаяся молочная кислота поступает в кровь и улавливается
в основном печенью, где и превращается в пируват. Пируват в печени частично
окисляется, а частично превращается в глюкозу. Часть пирувата в мышцах путем
трансаминирования превращается в аланин, который транспортируется в печень, и
здесь снова образует пируват.

Рис.
Цикл Кори и глюкозо-аланиновый цикл
Биосинтез
глюкозы (глюконеогенез).
Глюконеогенез протекает в основном по
тому же пути, что и гликолиз, но в обратном направлении. Однако три реакции
гликолиза необратимы, и на этих стадиях реакции глюконеогенеза отличаются от
реакций гликолиза.
Обходные пути глюконеогенеза.
I.
Первый обходной путь - превращение пирувата в фосфоенолпируват.
Это превращение осуществляется под
действием двух ферментов - пируваткарбоксилазы
(Е1) и карбокикиназы
фосфоенолпирувата (Е2).
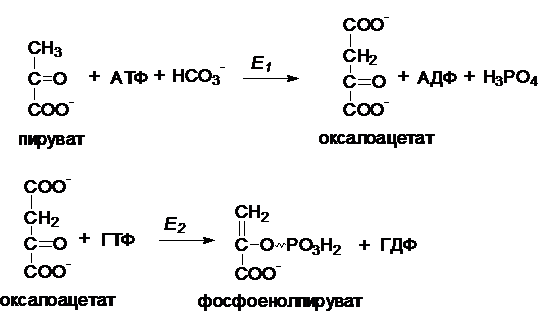
II.
Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализирует фермент
фруктозо-1,6-дифосфатаза.
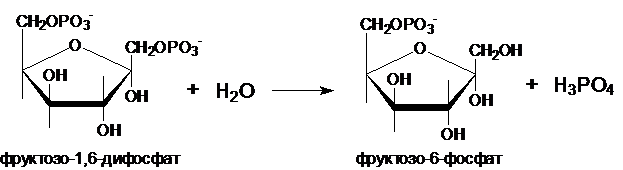
III.
Образование глюкозы из глюкозо-6-фосфата катализирует фермент глюкозо-6-фосфотаза .
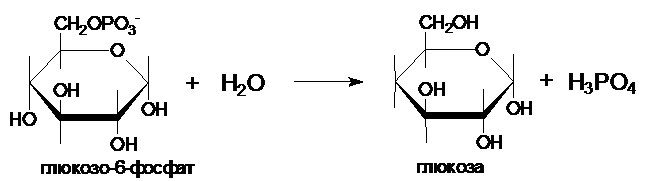
Этот фермент отсутствует в клетках
мозга, скелетных мышц и др. тканях, поэтому глюконеогенез, протекающий в этих
тканях не может поставлять глюкозу в кровь. Глюкозо-6-фосфатаза локализована в
почках и, особенно, в печени, и глюкозо-6-фосфат может превращаться в глюкозу,
если ее уровень в крови снижен.
Пентозофосфатный
путь (ПФП).
Значение ПФП.
Большая часть глюкозы расщепляется по
гликолитическому пути. Наряду с гликолизом существуют второстепенные пути
катаболизма глюкозы, одним из которых является пентозофосфатный путь (ПФП).
Пентозофосфатный путь скорее даже - анаболический путь, который использует 6 атомов
С глюкозы для синтеза пентоз и восстановительных эквивалентов в виде НАДФН,
необходимых для образования липидов в организме. Однако, этот путь - окисление
глюкозы, и при определенных условиях может завершиться полным окислением
глюкозы до СО2 и Н2О. Главные функции этого цикла
следующие:
Генерирование
восстановительных эквивалентов в виде НАДФН для восстановительных реакций
биосинтеза. Ферменты, которые катализируют реакции восстановления, часто
используют в качестве кофактора НАДФ+/НАДФН, а окислительные
ферменты - НАД+/НАДН. Восстановительные реакции биосинтеза жирных кислот
и стероидных гормонов требуют НАДФН, поэтому клетки печени, жировой ткани и
др., где протекает синтез липидов, имеют высокий уровень ферментов ПФП. В
печени около 30% глюкозы подвергаются превращениям в ПФП.
НАДФН
используется при обезвреживании лекарств и чужеродных веществ в
монооксигеназной цепи окисления в печени.
НАДФН
предохраняет ненасыщенные жирные кислоты эритроцитарной мембраны от аномальных
взаимодействий с активным кислородом. Кроме того, эритроциты используют реакции
ПФП для генерирования больших количеств НАДФН, который необходим для восстановления
глутатиона, участвующего в системе обезвреживания активного кислорода, что
позволяет поддерживать нормальную степень окисления Fe2+ в гемоглобине.
Снабжение клеток
рибозо-5-фосфатом для синтеза нуклеотидов, нуклеотидных коферментов и
нуклеиновых кислот. Превращение рибонуклеотидов в дезоксирибонуклеотиды также
требует НАДФН, поэтому многие быстро пролиферирующие клетки требуют больших
количеств НАДФН.
Хотя это не
значительная функция ПФП, он принимает участие в метаболизме пищевых пентоз,
входящих в состав нуклеиновых кислот пищи и может превращать их углеродный
скелет в интермедиаты гликолиза и глюконеогенеза.
Реакции ПФП.
Реакции ПФП
протекают в цитоплазме. ПФП можно разделить на два этапа: окислительный и неокислительный.
Субстратом является глюкозо-6-фосфат. Первая и третья реакции катализируются
НАДФ-зависимыми дегидрогеназами. На этом этапе происходит окисление глюкозы с
образованием 2 НАФН, поэтому реакции (1 - 3) - окислительная фаза ПФП. Фермент
Е1 (глюкозо-6-фосфат-дегидрогеназа)
- ключевой фермент ПФП, катализирует образование 6-глюконолактона. Лактон является неустойчивым соединением, которое
легко гидролизуется спонтанно и под действием фермента Е2(специфической лактоназы). Фермент Е3
(6-фосфоглюконат-дегидрогеназа)
катализирует реакцию окислительного декарбоксилирования.

Рибулозо-5-фосфат
под действием ферментов рибозофосфатизомеразы
и рибулозо-5-фосфат-3-эпимеразы может
обратимо изомеризоваться в другие пентозы: рибозо-5-фосфат, ксилулозо-5-фосфат.
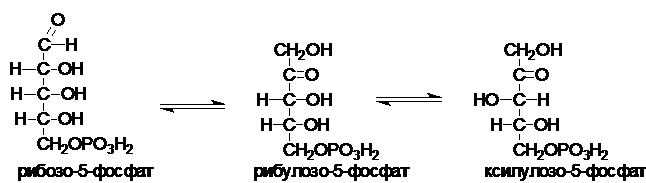
В некоторых
тканях ПФП на этом заканчивается Суммарное уравнение ПФП:
глюкозо-6-фосфат
+ Н2О + НАДФ+ ® рибозо-5-фосфат
+ СО2 + НАДФН×Н+
Некоторые клетки
нуждаются в большем количестве НАДФН, по сравнению с рибозо-5-фосфатом, т.е.
НАФДН утилизируется, а рибозо-5-фосфат остается в избытке. В таких случаях
рибозо-5-фосфат превращается в глицеральдегид-3-фосфат и фруктозо-6-фосфат (второй
этап). Этот этап связывает ПФП с гликолизом.
Эти превращения
катализируются двумя ферментами: транскетолазой
(Е4) и трансальдолазой
(Е5).
I
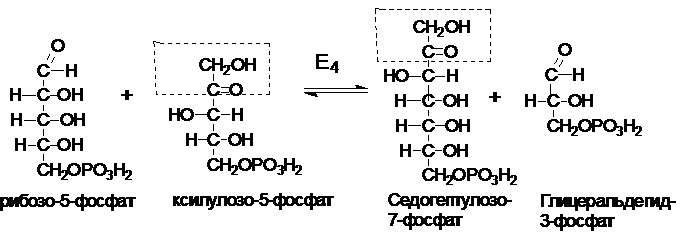
II

III
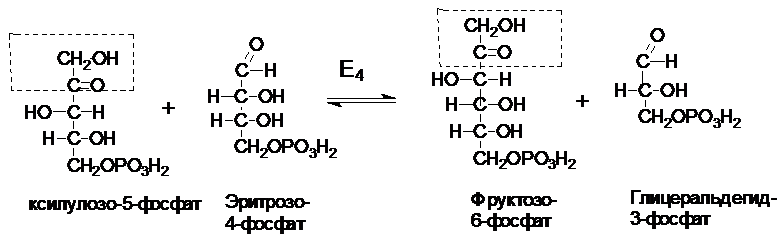
Фруктозо-6-фосфат
и глицеральдегид-3-фосфат вступают на путь гликолиза.
Суммарное
уравнение 2-го этапа:
рибозо-5-фосфат + 2
ксилулоза-5-фосфат ® 2 фруктозо-6-фосфат + глицеральдегид-3-фосфат
Общая
характеристика метаболизм гликогена.
Так как глюкоза свободно диффундирует
через клеточные мембраны, она не может служить резервным источником энергии в
клетках тканей. Фосфорилирование глюкозы задерживает ее в клетке, но
накапливаться глюкозо-6-фосфат не может, т.к. при этом увеличилось бы
количество проникающей в клетку воды за счет осмоса. Создание запаса недиффундирующей
глюкозы без осмотического набухания возможно благодаря способности некоторых
тканей (печени и мышц) превращать избыток углеводов в нерастворимый полимер - гликоген.
Биосинтез гликогена (гликогенез).
Анаболический процесс требует затрат
энергии. В обмене углеводов источниками энергии являются АТФ и УДФ.

Фермент гликогенсинтаза катализирует только образование a(1®4) связей путем
переноса гликозидной группы от УДФ-глюкозы на невосстанавливающий конец
гликогена. Этот фермент не способен образовывать a(1®6)-связи. Другой
ветвящий фермент (гликозил-4®6-трансфераза) образует a(1®6)-связи путем
переноса фрагментов, содержащих 6-7 остатков глюкозы. В результате работы двух
ферментов образуется разветвленная структура гликогена, которая обеспечивает быстрое
присоединение или освобождение глюкозы благодаря множеству концевых участков и
придает компактность и плотность резервному источнику глюкозы.
УДФ-глюкоза играет ключевую роль в
процессах анаболизма углеводов. На рисунке представлены пути возможной
утилизации УДФ-глюкозы.
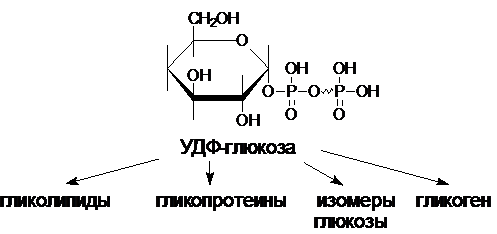
Есть и другой путь синтеза
полисахаридов. В качестве промежуточного соединения может выступать не
УДФ-глюкоза, а долихолфосфат-глюкоза или ретинил-фосфат-глюкоза.
Распад гликогена (гликогенолиз).
Деградация запасенного гликогена
происходит в ответ на повышение потребностей в глюкозе. Фермент гликогенфосфорилаза последовательно отделяет
остатки глюкозы от линейной цепи гликогена с образованием глюкозо-1-фосфата и,
укороченной на один остаток глюкозы, цепи гликогена.
![]()
Глюкоза, отщепляясь от гликогена,
активируется (т.е. превращается в глюкозо-1-фосфат), и это происходит без
участия АТФ или УТФ. В стандартном состоянии изменение свободной энергии в этой
реакции DG0` > 0.
Однако, концентрация H3PO4 в клетке высокая, а глюкозо-1-фосфата
- низкая, поэтому равновесие, сдвинуто в сторону образования глюкозо-1-фосфата.
Гликогенфосфорилаза не может отщеплять остатки глюкозы в местах ветвления
гликогена. Её активность падает за 4 остатка глюкозы до точки ветвления. Эти остатки
отделяются специальным неветвлящим
ферментом. Связи a(1®6) гидролизуются
под действием фермента гликоген-6-глюканогидролазы.
При этом открывается новый участок для действия гликогенфосфорилазы. В среднем
на 10 молекул глюкозо-1-фосфата образуется 1 молекула глюкозы.
При использовании гликогена в качестве
резервуара глюкозы хранение энергии обходится клетке в 1 макроэргический
эквивалент на 1 молекулу глюкозо-1-фосфата.
Регуляция гликогенолиза и гликогенеза.
Гликоген накапливается в клетке во время
пищеварения и расходуется в промежутках между приемами пищи. При смене этих
периодов должны изменяться относительные скорости распада и синтеза гликогена. Регуляторные механизмы
должны быть такими, чтобы при включении одного из процессов автоматически
выключался бы другой. Ключевую роль в регуляции гликонеогенеза и гликогенеза
играют ферменты гликогенфосфорилаза и
гликогенсинтаза.
Обмен
фруктозы и его нарушения.
Фруктоза включается на путь распада
глюкозы на стадии триозофосфатов.

С наследственной недостаточностью фруктозо-1-фосфатальдолазы (фермент 2 на
схеме) связана наследственная непереносимость фруктозы. В этом случае при
наличии в пище фруктозы в тканях накапливается фруктозо-1-фосфат, который
ингибирует альдолазу фруктозо-1,6-дифосфата. В результате нарушается и распад
глюкозы. Кроме того, фруктозо-1-фосфат ингибирует фосфорилазу гликогена. Эти
причины приводят к появлению гипоглюкоземии
после приема пищи, содержащей фруктозу или сахарозу.
Известно также наследственное нарушение - фруктоземия, вызванная недостаточностью
фруктокиназы. Поступающая в организм фруктоза не подвергается изменениям в
организме, поступает в кровь и выводится с мочой.
Обмен
галактозы и его нарушения.
Галактоза включается в метаболизм путем
превращения в глюкозо-1-фосфат.
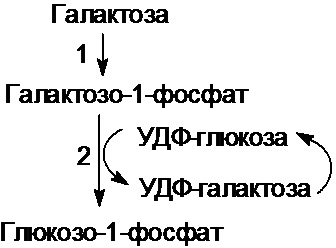
Известно наследственное заболевание - галактоземия, при котором имеется недостаточность
галактозо-1-фосфат-уридилтрансферазы
(фермента 2 на схеме). Болезнь обнаруживается с первых дней рождения,
проявляется в отказе от еды, рвоте, поносе. Характерным для галактоземии
является помутнение хрусталика (катаракта). Перевод на пищу, не содержащую
галактозу, полностью предотвращает все проявления болезни, но катаракта не
исчезает.
ОБМЕН ЛИПИДОВ.
Липиды представляют
собой нерастворимые в воде маслянистые вещества. Липиды организма человека
включают соединения, значительно различающиеся и по структуре и по функциям в
живой клетке.
Биологические функции липидов.
Липиды
– важная составная часть питания не только из-за высокой энергетической
ценности, но и из-за содержания в них жирорастворимых витаминов. Жир служит в
организме эффективным источником энергии и обеспечивает долговременный ее запас
в жировой ткани.
Жир
обеспечивает теплоизоляцию.
Мембраны
клеток построены из полярных липидов.
Липиды
являются электроизоляторами и обеспечивают быстрое распространение волн
деполяризации вдоль миелинированных нервных волокон, поэтому в состав нервной
ткани входит большое количество липидов.
Комплексы
липидов с белками (липопротеины) являются важными клеточными компонентами,
присутствуют в мембранах, митохондриях, служат средством транспортировки
липидов в токе крови.
I. Простые липиды – сложные эфиры жирных кислот с различными спиртами.
1) Жиры и
масла – сложные эфиры жирных кислот с
глицеролом.
2) Воска - сложные эфиры жирных кислот с одноатомными спиртами.
II. Сложные липиды – сложные эфиры жирных кислот со спиртами, дополнительно содержащими
другие группы.
1)
Фосфолипиды.
а)
Глицерофосфолипиды
б)
Сфингофосфолипиды
2)
Гликолипиды
III. Другие сложные липиды (сульфолипиды, аминолипиды, липопротеины).
IV. Предшественники и производные липидов.
Жирные
кислоты
Глицерол
Стероиды
Альдегиды жирных
кислот
Спирты
Жирорастворимые
витамины и гормоны
Эйкозаноиды – производные жирных кислот, содержащие пятиуглеродный
цикл. Выполняют регуляторные функции.
Обмен
жирных кислот.
Общая характеристика биологически
активных жирных кислот.
Некоторые
жирные кислоты, которые часто встречаются в липидах человека, приведены в
таблице 1 (в таблице приведены также цифровые символы ж.к. В цифровом символе
первое число указывает на число атомов углерода в ж.к., второе – на число
двойных связей, а числа в скобках – на положение двойных связей в молекуле
ж.к.).
Жирные
кислоты бывают насыщенные и ненасыщенные (содержат двойные связи в молекуле
между атомами углерода).
Систематическое
название ж.к. чаще всего образуется путем добавления к названию углеводорода
окончания -овая ( насыщенные ж.к.
имеют окончание –ановая, а
ненасыщенные - -еновая). Атомы
углерода нумеруются, начиная от карбоксильной группы (содержащей атом углерода
1). Атом углерода, следующий за карбоксильной группой (углерод 2), называют
также a-углеродом и т.д. Для
указания числа двойных связей и их положения были приняты различные
обозначения: D9 –
двойная связь находится между 9 и 10 атомами углерода; w9 – двойная связь находится между 9 и 10 атомами
углерода, если их отсчитывать с другого (противоположного карбоксильному) конца
(w-конца) (см. рис.1).
Ненасыщенные
ж.к. подразделяют по степени ненасыщенности:
А)
Мононенасыщенные
Б)
Полиненасыщенные
В)
Эйкозаноиды. Эти соединения
образуются из полиеновых ж.к. и подразделяются на простаноиды и лейкотриены. Простаноиды включают простагландины, простациклины и тромбоксаны.
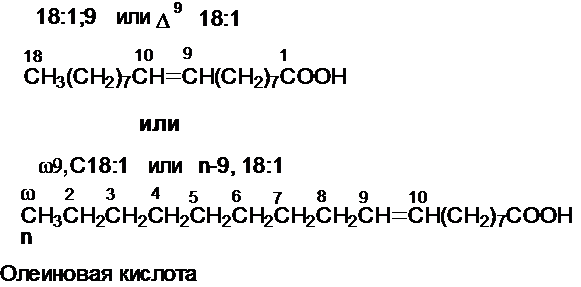
Все
природные ненасыщенные ж.к. имеют цис-конфигурацию
двойных связей.
Таблица
1. Некоторые жирные кислоты липидов
человека
|
Название кислоты |
Цифровой символ |
|
Насыщенные жирные кислоты |
|
|
Масляная |
4:0 |
|
Миристиновая |
14:0 |
|
Пальмитиновая |
16:0 |
|
Стеариновая |
18:0 |
|
Арахиновая |
20:0 |
|
Бегеновая |
22:0 |
|
Лигноцериновая |
24:0 |
|
Ненасыщенные жирные кислоты |
|
|
Пальмитоолеиновая |
16:1(9) |
|
Олеиновая |
18:1(9) |
|
Линолевая |
18:2(9,12) |
|
a-Линоленовая |
18:3(9,12,15) |
|
g-Линоленовая |
18:3(6,9,12) |
|
Арахидоновая |
20:4(5,8,11,14) |
|
Невроновая |
24:1(15) |
Подавляющее
большинство ж.к. организма имеет четное число атомов углерода. Жирнокислотный
состав разных групп липидов различный. В жирах в большом количестве содержатся
олеиновая пальмитиновая и линолевая кислоты. Состав мембранных липидов более
разнообразен. В одну молекулу мембранного липида входит по одной молекуле
насыщенной и ненасыщенной ж.к.
Источниками
ж.к. организма служат липиды пищи (главным образом жиры) и синтез ж.к. из углеводов.
Расходуются
ж.к. в основном по трем направлениям: 1) включаются в состав резервных жиров;
2) включаются в состав сложных липидов; 3) окисляются до СО2 и Н2О
с использованием энергии для синтеза АТФ.
Основные пути превращения жирных кислот.
В
общем случае основные пути превращений жирных кислот можно представить
следующим образом:
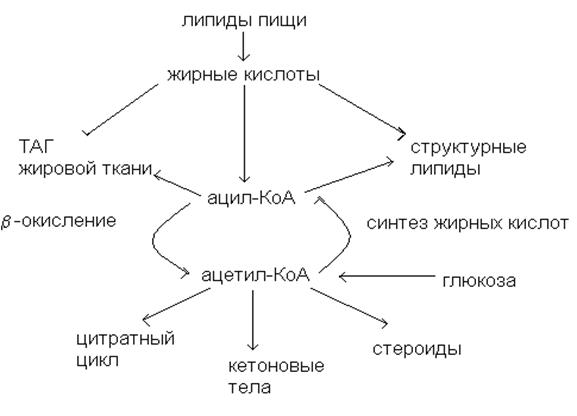
Свободные
ж.к. в тканях содержатся в небольших концентрациях, т.к. они служат лишь
промежуточными продуктами при синтезе и распаде других липидов. Свободными ж.к.
называют ж.к., находящиеся в неэтерифицированной форме. В плазме крови
длинноцепочечные ж.к. образуют комплекс с альбумином, а в клетке – с белком,
связывающим ж.к. (Z-белком).
Активация жирных кислот.
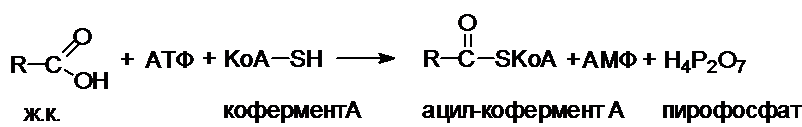
Все
превращения свободных ж.к. в клетках начинаются с их активации (с образования
ацил-КоА).
![]()
Фермент
ацил-КоА-синтетаза (тиокиназа) катализирует превращение свободной жирной
кислоты в «активную ж.к.» (ацил-КоА). Присутствие
неорганической пирофосфатазы, расщепляющей макроэргическую связь в пирофосфате,
обеспечивает полноту протекания процесса активации.
Таким
образом, для активации одной молекулы ж.к. расходуются две макроэргические
связи.
Ацил-КоА-синтетазы
находятся в эндоплазматическом ретикулуме,
а также внутри митохондрий и на их наружной мембране.
Окисление насыщенных жирных кислот.
В
катаболизме ж.к. можно выделить три части:
b-окисление
– специфический путь окисления ж.к., завершающийся превращением молекулы ж.к. в
несколько молекул ацетил-КоА (промежуточный обмен); ЦЛК; ЦПЭ.
b-Окисление жирных кислот.
Последовательность реакций.
При
b-окислении окисляется
группа –СН2- в b-положении ж.к. до карбонильной группы. При этом на двух стадиях
происходит дегидрирование: при участии фермента ацил-КоА-дегидрогеназы (Е1,
флавопротеин, простетическая группа – ФАД, с ФАДН2 атомы водорода
передаются в дыхательную цепь на кофермент Q) и b-гидроксиацил-КоА-дегидрогеназой (Е3) при участии в качестве
кофермента НАД+. Затем b-кетоацил-КоА при действии тиолазы (Е4)
распадается на ацетил-КоА и ацил-КоА, укороченный на 2 углеродных атома.

Этот
ацил-КоА вновь подвергается b-окислению.
Использование
ж.к. путем b-окисления происходит во
многих тканях. Особенно значительна роль этого источника энергии в скелетных мышцах
при длительной физической работе и в сердечной мышце. Около 70% кислорода,
поглощаемого сердечной мышцей, используется для окисления жирных кислот.
Нервная ткань не использует ж.к. как источник энергии.
Обмен
пропионовой кислоты.
В организме преобладают ж.к. с четным числом атомов углерода. Из ж.к. с нечетным числом углеродных атомов на завершающей стадии b-окисления образуется пропионил-КоА. Пропионил-КоА образуется и при распаде некоторых аминокислот (валина, изолейцина, треонина, метионина).
Пропионил-КоА
окисляется по особому пути:
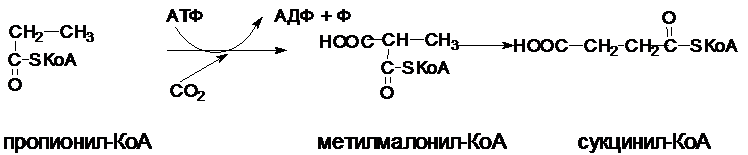
Вначале происходит карбоксилирование
пропионил-КоА с образованием метилмалонил-КоА. Фермент, катализирующий эту
реакцию, содержит биотин. Затем
метилмалонил-КоА под действием фермента метилмалонилмутазы – превращается в
сукцинил-КоА – один из субстратов ЦЛК. Этот фермент содержит в качестве
кофермента дезоксиаденозилкобаламин
– одну из коферментных форм витамина В12. При недостатке витамина В12
эта реакция замедляется, и с мочой выводятся большие количества метилмалоната и
пропионата.
Энергетика
окисления жирных кислот.
В результате переноса электронов по дыхательной цепи от восстановленного
флавопротеина через кофермент Q и НАД
синтезируется по 5 молекул АТФ на каждые 7 (из 8) молекул ацетил-КоА,
образующихся при b-окислении пальмитиновой кислоты
(7*5 =35 АТФ). Всего образуется 8 молекул ацетил-КоА, каждая из которых,
проходя через ЦЛК, обеспечивает синтез 12 АТФ. Всего на молекулу пальмитата по
этому пути генерируется 12*8 = 96 АТФ. Если учесть 2 АТФ, необходимые для активации
жирной кислоты, то получается 96 + 35 – 2 = 129 АТФ на 1 моль пальмитиновой
кислоты.
Синтез
и использование кетоновых тел.

В печени часть жирных кислот превращается в кетоновые
тела – ацетоуксусную, b-гидроксимаслянную кислоты и ацетон. Эти соединения образуются из
ацетил-КоА.
Синтез кетоновых
тел.
Ацетил-КоА, образовавшийся при
окислении жирных кислот включается в цитратный цикл в условиях, когда окисление
углеводов и липидов сбалансировано, т.к. включение ацетил-КоА в ЦЛК зависит от
доступности оксалоацетата, являющегося в основном продуктом обмена углеводов.

В условиях, когда преобладает
расщепление липидов, образовавшийся ацетил-КоА вступает на путь синтеза
кетоновых тел.
Ацетоацетат (ацетоуксусная кислота)
образуется из ацетил-КоА в три стадии. Затем свободный ацетоацетат
восстанавливается в ходе обратимой реакции до 3-гидроксибутирата или
декарбоксилируется спонтанно или ферментативно в ацетон. У людей с высоким содержанием
ацетона в крови в выдыхаемом воздухе может ощущаться запах ацетона.
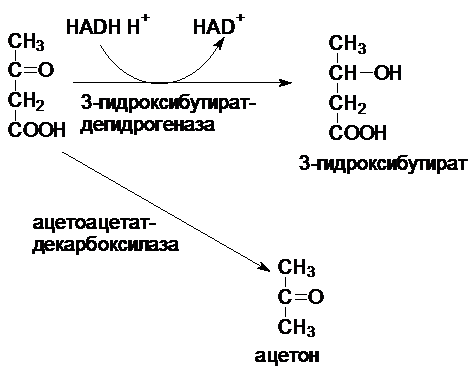
Использование
кетоновых тел.
Ацетоацетат и 3-гидроксибутират в
норме играют роль топлива и являются важным источником энергии. Кетоновые тела
поступают в кровь и могут использоваться как источники энергии в других тканях.

Образовавшийся ацетил-КоА далее вступает
в цитратный цикл. При этом в связи отсутствием в печени
3-кетоацил-КоА-трансферазы сама печень не способна использовать ацетоацетат в
качестве источника энергии, снабжая им те или другие органы. Т.О. ацетоацетат
можно рассматривать как водорастворимую транспортную форму ацетильных
компонентов.
В норме кетоновые тела в крови человека
отсутствуют или их концентрация невелика (~ 3 мг/дл). Содержание кетоновых тел
увеличивается в таких состояниях, когда источником энергии для организма служат
жирные кислоты – при длительной мышечной работе, при голодании, при некоторых
болезнях. Через двое суток голодания концентрация кетоновых тел в крови
достигает 5-6 мг/дл, через неделю – 40-50 мг/дл. При сахарном диабете
концентрация кетоновых тел может повышаться до 300-400 мг/дл, что приводит к
метаболическому ацидозу.
Биосинтез
насыщенных жирных кислот.
Особенности
биосинтеза жирных кислот.
Особенность биосинтеза жирных кислот заключается в
том, что в митохондриях существует система удлинения уже существующих средне
цепочечных жирных кислот, которая представляет несколько модифицированную
последовательность реакций b-окисления, в то время как полный
биосинтез пальмитиновой кислоты из низкомолекулярных предшественников в
митохондриях невозможен. Этот биосинтез активно протекает вне митохондрий по
совершенно другому пути, никак не связанному с b-окислением.
Кроме того, синтез жирных кислот в цитозоле имеет ряд других особенностей:
Непосредственным
предшественником семи (из восьми) двууглеродных фрагментов молекулы
пальмитиновой кислоты является малонил-КоА, образующийся из ацетил-КоА.
Ацетил-КоА
непосредственно в реакциях синтеза используется как затравка.
Для
восстановления промежуточных процессов синтеза жирных кислот используется НАДФН×Н+.
Все стадии
синтеза жирной кислоты из малонил-КоА представляют собой циклический процесс,
который протекает на поверхности пальмитатсинтазы.
Коферменты
синтазного комплекса.
Биосинтез
жирных кислот протекает с участием НАДФН, АТФ, Mn2+ и HCO3-, а также
биотин.
Образование
малонил-КоА.
Образование малонил-КоА протекает в
цитозоле. Ацетил-КоА в цитоплазме образуется из цитрата, который поступает из
митохондрий и расщепляется с помощью фермента АТФ-цитратлиазы:
![]()
Первой реакцией биосинтеза жирных
кислот, катализируемой ацетил-КоА-карбоксилазой
и осуществляется за счет энергии АТФ, является карбоксилирование ацетил-Ко;
источником СО2 является бикарбонат. Эта стадия является лимитирующим
этапом, определяющим скорость всего процесса биосинтеза жирных кислот в
животных тканях. Ацетил-КоА-карбоксилаза представляет собой полиферментный
комплекс. Для функционирования этого фермента необходим фермент биотин. Фермент имеет регуляторный
аллостерический центр. Этот фермент ингибируется длинноцепочечными ацил-КоА и
активируется цитратом. Реакция протекает в 2 стадии: 1) карбоксилирование
биотина с участием АТФ и 2) перенос карбоксильной группы на ацетил-КоА. В
результате образуется малонил-КоА.
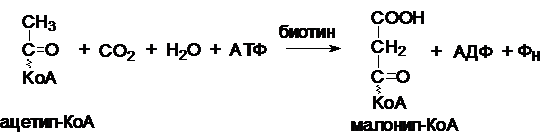
Синтез пальмитиновой кислоты (пальмитата).
Центральную роль в дальнейшем синтезе
жирных кислот играет пальмитилсинтаза – полиферментный
комплекс, состоящий из 7 ферментов, каждый из которых выполняет определенные
функции. У человека этот фермент активен только в виде димера. Центральное
место в каждом из димеров занимает ацилпереносящий белок (АПБ), который
содержит фосфорилированную пантотеновую кислоту (фосфопантотеин). Фосфопантотеин
имеет на конце –SH группу. Кроме того, в непосредственной близости от этой
группы расположена еще одна SH-группа, принадлежащая
остатку цистеина, входящего в состав 3-кетоацилсинтазы (b-кетоацилсинтазы)
другого мономера.
На первом этапе ацетильный остаток
переносится на SH-группу цистеина, а малонильный остаток переносятся на
SH-группу 4`-фосфопантетеина пальмитилсинтетазы (ацилтрансферазная активность)
(реакции 1 и 2).
Далее в реакции 3 ацетильный остаток
переносится на место карбоксильной
группы малонильного остатка; карбоксильная группа при этом отщепляется в
виде СО2. Затем последовательно происходит восстановление
3-карбонильной (b-карбонильной) группы (реакция
4), отщепление воды с образованием двойной связи между a- (2) и b- (3)
углеродными атомами (реакция 5), восстановление двойной связи (реакция 6). В результате
получается остаток четырехуглеродной кислоты, соединенной с ферментом через
пантотеновую кислоту (бутирил-Е). Далее новая молекула малонил-КоА
взаимодействует с SH-группой
фосфопантетеина, при этом насыщенный ацильный остаток перемещается на свободную
SH-группу цистеина.
Общая характеристика жиров.
Природные жиры представляют собой смесь триацилглицеролов, различающихся
по жирнокислотному составу. В триацилглицеролах человека содержится много
ненасыщенных жирных кислот, поэтому жир человека имеет низкую температуру
плавления (10-150С) и находится в клетках в жидком состоянии.
Другие животные жиры отличаются по жирнокислотному составу, имеют различную
температуру плавления (сливочное масло, говяжий жир, подсолнечное масло).
Жиры нерастворимы в воде, и с этим связан ряд особенностей их обмена:
необходимость специальных механизмов транспорта их с кровью и лимфой, а также
возможность депонирования их в клетках подобно гликогену.
Переваривание
жиров.
Жиры – одна из групп основных пищевых веществ человека. Суточная потребность
в них составляет 50-100г. Жиры обеспечивают до 50% потребности организма в
энергии. У взрослого человека условия для переваривания жиров имеются только в кишечнике. В двенадцатиперстную
кишку поступает желчь и сок поджелудочной железы, который содержит
панкреатическую липазу, гидролизующую сложноэфирную связь в триацилглицеролах.
В составе желчи содержатся желчные кислоты – производные холестерола:
Поскольку жиры нерастворимы в воде, а липаза нерастворима в жирах, то
гидролиз происходит на границе раздела фаз
и, следовательно, скорость переваривания зависит от площади этой
поверхности. Желчные кислоты обладают амфифильным свойствами. На поверхности
раздела жир – вода они ориентируются таким образом, что гидрофобная циклическая
часть оказывается погруженной в жир, а гидрофильная боковая цепь – водную фазу,
в результате чего образуется стабильная эмульсия. Эмульгирование жиров
увеличивает поверхность раздела фаз. Липаза адсорбируется на поверхности
мицелл, где и происходит гидролиз жира.
Панкреатическая липаза поступает в кишечник в неактивной форме – в
форме пролипазы. Активация происходит при участии желчных кислот и еще одного
белка панкреатического сока – колипазы. Колипаза присоединяется к пролипазе в
молярном соотношении 2:1. Это приводит к тому, что липаза становится активной и
устойчивой к трипсину.
Активная липаза катализирует гидролиз эфирных связей в a- и a’- положениях, в результате образуется b-моноацилглицерол и высвобождаются две молекулы жирной
кислоты. В панкреатическом соке помимо липазы содержится моноглицеридная
изомераза – фермент, катализирующий внутримолекулярный перенос остатка жирной
кислоты из b- в a-положение. Таким образом, под действием липазы
гидролизуется последняя сложноэфирная связь. Жирные кислоты, моноацилглицеролы,
диацилглицеролы обладают эмульгирующим действием подобно желчным кислотам.
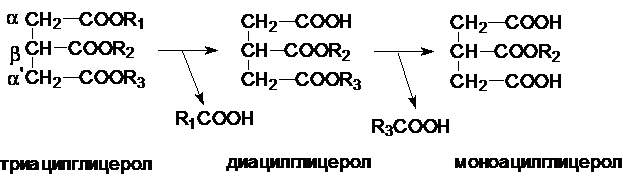
Катаболизм триацилглицеролов.
Путь катаболизма триацилглицеролов начинается с их гидролиза до жирных
кислот и глицерина под действием липазы; в основном этот процесс происходит в
жировой ткани. Высвободившиеся жирные кислоты поступают в плазму крови, где
связываются сывороточным альбумином. Затем свободные жирные кислоты переходят в
ткани и расходуются в разных направлениях (см. выше). Дальнейшая судьба глицерола
зависит от наличия в ткани активирующего фермента – глицеролкиназы, который
катализирует превращение глицерола в глицерол-3-фосфат, который может расходоваться
на синтез других липидов и вступать на путь гликолиза.
Биосинтез
триацилглицеролов (ТАГ).
В организме биосинтез ацилглицеролов не является процессом обратным катаболизму.
Перед их образованием глицерол и жирные кислоты должны быть активированы при
участии АТФ.
Образование
жиров из углеводов.
Часть углеводов, поступающая с пищей, превращается в организме в жиры,
особенно если количество углеводов превышает необходимое для возобновления запасов
в печени и мышцах. Глюкоза служит источником ацетил-КоА, из которого синтезируются
жирные кислоты. Необходимый для восстановительных реакций НАДФН, поставляется
за счет окисления глюкозы в пентозофосфатном пути, а также за счет
НАДФ-зависимых малатдегидрогеназной и изоцитратдегидрогеназной реакций. 3-Глицерофосфат
получается путем восстановления дигидроксиацетонфосфата – промежуточного продукта
гликолиза. Таким образом, из глюкозы образуется все, что необходимо для синтеза
жиров (схема 1).
Реакции синтеза ТАГ.
Синтез ТГА идет по следующей схеме:
на первой стадии под действием фермента глицерофосфат-ацил-трансферазы образуется
фосфатидная кислота
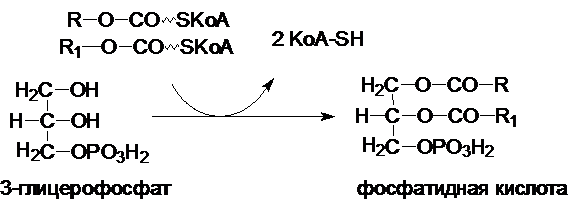
Фосфатидная кислота подвергается действию фосфатидат-фосфогидролазой с образованием диацилглицерола
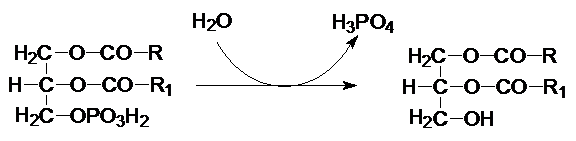
На диацилглицерол с помощью диацилглицерол-ацилтрансферазы
переносится третий ацильный остаток
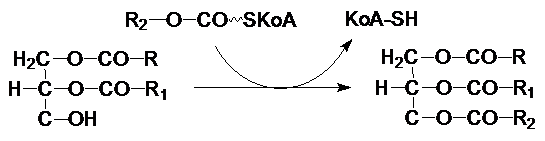
Синтез жиров из углеводов наиболее активно происходит в печени, менее
активно – в жировой ткани. Синтезируемые жиры накапливаются в виде жировых
включений в цитоплазме клеток.