Особенности
аналитического контроля металлов в почвах.
Металлы – ксенобиотики. Они являются главными по объёму загрязнителями,
сбрасываемыми в водоёмы.
Многие металлы чрезвычайно токсичны для
позвоночных в малых дозах (Hg, Pb, Cd, Tl), другие вызывают токсические эффекты в
больших дозах, хотя и являются микроэлементами (Zn,
Cu).
Считается, что если добыча данного элемента опережает
его перенос биогеохимическом цикле в 10 раз, то такой элемент должен
рассматриваться как загрязнитель.
В настоящее время по многим металлам эта норма перекрыта в 15-20 раз.
Металлы-токсиканты вездесущи. В различных формах они могут загрязнять
все три области биосферы – воздух, воду и почву.
Ртуть.
Hg
– один из лидеров “большой тройки” металлов (Hg,
Cd, Pb), представляющих наибольшую опасность
для людей и окружающей среды. В мире ежегодно производится 9000 т ртути, из них
5000 т впоследствии оказывается в океанах.
Источниками ртутных загрязнений
являются:
1)
производства,
связанные с обогащением руд (амальгамирование);
2)
прцессы электрохимического
получения хлора;
3)
ртутные
батареи, краски, пестициды, люминисцентные лампы
(одна лампа содержит 150 мг Hg и загрязняет
500 м3 воздуха);
4)
катализаторы
в ряде химических производств.
Токсические
свойства ртути.
1.
Воздействие
на нервную систему гидробионтов и млекопитающих. По пищевым цепям она
переносится к человеку, вызывая тяжёлые психические расстройства, врождённые
тератологические эффекты у детей.
2.
Зависимость
токсических свойств от формы соединения. Так, ряд токсичности
Hg2Cl2<HgCl2<CH3Hg+<(CH3)2Hg
обусловлен физическими
свойствами этих соединений. В частности, Hg2Cl2 – обладает более низкой
растворимостью по сравнению с HgCl2. В то же время Hg-органические соединения хорошо растворимы в жирах,
а Hg(CH3)2,
кроме того, летуче и легко впитывается кожей.
3.
Возможность
малотоксичных неорганических форм Hg превращаться биогенно в воде под действием микроорганизмов в
высокотоксичные металлоорганические формы.
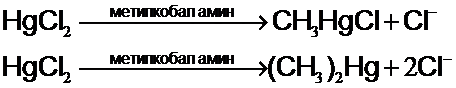
Такой процесс иногда называют метилированием ртути. Метильные
группы переносятся на ион Hg2+ от метилкобаламина – специфического кофермента бактерий.
Hg-органические пестициды (фунгициды). Используемые для протравки семян перед севом, могут биогенно превращаться в ещё более опасные соединения.
В настоящее время почти все препараты ртути запрещены к производству и использованию.
В США в одном озере, в которое фабрика
спускала сточные воды, содержавшие связанную в форме неорганических соединений
ртуть, эти ртутные соединения поглощались растениями (например, камышами),
восстанавливались и затем уходили в атмосферу в виде очень ядовитой
элементарной ртути в газообразном состоянии. Помимо прямого токсического
действия металлическая ртуть обладает свойствами, которые усиливают этот
токсический эффект: высокая упругость паров и диффундирующая способность.
Примером биотрансформации явилось событие в
Японии, получившее название “болезнь Минамата”. На
одной фабрике, расположенной у реки Минамата, использовалась
сулема в качестве катализатора синтеза винилхлорида. Японское “экономическое чудо
” было в своё время связано в значительной мере с полным отказом от какой-либо
очистки сточных вод. Стоки, содержащие ртуть, попадали в реку, а из реки – в
море, в бухту около городка Минамата. По пищевым
цепям ртуть переходила к рыбам, количество ртути в которых составляло5-20
мг/кг. Заболело много людей, из них более 200 умерло. После судебного процесса
фабрику закрыли, а вылов рыбы в акватории океана около Минамата
был запрещён. Но по настоящее время на дне океана лежит 600 тонн ртути, которая
постепенно превращается в токсичные ртутьорганические соединения.
4.
Hg – токсикант, характеризующийся биологическим накоплением. По
пищевым цепям от фито- и зоопланктона она переходит к рыбам. А затем к
человеку, где накапливается в жировых тканях (особенно в печени и почках).
5.
Высокое
время удерживания ртути в организме человека и животных, обусловленное
образованием её прочных комплексов.
Меры по
предотвращению ртутных загрязнений.
1.
Переход
на альтернативные процессы в металлургии. Организация замкнутого цикла в процессах,
использующих ртуть. Повышение надёжности герметизации оборудования в этих
процессах.
2.
Отказ
от использования Hg-органических
соединений в качестве пестицидов.
3.
Переход
на диафрагменный метод производства хлора.
4.
Замена
Hg-содержащих катализаторов менее токсичными формами.
Например, использование для этой цели солей или комплексов металлов Pt-группы.
5.
Сбор
и утилизация ртуть-содержащих
изделий.
6.
Разработка
альтернативных пигментов.
Свинец.
Источниками свинцовых загрязнений могут быть следующие процессы: процесс
окисления в свинцовых трубах
![]()
В щелочной среде образуются водорастворимые плюмбиты
![]()
При наличии в воде СО2
образуются гидрокарбонаты, также хорошо растворимые в воде
![]()
Ежегодное мировое потребление свинца
составляет 3 млн. тонн, из них 40 % идёт на производство аккумуляторных
батарей, 20 % - на получение тетраэтилсвинца и тетраметилсвинца
– самых эффективных из агнтидетонаторов, остальные –
в строительстве, для покрытия кабелей, изготовления средств радиационной защиты.
Токсические
свойства свинца.
Неорганические соединения Pb2+ нарушают обмен веществ и
являются ингибиторами ферментов, вызывая у детей умственную отсталость, заболевания
мозга. Механизм действия свинца на ферменты заключается в диффузии его катиона
через клеточную мембрану и взаимодействия в клетке с сульфгидрильными группами
белковых составляющих ферментов.
![]()
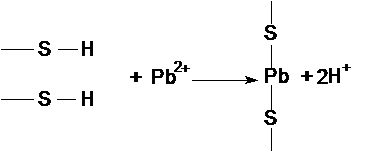
Pb может замещать
кальций в костях, становясь постоянным источником отравления. Органические
соединения свинца ещё более токсичны.
Меры по
предотвращению свинцовых загрязнений.
1.
Снижение
концентрации свинца в бензине или полный отказ от тетраэтилсвинца и тетраметилсвинца как антидетонаторов, разработка алтернативных антидетонаторов. Имеется положительный опыт
по использованию Mn-органических
соединений.
2.
Переход
на другие виды двигателей – дизельные, электромобили и др.
3.
Утилизация
Pb из батарей и
других Pb-содержащих
изделий.
4.
Замена
свинцовых пигментов более безопасными пигментами.
Кадмий.
Кадмий считается токсичней свинца и
отнесён Всемирной организацией здравоохранения (ВОЗ) к числу наиболее опасных для здоровья человека элементом.
Ежегодное производство кадмия в мире
составляет около 20 тыс. тонн. Несмотря на небольшой масштаб производства , он находит всё большее применение в гальванотехнике
(гальванопокрытия, которые получают по специальной технологии – кадмировании), в производстве полимеров – в качестве стабилизаторов
– солей жирных кислот, при получении пигментов (CdS, CdSe, CdO, CdCO3), аккумуляторов (Ag-Cd
и Ni-Cd)
и спец. сплавов.
В частности, сульфид кадмия и селенид
кадмия представляют собой термически устойчивые красители соответственно
жёлтого и красного цвета. Вместе с сульфатом бария (BaSO4)
они могут передавать любые оттенки от жёлтого до красного и поэтому применяются
в полиграфии, при производстве лаков, красок и резиновых изделий, а также для
окраски кожи. Оксид кадмия, CdO,
и карбонат кадмия, CdCO3, находят
применение для окраски стекла, эмали и глазури на керамике.
Никель-кадмиевые аккумуляторы и соответствующие батареи, составленные из них находят широкое
применение благодаря их высоким потребительским свойствам: высокой удельной
энергии, большим ресурсам работы, высокой скорости подзарядки и возможности
использования в широком температурном диапазоне. Наряду с применением в технике
для запуска авиационных двигателей (небольшая масса батарей) и в телефонных
системах, он широко используется населением для питания бытовой электроники. В
настоящее время нет какой-либо альтернативы Ni-Cd-аккумуляторам.
Источники
загрязнения кадмием.
1.
Эксплуатация
изделий, содержащих кадмий.
2.
Использование
фосфорных удобрений.
3.
Сжигание
полимеров.
4.
Удобрение
почвы иловыми отложениями рек из индустриальных районов.
5.
Сжигание
каменного угля (в 1 т каменного угля содержится 2 г Cd).
В организм человека Cd в основном попадает через пищевые цепи,
где постепенно накапливается.
В отличие от Pb и Hg
нет эффективных методов удаления кадмия из организма.
Токсичность.
Кадмий опасен в любой форме. Принятая
внутрь доза в 30-40 мг может оказаться смертельной. Самые ранние симптомы
отравления кадмием – поражение почек, нервной системы, позднее возникают
костные боли в спине и почечные боли. Типично также нарушение функций лёгких.
Кадмий оказывает также канцерогенное действие.
Ежегодно в окружающую среду попадает 5
тыс. т кадмия. В Балтийском море находится 200 т.
Известные до настоящего времени данные о
максимальной аккумуляции кадмия в пищевых продуктах относится к свиным почкам,
где находится до 2 мг/кг Cd.
Все без исключения яйца серых куропаток и фазанов из верхнего Эльзаса содержали
Cd, а более половины
ещё и Hg. Двустворчатые моллюски могут аккумулировать
кадмий, повышая его концентрацию в миллион раз по сравнению с его содержанием в
морской воде.
Однако больше всего кадмия мы получаем с
растительной пищей, поскольку Cd
чрезвычайно легко переходит из почвы в растения. Особую опасность в этом отношении
представляют грибы, которые могут накапливать кадмий в исключительно высоких
концентрациях. Так, например, в луговых шампиньонах было обнаружено до 6 мг/кг Cd.
Аккумуляция кадмия частично связана с
его замещающим действием на Zn (микроэлемент),
в результате чего происходит дезорганизация биохимических процессов в
организме. Во многом количество кадмия, попадающего в организм человека,
зависит не только от потребления им кадмий-содержащих
органических продуктов, но и в значительной степени от качества его диеты. В
частности. Даже весьма незначительный дефицит железа может заметно усилить
аккумуляцию Cd.
Согласно данным НИИ продуктов питания, в
Вене общее загрязнение пищи свинцом и ртутью в среднем на душу населения
заметно ниже предельных норм ВОЗ, тогда как в случае Cd оно составляя
2 мг, точно им соответствует. Около 40 % этого Cd приходится на чёрный хлеб.
Следует признать, что именно Cd, а не Hg
и Pb является самым
опасным тяжёлым металлом, особенно в связи с тем, что он через почву и корни
растений легко попадает в пищевые цепи.
У курильщиков содержание Cd в почках и печени почти удвоено по
сравнению с некурящими.
В растениеводстве повышение дозы
удобрений способствует аккумуляции кадмия. Поэтому в областях с интенсивным
сельским хозяйством отмечается высокое содержание Cd в почве.
Меры по предотвращению загрязнений и
последствий отравлений кадмием.
1.
Переход
тепловой энергетики, использующей угли в качестве теплоносителя, на
альтернативные виды топлива.
2.
Сбалансированное
использование удобрений. Увеличение доли органических удобрений.
3.
Отказ
от практики сжигания твёрдых отходов. Переход на экологически безопасные
способы переработки твёрдых отходов. Сортировка отходов. Паро-газовая конверсия органической составляющей
твёрдых отходов.
4.
Сортировка
отходов электрохимической промышленности. Регенерация отходов.
5.
Разработка
альтернативных видов пигментов.