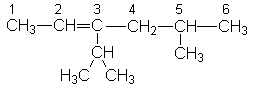
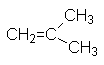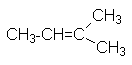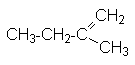Лекции
№11-13
АЛКЕНЫ
План.
Алкены
(олефины) - углеводороды, в молекулах которых содержится одна двойная
углерод-углеродная связь >C=C< между атомами углерода в sp2-состоянии,
а все остальные атомы углерода находятся в sp3 - состоянии.
Алкены образуют гомологический ряд соединений, состав которых выражается эмпирической формулой CnH2n.
Изомерия и номенклатура алкенов
Структурная изомерия алкенов начинается с четвертого члена ряда, однако, число структурных изомеров по сравнению с соответствующими алканами значительно больше. Это связано с тем, что структурная изомерия алкенов определяется дополнительным фактором: положением двойной связи углеродной цепи. У алкенов проявляется и другой вид изомерии - пространственная (геометрическая) или цис-транс-изомерия. Так как свободного вращения по двойной связи не происходит, определенные заместители могут фиксироваться по одной стороне двойной связи (цис-изомер), или по противоположным сторонам (транс-изомер):
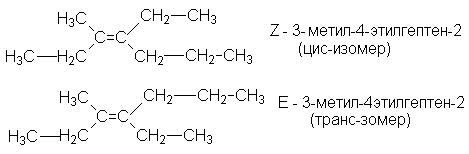
Наличие в молекулах алкенов третичных углеводородных атомов с четырьмя различными заместителями обусловливает их хиральность и, как следствие, наличие стереоизомеров.
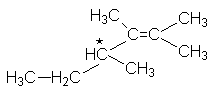
Название алкенов по номенклатуре IUPAC образуются из названий аналогично
построенных алканов заменой окончания "ан" на "ен" с
указанием цифрой местоположения двойной связи. В качестве родоначальной
структуры выбирается самая длинная углеродная цепь, содержащая двойную связь.
Нумерация атомов углерода в родоначальной структуре начинается с конца, к
которому ближе расположена двойная связь. Иногда употребляется тривиальные и
старые рациональные названия алкенов. Так, по рациональной номенклатуре алкены
рассматриваются как результат замещения атомов водорода в этилене на алкильные
группы.
|
Соединения |
Названия |
|||||
|
IUPAC |
рациональная |
тривиальная |
||||
|
СH2=СH2 |
этен |
этилен |
|
|||
|
CH3CH=CH2 |
пропен |
метилэтилен |
пропилен |
|||
|
CH2=CH-CH2
-CH3 |
1-бутен |
этилэтилен |
бутилен |
|||
|
CH3-CH=CH-CH3 |
2-бутен |
симм.
диметилэтилен |
псевдобутилен |
|||
|
|
2-метилпропен |
несимм.
диметилэтилен |
изобутилен |
|||
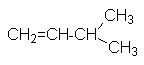
|
CH2=CH-CH2CH2CH3 |
1-пентен |
пропилэтилен |
амилен |
|||
|
CH3-CH=CH-CH2-CH3 |
2-пентен |
симм.
метилэтилен |
- |
|||
|
|
3-метил-2-бутен |
изопропилэтилен |
- |
|||
|
|
2-метил-2бутен |
триметилэтилен |
- |
|||
|
|
2-метил-1-бутен |
несимм.
метилэтилэтилен |
- |
|||
|
|
5-метил-3-изопропил-2-гексен |
- |
- |
|||
Названия остатков алкенов (алкенильных групп) образуют присоединением к названию алкена суффикса "ил". Некоторые остатки алкенов сохраняют тривиальные названия:

Для обозначения геометрических изомеров используется Z, E- номенклатура, согласно которой обозначения Z используется для цис-изомеров, а Е - для транс-изомеров. Обозначения Z и Е- выбираются по пространственному расположению самых старших групп. Старшинство углеводородных заместителей увеличивается в ряду:
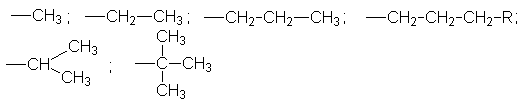
Чтобы отнести изомер к Z- или Е- ряду необходимо среди четырех заместителей у двойной связи найти два самых старших. Если оба старших заместителя расположены по одну сторону плоскости, в которой лежит двойная связь, изомер относится к Z-ряду, в противном случае к Е-ряду. (см. пример названий выше).
Методы получения алкенов
1. Дегидрирование и крекинг алканов.
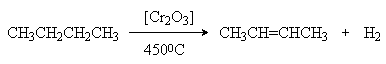
При более высоких температурах происходит также разрыв связей С-С и получаются смеси различных алканов и алкенов, у которых молекулярная масса меньше, чем у исходных алканов (крекинг).
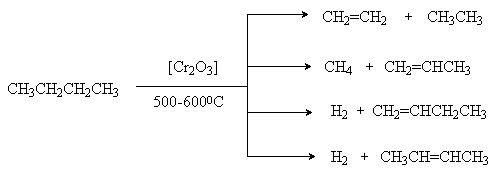
Эти методы имеют промышленное значение.
2. Дегидратация спиртов.
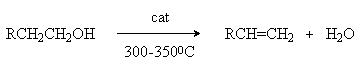
В качестве катализаторов используются Бренстедовские или Льюисовские кислоты, например H3PO4 и Al2O3. В первом случае фосфорную кислоту наносят на пористый носитель, например, силикагель.
Особенностью этих реакций является порядок отщепления воды, определяемый правилом Зайцева: при отщеплении воды наиболее легко отщепляется водород от соседнего наименее гидрированного атома углерода.
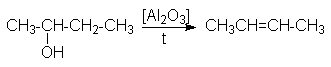
Такой характер отщепления может быть обоснован более высокой термодинамической стабильностью алкенов, у которых наибольшее число заместителей при двойной связи.
Реакции дегидратации имеют препаративное и промышленное значение. Так, в промышленности изобутилен получают дегидротацией изобутилового спирта.
3. Дегидрогалогенирование галогеналканов.
Эта реакция может осуществляться в двух вариантах:
а) щелочное дегидрогалогенирование
![]()
Порядок отщепления галогеноводорода в этих реакциях также определяется правилом Зайцева: при отщепление HHal наиболее легко отщепляется водород от наименее гидрированного атома углерода.
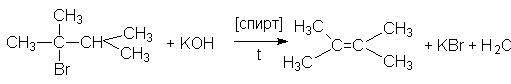
б) термическое дегидрогалогенирование в паровой фазе.
![]()
В отличие от щелочного дегидрогалогенирования эта реакция мало избирательна и при наличии нескольких неэквивалентных атомов водорода при вицинальном углеродном атоме образуется смесь алкенов.
Методы имеют препаративное и промышленное значение.
4. Отщепление галогенов от вицинальных дигалогеналканов металлическим цинком.
![]()
5. Селективное гидрирование диенов и алкинов.
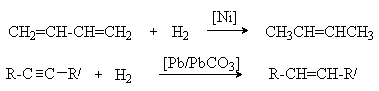
6. Реакция Виттига - взаимодействие карбонильных групп с фосфоний - илидами.
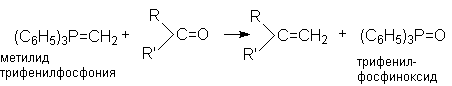
Сами фосфоний - илиды могут быть получены дегидрогалогенированием соответствующим галоидных солей фосфония под действия основания.
![]()
7. Реакция Гофмана - расщепление четвертичных аммониевых солей под действием оснований.
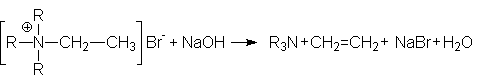
Характер образующихся продуктов определяется правилом Гофмана: при расщеплении образуется наименее замещенный алкен. Например:
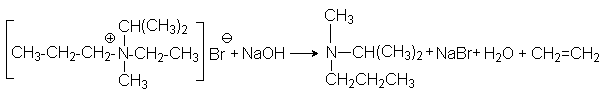
Обоснованием правила Гофмана является относительная кислотность атомов водорода при b -углеродных атомах: наименее кислыми являются атомы водорода при наиболее разветвленных углеродных атомах. Так как образующиеся при отрыве от них анионы существенно дестабилизированы алкильными группами, такое отщепление становится энергетически невыгодным.
Физические свойства алкенов
Алкены С2-С4- газы, следующие за ними члены гомологического ряда - бесцветные жидкости или кристаллические вещества.
Плотность алкенов выше по сравнению с алканами с тем же числом углеродных атомов. Это обусловлено более сильными межмолекулярными взаимодействиями в алкенах причиной которых являются высокая поляризуемость двойной связи: так RC-C=1,29 a RC=C=4,17.
Высокая поляризуемость двойной связи обусловливает ее значительное поляризацию под действием полярных групп.
![]()
Введение алкильных групп у двойной связи увеличивает стабильность молекул алкенов. Это можно проиллюстрировать различием в теплотах гидрирования соответствующих алкенов.
CH2=CH-CH2CH3 + H2 ® CH3CH2CH2CH3 + 127 кДж
транс- CH3-CH=CH-CH3
+ H2 ® CH3CH2CH2CH3
+ 115 кДж
Такое различие можно проиллюстрировать энергетической диаграммой.
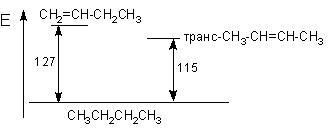
Можно видеть, что транс-псевдобутилену соответствует более низкий уровень энергии и, следовательно, более высокая стабильность.
Электронографическое изучение этилена показало, что геометрия молекулы резко отличается от пространственного строения алканов. Молекула этилена плоская. Углы между связями близки к 120о, связь С=С намного короче связи С-С. Потенциал ионизации в алкенах на 1-1,5 эв меньше, чем у соответствующих алканов, что свидетельствует об электронодонорных свойствах двойной связи.
Подвижность p -электронной системы отражается в электронных спектрах поглощения. Максимум поглощения находится в более длинноволновой области спектра (180-200 нм), чем у алканов. Это связано с переходом электронов со связывающей на разрыхляющую p -орбиталь p ® p *.
В колебательных спектрах кроме поглощения алкильных групп наблюдаются валентные колебания двойной связи при 1640-1660 см-1 и связи =С-Н при 3000-3100 см-1, а также деформационные колебания =С-Н - связи при 890-980 см-1. В спектрах ПМР характерны сигналы при 5,5-6 м.д., соответствующие протонам Н-С=.
Химические свойства
Химические свойства алкенов определяются рядом факторов: относительно слабой p -связью в двойной связи, ее поляризуемостью, электронодонорными свойствами, способностью к сопряжению с реакционным центром, возникающим при a -углеродном атоме.
Поэтому естественными реакциями алкенов являются реакции присоединения, среди которых наиболее представительными являются реакции электрофильного присоединения, а также реакции замещения, в которых подвижными являются атомы и группы при a -углеродном атоме по отношению к двойной связи.
1. Реакция гидрирования
Реакции
гидрирования алкенов являются иллюстрацией ненасыщенного характера алкенов в
силу отмеченной выше слабости p -связи. Последняя легко рвется под действием гидрирующего
агента и по освобождающимся валентностям присоединяются атомы водорода.
![]()
В качестве катализаторов используют Pd, Pt, Ni, нанесенные на пористые носители: g -AI2O3, SiO2, алюмосиликаты, активированный уголь.
Присоединение водорода происходит в цис-положение. Такой характер присоединения обусловлен геометрией активированного комплекса реакции гидрирования на поверхности катализатора:
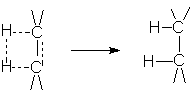
Экспериментальное подтверждение этого является образование цис-1,2-диметилциклогексана при гидрировании 1,2-диметилциклогексена
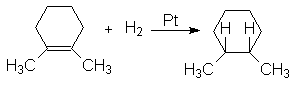
Гидрирование на металлических катализаторов часто осложняется изомеризацией алкенов и разрывом простых углерод-углеродных связей.
Более удобными в этом отношении являются катализаторы гомогенного гидрирования – комплексы хлоридов родия или рутения с трифенилфосфином (C6H5)3P (катализаторы Уилкинcона), например, хлорид трис-(трифенилфосфин)родия, получаемый при взаимодействии хлорида родия (III) с трифенилфосфином.
![]()
Легкость гидрирования в этих реакциях зависит от степени замещения при двойной
связи: чем больше степень замещения, тем медленнее гидририруется двойная связь.
Это открывает возможность селективного гидрирования соединений, содержащих
различные по степени замещенности двойные связи:
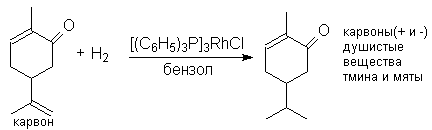
Можно видеть, что замещенная двойная связь и карбонильная группа не подвергаются гидированию.
Показано, что гомогенное гидрирование в присутствии указанных катализаторов происходит в цис-положение.
Недостаток катализаторов Уилкинсона – невозможность его использования для гидрирования соединений, содержащих альдегидную группу из-за осложнений основной реакции декарбонилированием
RCHO ® RH + CO
2. Реакции электрофильного присоединения по двойной связи алкенов.
а) Реакции галогенирования.
Алкены легко реагируют в обычных условиях с растворами CI2 или Br2 в инертном растворителе (например, CCI4) согласно стехиометрическому уравнению:
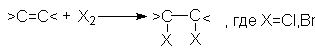
J2 в этих реакциях значительно менее активен.
Механизм реакций галогенирования может быть представлен последовательностью стадий (1) – (5), предполагающей образование p -комплексов между молекулами галогена и кратной связью алкена с последующим его переходом в s -комплекс (I) и (или) неклассический катион (II). Заключительными стадиями являются реакции (4) и (5), представляющие собой быструю нуклеофильную атаку интермедиатов I и II с образованием продукта галогенирования.
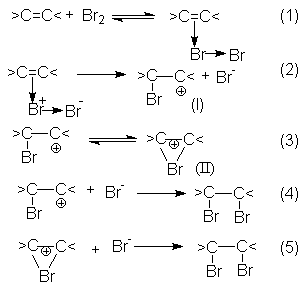
Скорость–определяющей стадией в этих реакциях является переход p - комплекса в s -комплекс.
Аргументами в пользу этого являются:
- кинетическое уравнение
реакций галогенирования двойных связей
r =
k[>C=C<][Br2]
- ускорение реакций
сильно сольватирующими растворителями
- ряд реакционной
способности алкенов в реакциях галогенирования:
(CH3)2C=CH2 > CH3-CH=CH2
> CH2=CH2
соответствующий ряду стабильности соответствующих s -комплексов:
![]()
В общем случае повышение реакционной способности алкенов обусловлено наличием при углеродных атомах кратных связей электронодонорных заместителей.
В то же время образование продуктов транс-присоединения, наблюдаемое при галогенировании циклоалкенов, может быть обосновано исключительным образованием неклассических циклических ионов (II), в которых атом галогена блокирует подход галогенид-аниона со стороны занятого им положения.
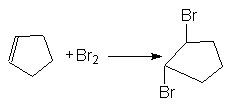
В этой связи следует предположить, что время жизни классических карбкатионов в таких реакциях слишком мало и они быстро изомеризуются в циклический катион по реакции (3).
В то же время если заместители при атомах углерода двойной связи существенно отличаются по своей электронодонорной способности, то образование открытого карбкатиона может стать энергетически более выгодным и реакция присоединения должна идти нестереоспецифично, поскольку открытый карбкатион равновероятно атакуется с противоположных сторон галогенид анионом. Такая ситуация реализуется при бромировании п-метоксипропенилбензола
СH3-O-C6H4CH=CH-CH3 + Br2 ® CH3O-C6H4CHBr-CHBr-CH3
когда образуется смесь энантиомеров.
Другим тестом на протекание реакции через классических катион является наличие побочной реакции полимеризации.
Таким образом, в зависимости от строения алкена реакция может идти как через классический, так и через мостиковый ион, причем симметрия последнего зависит от природы заместителей при двойной связи, и связь С…Hal в мостиковом катионе в меньшей степени связана с атомом, при котором существуют структурные возможности для делокализации положительного заряда. На заключительной стадии именно с этим атомом взаимодействует нуклеофил.
Ассимметриченое строение алкенов обусловливает характер образующихся продуктов в реакциях сопряженного присоединения, когда при проведении реакции галогенирования в реакционной массе присутствуют посторонние нуклеофильные агенты, например, другие галогениданионы, вода, спирты и т.д.
CH3CH=CH2
+ Br2 + Cl- ® CH3CHCl-CH2Br
+ Br- или
CH3CH=CH2
+ Br2 + NaCl ® CH3CHCl-CH2Br
+ NaBr
CH3CH=CH2
+ Cl2 + H2O ® CH3CHOH-CH2Cl
+ HCl
Последняя реакция, называемая хлоргидринированием, имеет промышленное значение для получения хлоргидринов.
Структура образующихся продуктов в приведенных примерах сопряженного присоединения обусловлено несимметричным строением иона хлорония, благодаря которому положительный заряд в большей степени локализован на центральном атоме углерода и поэтому последний является объектом нуклеофильной атаки.
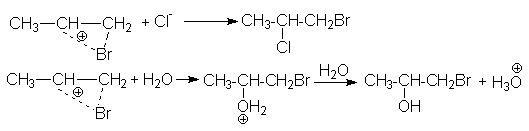
б) Взаимодействие с Н-электрофилами.
В качестве Н-электрофилов в этих реакциях могут выступать протонные кислоты, вода, сероводород, спирты, тиоспирты и др.
Присоединения Н-электрофилов к алкенам характеризуется стехиометрическим уравнением
R-CH=CH2 + HX ® R-CHX-CH3
В общем виде механизм этих реакций может быть проиллюстрирован последовательностью стадий:
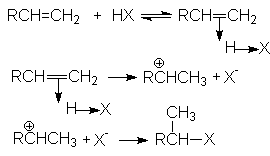
Скорость определяющей стадией этих реакций является образование s -комплеса (карбкатиона). Это согласуется с кинетическим уравнением присоединения Н-электрофилов к алкенам
r=k[>C=C<][HX]
Характер скорость-определяющей стадии дает обоснование реакционной способности реагентов в этой реакции
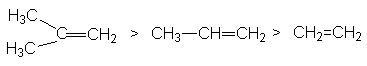
определяемой рядом стабильности карбкатионов
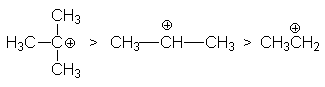
С другой стороны, ряд реакционной способности галогеноводородов
HI > HBr > HCl > HF
определяется кислотностью этих реагентов. Действительно, из рассмотрения скорость-определяющей стадии можно видеть, что при образовании s -комплексов реализуется кислотность этих реагентов.
В случае Н-электрофилов, обладающих слабой кислотностью (Н2О, ROH, RSH и др.) для эффективного осуществления реакций присоединения используется кислотный катализ и более жесткие условия реакций. Так, например, реакции гидратации алкенов, осуществляемые в промышленном масштабе (синтез этанола и изопропанола), проводит в паровой фазе при температура около 300оС, давлениях 5-7мПа в присутствии фосфорной кислоты на Al2O3 или другом носителе. Роль катализатора может выполнять g -Al2O3, содержащий протонные кислотные центры. Механизм этих реакций может быть проиллюстрирован на примере гидратации пропена
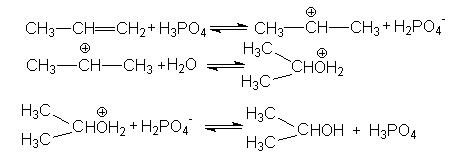
Суммирование левых и правых частей этих стадий приводит к стехиометрическому уравнению реакции гидратации
CH3CH=CH2
+ H2O ® CH3CH(OH)CH3
Основная реакция осложняется протеканием двух побочных реакций:
- полимеризации
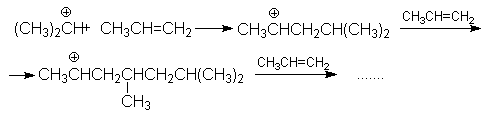
- образование простых эфиров
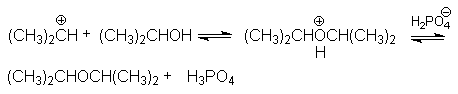
В кратком виде основную и побочные реакции можно представить системой конкурирующих реакций.
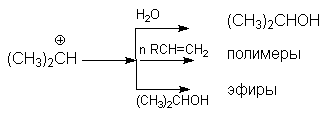
Из приведенной схемы видно, что факторами подавления побочных реакций являются: использование избытка водяного пара и снижение конверсии (концентрации спирта).
Порядок присоединения Н-электрофилов определяется правилом Марковникова, согласно которому водород Н-электрофила присоединяется к наиболее гидрированному атому. Причиной такого характера присоединения является большая энергетическая стабильность карбокатиона, образующегося при присоединении протона к более гидрированному углеродному атому двойной связи. Можно видеть, что дилемма образования карбокатионов в рассмотренном примере
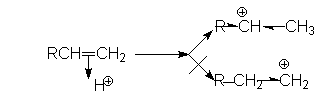
решается в пользу первого, стабилизированного индуктивным эффектом алкильных групп и эффектом снятия стерических напряжений. Соответственно, более предпочтительное образование карбокатиона R-CHÅ -CH3 обусловливает образование продукта R-CHX-CH3.
В связи с этим современная трактовка правила Марковникова формулируется
следующим образом: присоединение протона электрофила к алкену происходит в
направлении образования наиболее стабильного карбкатиона. Такая
формулировка объясняет, почему алкены, содержащие сильные электроноакцепторные
заместители присоединяют Н-электрофилы против правила Марковникова в его
классическом понимании.
|
CH2=CH-COOH
+ HBr |
® |
Br-CH2CH2-COOH |
|
акриловая
кислота |
|
b
-бромпропионовая кислота |
При взаимодействии акриловой кислоты с HBr можно представить два варианта присоединения протона.
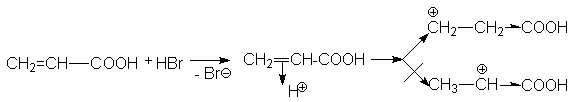
Можно видеть, что второй карбкатион существенно дестабилизирован
электроноакцепторной карбоксильной группой, поэтому его образование
энергетически невыгодно. Предпочтительным является образование
карбкатиона ![]() , который и дает продукт
присоединения Br-CH2CH2COOH.
, который и дает продукт
присоединения Br-CH2CH2COOH.
Обращение правила Мaрковникова имеет место и в случае свободнорадикального гидробромирования алкенов. Условием свободнорадикального процесса является использования инициаторов радикальных реакций, таких как пероксид водорода, органические гидропероксиды, пероксиды и др.
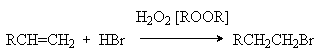
Характер образующегося продукта может быть обоснован в рамках свободнорадикального механизма гидробромирования.
H2O2 ® 2HO·
HO· + HBr ® H2O + Br·
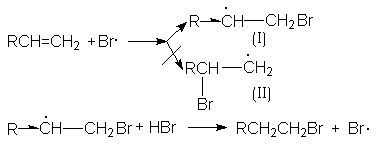
Можно видеть, что радикал I обладает большей стабильностью за счет действия двух эффектов: индуктивного и снятия стерических напряжений. Это обусловливает его предпочтительное образование и, что приводит к продукту присоединения против правила Мaрковникова.
3. Взаимодействие с катионами металлов.
Алкены образуют p -комплексы с катионами металлов, содержащих незаполненные орбитали, например:
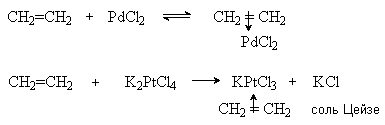
Образование таких комплексов объясняется донорноакцепторной взаимодействием, где алкен выступает в роли донора электрона, а ион металла в качестве акцептора. В результате такого взаимодействия изменяется характер С=С – связи в алкене; на атомах углерода двойной связи появляется положительный заряд, а сама связь разрыхляется, что создает предпосылки для ее разрыва. Эти реакции играют важную роль при катализе многих реакций алкенов, в которых комплексы солей металлов с алкенами выступают в качестве интермедиатов. Примерами таких реакций являются реакции оксосинтеза алкенов, катализируемые гидрокарбонилом HCo(CO)4, и окисление алкенов в карбонильные соединения при катализе хлоридом палладия PdCl2.
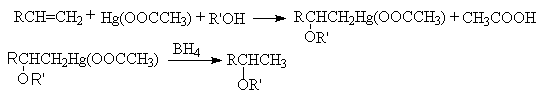
Особое место занимают реакции с солями ртути. В присутствии воды взаимодействие алкена с солью ртути (II) приводит к образованию продукта сопряженного присоединения – ртуть-органического соединения с гидроксильной группой (гидроксимеркурирование).
RCH=CH2 +
Hg(OOCCH3)2 + H2O ® R-CHOH-CH2HgOOC-CH3 + CH3COOH
Последующее восстановление полученного ртуть - органического соединения приводит к образованию спирта (дeмеркурирование)
![]()
В целом эта реакция называется гидроксимеркурированием. Она имеет синтетическое значение: последовательностью реакций гидроксимеркурирования – демеркурирования можно получить продукт гидратации по правилу Марковникова с минимумом побочных продуктов.
Аналогично осуществляют синтез простых эфиров последовательностью реакций алкоксимеркурирования – демеркурирования:
4. Гидроборирование алкенов.
При взаимодействии диборана или замещенных диборанов с алкенами образуются триалкилпроизводные бора
6RCH=CH2 + B2H6
® 2[RCH2CH2]3B
4RCH=CH2 + B2H4(C2H5)2
® 2(RCH2CH2)2B(C2H5)
Реакция представляет собой электрофильное присоединение BH3 или С2Н5 BH2 к двойной связи, причем электрофильным центром является атом бора со своей незаполненной орбиталью.
Полученные борорганические соединения являются важными промежуточными продуктами при синтезе соответствующих соединений. Так, их гидролитическое расщепление в присутствии кислот приводит к образованию соответствующих алканов.
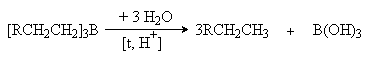
Обработка триалкилборана пероксидлом водорода при катализе основаниями приводит к образованию спиртов, причем конечным результатом является присоединение воды к алкену против правила Мaрковникова:
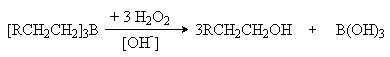
Таким образом открывается возможность синтеза первичных спиртов из a -алкенов.
Обе реакции высоко стереоспецифичны. Так, 1-метициклопентен при гидроборировании и последующей обработке реакционной массы щелочным раствором Н2О2 дает исключительно транс-2-метилциклопентанол. Гидроборирование и последующий кислотный гидролиз дают исключительно продукты цис-присоединения. Поскольку триалкилборан является продуктом цис-присоединения, превращение С-В связи в С-Н происходит с сохранением конфигурации, а гидроксилирование – с обращением конфигурации.
5. Взаимодействие с С-электрофилами.
Алкены присоединяют сильные С-электрофилы, к которым относятся карбкатионы, которые генерируются в реакционной смеси обычно в виде ионных пар:
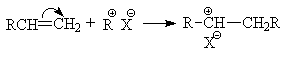
В результате образуется новый карбкатион, который может претерпевать дальнейшие превращения, например, присоединяться к следующей молекуле алкена. Многократное возобновление акта присоединения растущего карбкатиона к очередной молекуле алкена лежит в основе катионной полимеризации алкенов.
6. Реакции циклоприсоединения.
Алкены способны вступать в реакции, в которых образуется цикл. Такие реакции называются циклоприсоединением.
Эти реакции подразделяются в зависимости от числа атомов, участвующих в образовании цикла (цифры в квадратных скобках)
a) Циклоприсоединение [2+1].
К этому типу относятся реакции алкенов с карбенами.
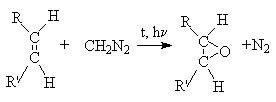
б) Циклоприсоединение [2+2].
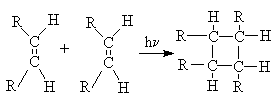
в) Циклоприсоединение [2+4].
7. Реакции окисления алкенов.
а) Окисление разбавленными растворами KMnO4 в слабощелочной среде (окисление по Вагнеру).
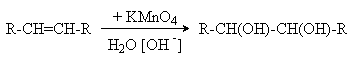
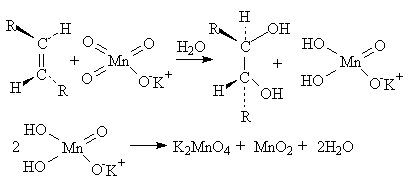
Эта реакция протекает стереоселективно как цис-присоединение двух гидроксильных групп:
б) Окисление концентрированными растворами окислителей.
(KMnO4, CrO3, HNO3)
При действии этих окислителей происходит разрыв молекулы алкена по месту двойной связи с образованием кетонов и кислот.
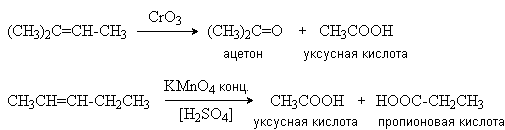
Эта реакция широко используется для определения строения алкенов.
в) Озонолиз.
Озонолиз представляет собой комбинацию последовательных реакций озонирования и гидролиза:
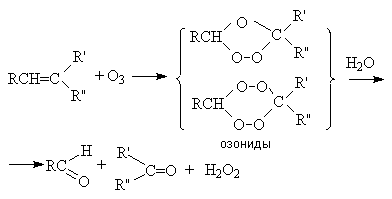
Озонолиз используют для установления строения алкена, так как его результаты является селективное расщепление молекулы алкена по месту двойной связи.
г) Окисление пероксикислотами и гидропероксидами (реакция Прилежаева).
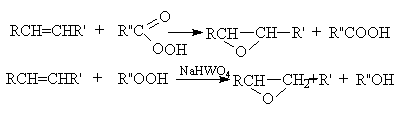
Результатом этих реакций является синтез эпоксидов, соединений, содержащих трехчленный оксидный цикл.
Промышленный вариант реакции эпоксидирования связан с каталитическим окислением этилена кислородом или воздухом на нанесенных серебряных катализаторах.
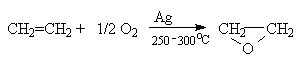
д) Окисление алкенов в присутствии PdCI2.
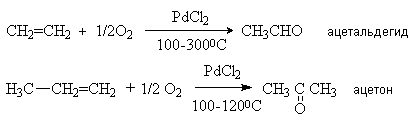
Этот метод реализован в промышленности для получения ацетальдегида. В настоящее время это наиболее прогрессивный способ получения ацетальдегида (Вакер-процесс). Промышленный катализатор представляет собой трехкомпонентную систему PdCl2-CuCl2-HCl. Каталитический цикл состоит из трех сопряженных реакций:
- окисления алкена
хлорида палладия
- CH2=CH2
+ PdCl2 + H2O ®
CH3CHO + Pd + 2HCl
- регенерации хлорида
палладия хлоридом меди (II)
Pd + 2CuCl2 ® PdCl2 + 2CuCl
- регенерации CuCI2
кислородом в присутствии соляной кислоты
2CuCl + 2HCl + 1/2O2 ® 2CuCl2 + H2O
Первая
стадия этого цикла протекает через образование p -комплекса PdCl2
с алкеном с последующим разложением комплекса водой:
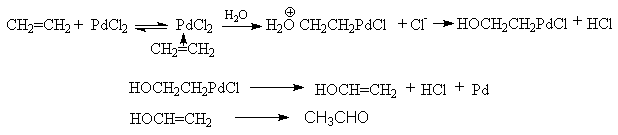
Замена в Вакер-процессе воды уксусной кислотой позволяет получать в промышленном масштабе винилацетат.
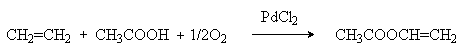
8. Реакции полимеризации.
а) Катионная полимеризация.
Выше отмечалось, что если в качестве нуклеофильного реагента по отношению к двойной связи выступает карбкатион, то это открывает возможность роста его цепи за счет многократно повторяющихся актов присоединения растущего карбкатиона к двойной связи. такой процесс называется катионной полимеризацией. Катионная полимеризация катализируется протонными кислотами, например, серной или органическими сульфокислотами. Механизм этой реакции может быть представлен на примере полимеризации изобутилена:
Инициирование:
![]()
Рост цепи:
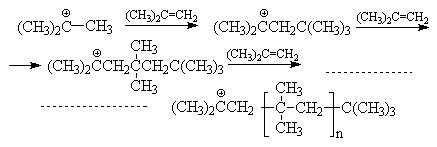
Обрыв цепи:
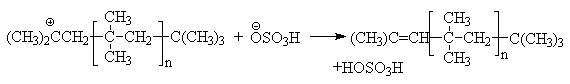
Можно видеть, что роль кислоты - катализатора заключается в генерировании исходных карбкатионов, выступающих в роли электрофильных агентов по отношению к двойной связи. Предпосылкой катионной полимеризации является разветвленная структура алкена, обусловливающая образование стабильных третичных карбкатионов.
б) радикальная полимеризация
В присутствии генераторов активных свободных радикалов алкены полимеризуются по свободнорадикальному механизму:
Инициирование:
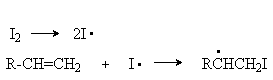
Развитие цепей:
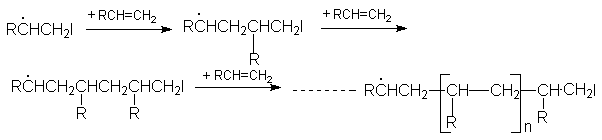
Обрыв цепей:
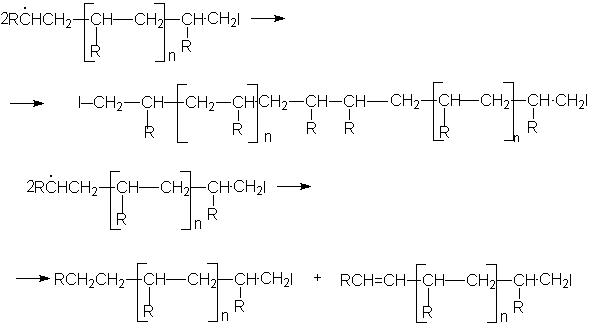
где в качестве инициатора выступают органические пероксиды, гидропероксиды , азобисизобутиронитрил.
Ряд реакционной способности алкенов в этих реакциях
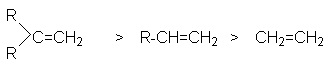
определяется стабильностью образующихся на стадиях развития цепей радикалов.
Поэтому полимеризация наиболее инертного этилена осуществляется в наиболее жестких условиях (200оС, давления до 150 мПа). В этих условиях инициирование осуществляется кислородом, который являясь бирадикалом обладает достаточной активностью при высоких температурах для генерирования радикальных активных центров, например:
![]()
в) стереорегулярная полимеризация
Этот вид полимеризации осуществляется на катализаторах Циглера-Натта, представляющие собой комбинации триалкилалюминия с TiCI4. Эта смесь образует активные титанорганические соединения, которые способны легко полимеризовать алкены до полиалкенов с высокой молекулярной массой:
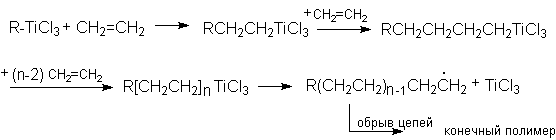
Полимеризация этилена на катализаторах Циглера-Натта осуществляется легко при умеренном давлении и дает плотный полиэтилен высокой молекулярной массы.
Особенности этих реакций - регулярное строение полимеров, обусловливающее их кристалличность, а следовательно, превосходные физико-механические характеристики. Такой характер полимеризации связан с тем, что очередная молекула алкена "встраиваясь" по связи Ti-C воспроизводит одну и ту же структуру, обусловленную геометрией этой связи и ее окружения.
9. Гидроформилирование или оксосинтез
Этим способом в промышленности получают альдегиды, которые затем перерабатывают в спирты
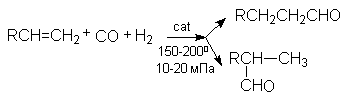
В качестве катализатора этой реакции используют комплексное соединение - гидрокарбонил кобальта HCo(Co)4.
Катализ предполагает внедрение алкена в качестве лиганда в координационную сферу гидрокарбонила
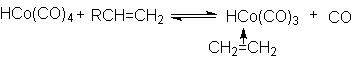
с последующим взаимодействием образующего p -комплекса с реагентами.
10. Радикальные реакции алкенов.
Выше уже упоминались радикальные реакции алкенов, такие как гидробромирование в присутствие пероксидов и радикальная полимеризация. Другими радикальными реакциями с участием алкенов являются:
а) теломеризация
Теломеризация – олигомеризация алкенов в присутствии веществ – передатчиков цепи (телогенов). В результате реакции образуется смесь олигомеров (теломеров), концевые группы которых представляют собой части телогена. Например, в реакции CCl4 с этиленом телогеном является CCl4.
CCl4 + nCH2=CH2 ® Cl(CH2CH2)nCCl3
Инициирование этих реакций может осуществляться радикальными инициаторами или g -излучением. Это обусловливает свободнорадикальный характер реакций теломеризации:
Инициирование:
![]()
Развитие цепей:
CH2=CH2 + · CCl3 ® · CH2CH2CCl3
· CH2CH2CCl3 + CH2=CH2
® · CH2CH2CH2CH2CCl3
Передача цепи:
· CH2CH2CH2CH2CCl3 + CCl4 ® · CCl3 + Cl-CH2CH2CH2CH2CCl3
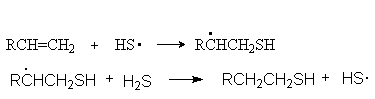
б) Присоединение H2S и RSH в присутствии инициаторов радикальных реакций.
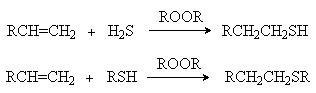
Можно видеть, что такое присоединение идет против правила Марковникова. Обоснование такого порядка присоединения такое же, как и в случае свободнорадикального гидробромирования алкенов. (см. выше)
Гидробромирование, тиогидратацию и другие подобные реакции алкенов следует проводить в условиях избытка аддента (т.е. вещества, присоединяющегося к алкену), чтобы подавить побочную реакцию полимеризации. Необходимость такого решения можно проиллюстрировать на примере реакций тиогидратации:
Инициирование:
I2 ® 2I·
I· + H2S ® HI + HS·
Развитие цепей (тиогидратация)
Развитие цепи (полимеризация)
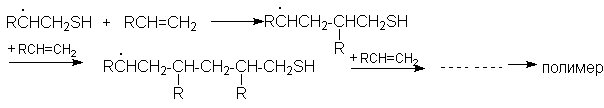
В кратком виде конкуренция реакций тиогидратации и полимеризации может быть представлена схемой:
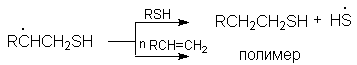
Из этой схемы очевидно вытекает необходимость применения избытка адденда для подавления побочной реакции полимеризации.
в) Галогенирование кратной связи.
Cl2 и Br2 могут присоединяться по двойной связи алкена по свободноразикальному механизму. Эти реакции протекают гораздо быстрее, чем реакции ионного галогенирования, но требуют химического или фотохимического инициирования.
Механизм этих реакций можно проиллюстрировать на примере бромирования:
Инициирование:
![]()
Развитие цепей:
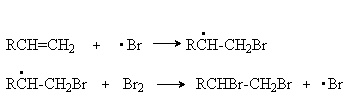
Обрыв цепей:
Br· + · Br ® Br2
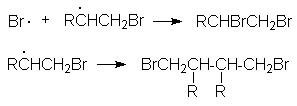
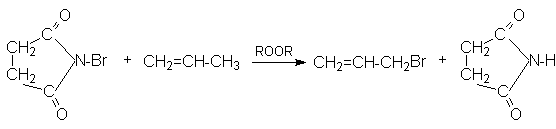
г) Аллильное замещение галогенами.
В условиях высоких температур (300-400оС) пропен и другие алкилзамещенные алкены хлорируются в паровой фазе в аллильное положение.
CH2=CH-CH3
+ Cl2 ® CH2=CH-CH2Cl
+ HCl
Такое направление хлорирования связано со стабильностью аллильного радикала, образующегося при реализации радикально-цепного процесса:
Инициирование:
Cl2 + M ® 2Cl· + M
Развитие цепей:
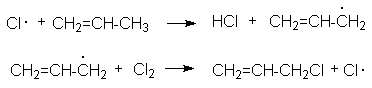
Обрыв цепей:
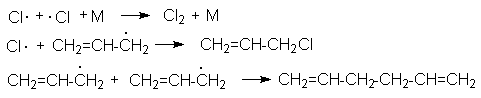
В то же время возможность присоединительного хлорирования путем реализации последовательности реакций
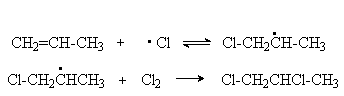
практически исключена, поскольку высоко-экзотермическое равновесие присоединения хлор-радикала к двойной связи в условиях высоких температур практичеки нацело смещено в левую строну.
Аллильное бромирование можно провести в лабораторных условиях, используя N-бромсукцинимид и инициатор свободнорадикальных реакций