Лекция
№14
АЛКАДИЕНЫ
План
- Типы алкадиенов.
- Номенклатура.
- Методы синтеза1,3-алкадиенов.
- Физические свойства
1,3-алкадиенов и их строение.
- Химические свойства
1,3-алкадиенов и их применение.
- Аллены.
Углеводороды
с открытой цепью, содержащие две двойные связи, называются алкадиенами. В зависимости от взаимного расположения двойных связей
различают следующие типы алкадиенов. Если двойные связи располагаются у одного
атома углерода, то они называются алкадиенами – 1,2 или алленами, например:
СН2=С=СН2 пропадиен–1,2, аллен
а расположенные таким образом двойные связи называются кумулированными.
Если между двумя двойными связями находится одна одинарная связь, то такие алкадиены называются алкадиенами-1,3 или сопряженными диенами, например,
СН2=СН–СН=СН2 бутадиен-1,3.
Алкадиены с изолированными связями - такие алкадиены, у которых две двойные связи разделены двумя или более одинарными углерод-углеродными связями.
При наименовании алкадиенов используют номенклатуру IUPАC и тривиальные названия. Согласно номенклатуре IUPАC, родоначальная структура представляет собой самую длинную углеродную цепь, содержащую обе двойные связи. Нумерация этой цепи начинается с конца, которому соответствует меньшая сумма локантов. Название диена производится от корня родоначальной структуры путем добавления к нему суффикса “диен” с указанием положения двойных связей в цепи, например 3,7–диметилоктадиен–2,5.
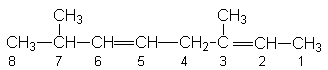
За рядом первых алкадиенов устойчиво сохраняются тривиальные названия:
СН2=СН–СН=СН2 дивинил
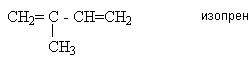
СН2=С=СН2 аллен
СН3СН=С=СН2 метилаллен
СН3–СН=СН–СН=СН2 пиперилен
Наиболее важными с научной и практических точек
зрения являются алкадиены–1,3. Поэтому им в данном разделе уделяется наибольшее
внимание.
Методы синтеза 1,3-алкадиенов
1. Дегидрирование алканов
а) дегидрирование бутан-бутеновой фракции
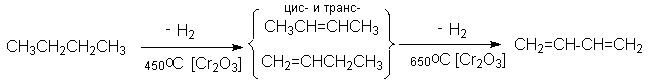
б) Дегидрирование изопентан-изопентеновой фракции
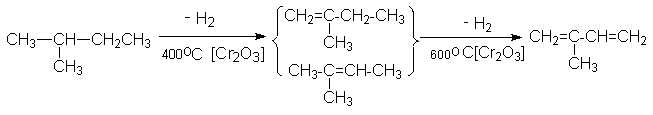
Рассмотренные методы имеют промышленное значение
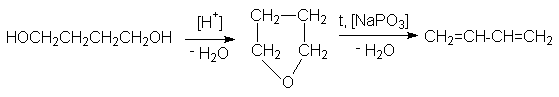
2. Дегидратация гликолей
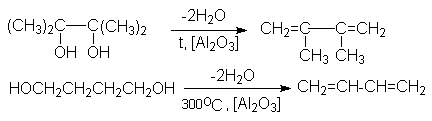
Дегидратация может быть осуществлена по методу Реппе
3. Дегидратация ненасыщенных спиртов
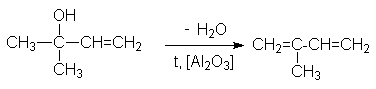
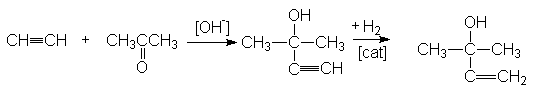
Исходный спирт может быть получен конденсацией карбонильных соединений с ацетиленом по методу Фаворского с последующим селективным гидрированием
4. Реакции сочетания винилгалогенидов
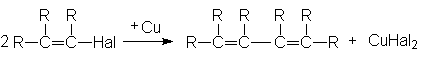
Винилгалогениды вступают также в реакцию сочетания под действием Cu2Cl2, Zn в присутствии NiCl2, н-бутиллития в присутствии MnCl2.
5. Димеризация ацетилена с последующим селективным гидрированием
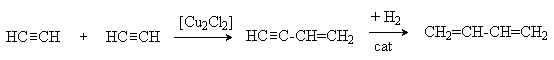
6. Метод C.В. Лебедева

Этот метод был первым процессом получения бутадиена-1,3, освоенным в промышленном масштабе. В настоящее время он вытесняется более прогрессивным методом дегидрирования бутан-бутеновой фракции.
7. Расщепление 4,4-диметил-1,3диоксана, который получают конденсацией изобутена и формальдегида:
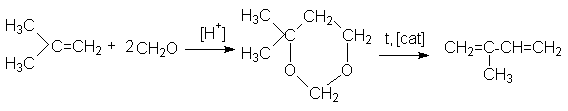
+ H2O + CH2O
Метод имеет ограниченное промышленное применение.
Физические свойства и строение алкадиенов–1,3
Алкадиены–1,3 являются бесцветными веществами. Первые члены гомологического ряда - газы или низкокипящие жидкости. Для алкадиенов –1,3 характерна повышенная молекулярная рефракция. В расчете на одну кратную связь она оказывается R(c=c) = 6,33, т.е. больше, чем у тройной связи. Это характерно для систем сопряженных связей.
Теплота гидрирования алкадиенов –1,3 на 13-16 кДж меньше, чем теплота гидрирования отдельных двойных связей. Это свидетельствует о большей стабильности сопряженных систем на величину энергии сопряжения.
Структурные исследования молекулы бутадиена–1,3 методом электронографии показывает, что все ее атомы лежат в одной плоскости. Наиболее энергетически выгодным и поэтому наиболее вероятным является расположение двойных связей в транс-конформации по отношению к одинарной связи. Длина связей С–С (0,146 нм) отличается от длины связи С=С в этилене (0,133 нм) и С–С в этане (0,154 нм). Эти данные являются дополнительным аргументом в пользу сопряжения двух p -связей в алкадиенах–1,3.
Важные выводы о строении сопряженной системы дают результаты квантово-химических расчетов.
В сопряженную систему бутадиена каждый углеродный атом отдает один p -электрон
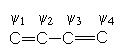
Молекулярные орбитали (МО) сопряженной системы получают линейной комбинацией атомных орбиталей (АО) y1, y2, y3, и y4:
y j = Cj1y 1 + Cj2y 2 + Cj3y 3 Cj4y 4
В результате решения волнового уравнения получают четыре МО (J=1,2,3,4),
каждый из которых соответствует свое значение Еj и выражено для Yj. Энергетические уровни Еj
представлены ниже. Для сравнения здесь же даны энергетические уровни для МО
этилена
|
бутадиен-1,3 |
этилен |
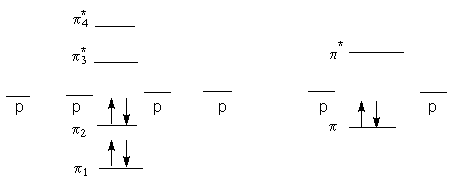
Можно видеть, что четыре p -электрона молекулы бутадиена размещаются на двух заполненных МО, а две остальные остаются незаполненными.
Первая МО (Y1) полностью делокализована и охватывает все четыре углеродных атома
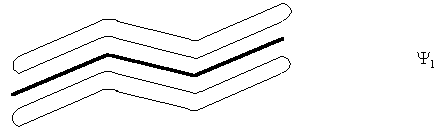
Вторая МО (Y2) имеет узловую плоскость между вторым и третьим углеродным атомом. Она участвует в образовании связей между С1 и С2, С3 и С4. Y 2 является высшей заполненной МО (ВЗМО).
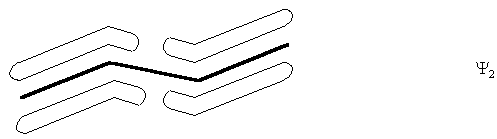
Третья МО (Y3) является низшей свободной МО (НСМО). Она имеет два узловые плоскости
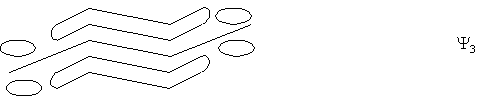
Четвертая МО (Y4) имеет три узловые плоскости

ВЗМО и НСМО называются фронтальными орбиталями: они определяют реакционную способность сопряженной системы. Энергия ВЗМО по абсолютной величине соответствует ионизации орбиталей и определяет электронодонорные свойства и, соответственно, из способность к взаимодействию с электрофильными реагентами.
Более высокий энергетический уровень этой орбитали по сравнению с энергией связывающей p -орбитали этилена обусловливает более высокую реакционную способность бутадиена в реакциях электрофильного присоединения.
Энергия НСМО определяет сродство к электрону, т.е. электроноакцептоные свойства, их способность к взаимодействию с нуклеофильными реагентами. Более низкий энергетический уровень орбитали по сравнению с энергией разрыхляющей p -орбитали этилена обусловливает более высокую реакционную способность бутадиена в нуклеофильных реакциях.
В молекуле бутадиена наибольшие электронные плотности во фронтальных орбиталях находятся на концевых атомах углерода. Это означает, что атака как электрофильных, так и нуклеофильных реагентов начинается с концевых (С1 и С4) атомов углерода.
Порядок p -связей свидетельствует, что для бутадиена характерны значительно выравненные (делокализованные) связи. Это подтверждается их длиной.
Энергия возбуждения p -связей в сопряженных диенах D Е=ЕВЗСМО – ЕНСМО. Сравнение с этиленом показывает, что для сопряженных систем D Е меньше, чем для несопряженных, поэтому УФ-поглощения наблюдается при больших длинах волн – СН2= СН2 – 180-200 нм; СН2=СН–СН= СН2 – 217-220 нм.
Химические свойства алкадиенов–1,3
Характерными реакциями всех алкадиенов являются реакции присоединения. Наиболее важными среди них являются:
1. Реакции гидрирования.
Эти реакции имеют ступенчатый характер. Варьируя соотношение реагентов, может получать либо алкен, либо алкан в соответствии со схемой
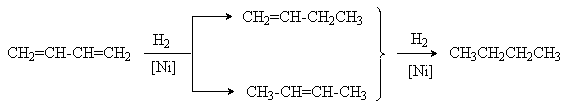
Катализаторами этих реакций являются Ni, Pt, Pd. Особенностью этих реакций является конкуренция 1,4– и 1,2–присоединения. Это связано с наличием двух реакционных центров у поверхностного интермедиата, образующегося в результате реализации механизма реакции
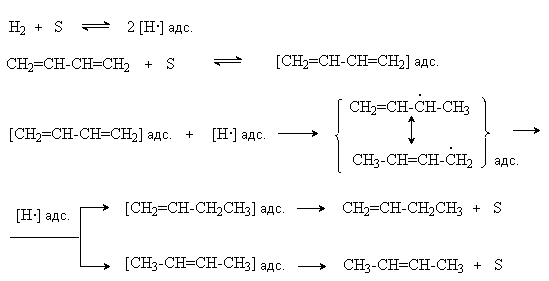
где S – свободная поверхность катализатора.
2. Реакции электрофильного присоединения
а) Галогенирование
При реализации этой реакции образуется смесь продуктов 1,2– и 1,4–присоединения, например:
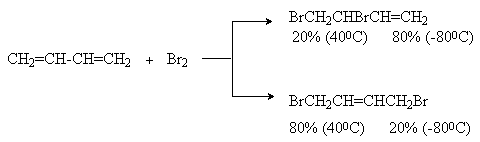
Образование продуктов конкурирующего галогенирования объясняется следующим механизмом:
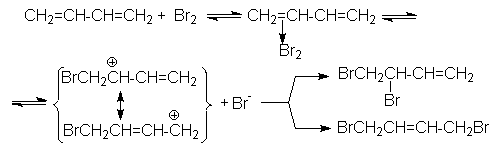
Можно видеть, что промежуточный карбкатион имеет два реакционных центра, что и обусловливает образование продуктов конкурентного галогенирования.
При углублении реакции образуются продукты исчерпывающего галогенирования:
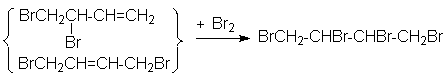
Изменение состава продуктов первичного галогенирования при изменении температуры обусловлено изменением характера факторов, определяющих соотношение продуктов. Так, в области высоких температур конкурирующие реакции быстро достигают положения равновесия, и состав продуктов будет определяться соотношением их равновесных концентраций. Таким образом, в области высоких температур осуществляется термодинамический контроль состава продуктов. В области низких температур из-за высокой экзотермичности каждой из конкурирующих реакций их равновесия существенно смещены в сторону продуктов, а скорости их слишком малы, чтобы заметно приблизиться к состоянию равновесия. Поэтому обе реакции протекают в условиях практической необратимости, когда состав продуктов определяется соотношением их скоростей. Это область кинетического контроля состава продуктов.
Энергетический профиль реакции бромид-аниона с промежуточным карбкатионом иллюстрирует факторы, управляющие такого рода процессами.
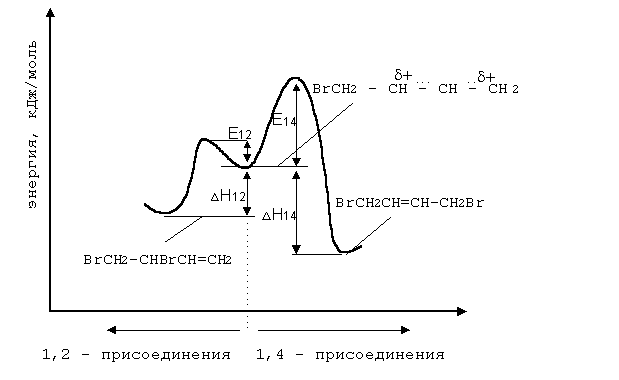
Можно видеть, что образование продукта 1,4–присоединения термодинамические более выгодно, т.к. теплота D Н1,4 – более электроотрицательна, чем D Н1,2. Поэтому в области термодинамического контроля предпочтительно образуется продукт 1,4–присоединения. В то же время энергетический барьер образования продукта 1,2–присоединения (Е1,2) ниже, чем энергетический барьер образования продукта 1,4–присоединения (Е1,4). Поскольку система легче преодолевает более низкий барьер, то в области кинетического контроля преобладающим будет продукт 1,2–присоединения.
В целом вероятность термодинамического контроля возрастает с ростом температуры и времени реакции. Наоборот, вероятность кинетического контроля тем больше, чем ниже температура и время реакции.
б) Реакции гидрогалогенирования.
При реализации этих реакций образуются продукты конкурентного галогенирования:
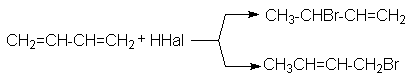
Механизм образования продуктов может быть представлен следующими стадиями:
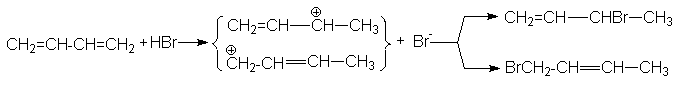
В области высоких температур состав продуктов определяется термодинамическим контролем и доминирующим продуктом является продукт 1,4–присоединения. В области низких температур состав продуктов определяется кинетическим контролем и основным продуктом является продукт 1,2–присоединения. Таким образом наблюдается полная аналогия между реакциями галогенирования и гидрогалогенирования 1,3-алкадиенов.
в) Полимеризация
Стехиометрически полимеризация сопряженных алкадиенов описывается следующими уравнениями
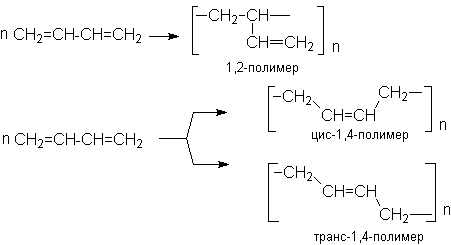
Полимеризация сопряженных алкадиенов имеет важное практическое значение для синтеза каучуков. Реакция может осуществляться по свободнорадикальному, карбанионному и карбкатионному механизмам в зависимости от типа инициирующей системы. В промышленной практике наиболее широко реализуется стереорегулярная полимеризация под действием катализаторов Циглера-Натта.
Механизм радикальной полимеризации может быть представлен на примере 1,4–присоединения.
Инициирование
I2 ® 2I·
Развитие цепей
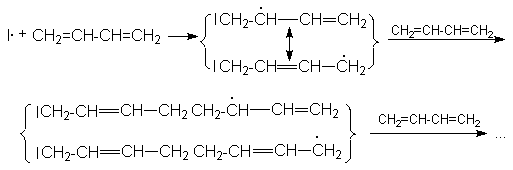
Таким образом, в результате актов многократного присоединения растущего радикала к алкадиену происходит рост цепи будущего полимера. Обрыв цепей осуществляется рекомбинацией или диспропорционированием макрорадикалов. Можно видеть, что растущие радикалы обладают двойственной реакционной способностью, что открывает возможность образования 1,4– и 1,2–полимера. Обычно при свободнорадикальной полимеризации доминирующим является 1,4–полимер с примесью 1,2–полимера, причем первый в основном состоит из транс-изомера. В качестве инициаторов этих реакций используют пероксиды или азобисизобутиронитрил.
В присутствии металлического натрия осуществляется полимеризация по анион-радикальному механизму:
![]()
Обозначая ![]()
можно представить последующий путь полимеризации совокупностью стадий:
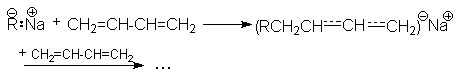
Полимеризация обычно протекает на поверхности металла, поэтому из-за стерических требований к реакции преимущественно образуется 1,2–полимер.
Полимеризация по Циглеру-Натта приводит к образованию стереорегулярного каучука, причем в основном образуются цис-полиалкадиены.
Натуральный каучук представляет собой эластичную при низких температурах, пластичную и клейкую при более высоких температурах массу, которую получают при нагревании млечного сока растений – каучуконосов, таких как гевея. Первое практическое применение натурального каучука нашел Макинтош (1823) – при пропитывании тканей раствором каучука он получил водонепроницаемый материал. Наибольшее значение для широкого использования каучука имело открытие Гудьира (1839). Он обнаружил, что при обработке каучука серой или серосодержащими соединениями получается материал с превосходными механическими свойствами. Так была впервые получена резина. Сера, реагируя по аллильному водороду и двойной связи образует мостики, связывающие между собой полимерные цепи.
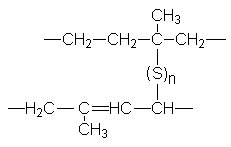
Этот процесс называется вулканизацией. При исследовании строения натурального каучука было показано, что он является полимером изопрена. Позже на основе рентгеноструктурного анализа было установлено, что натуральный каучук имеет строение цис-полиизопрена. В природе встречается также транс-полиизопрен, называемый гуттаперчей, который является твердым хрупким материалом и поэтому не находит широкого практического применения.
В СССР впервые синтетический каучук был получен на основе бутадиена–1,3 при катализе Na или K (1932) – метод С.В. Лебедева.
Промышленная партия стереорегулярного полиизопрена была выпущена у нас в стране в 1963 – так называемый каучук СКИ-3. По своим свойствам этот каучук не уступает натуральному.
В 1956 году под руководством советского химика Долгоплоска был разработан метод стереорегулярной полимеризации 1,3–бутадиена и получения на его основе цис-полибутадиенового каучука (дивинилкаучук, СКД). По эластичности СКД не уступает СКИ-3, но превосходит его в устойчивости при низких температурах и износостойкости.
Спектр практического использования каучуков существенно расширен за счет синтеза сополимеров бутадиена со стиролом, бутадиена с акрилонитрилом и др.
3. Реакции диенового синтеза
Алкадиены–1,3 могут присоединяться к двойной (или тройной) связи с образованием циклического продукта (циклоприсоединение [2+4]).
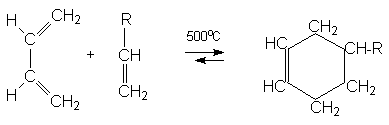
Такие реакции называются диеновым синтезом или реакцией Дильса-Альдера. Соединения, содержащие двойную или тройную связь и вступающие с 1,3–алкадиенами в реакцию диенового синтеза называются диенофилами. Реакционная способность диенофилов увеличивается при активировании их кратной связи электроноакцепторными группами.
В реакции Дильса-Альдера происходит исчезновение трех старых p -связей и появление новых: одной p -связи и двух s -связей. Поскольку прочность s -связей существенно выше, чем прочность p -связей, реакция Дильса-Альдера экзотермична. Это обусловливает ее обратимость при высоких температурах.
Условием успешного протекания реакции является такая геометрия реагентов, при которой оба конца диена ориентированы на углеродные атомы кратной связи диенофила. При этом происходит согласованный процесс образования новых и разрыва старых связей с синхронным перемещением всех p -электронов циклической системы
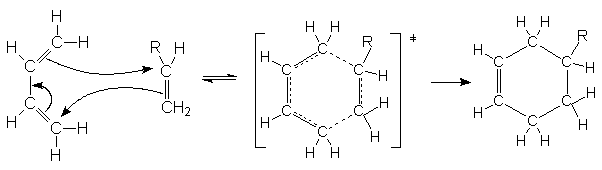
Поскольку диен может реагировать в s-цисоидной конформации, реакции некоторых диенов являются стерически запрещенными. Примером таких диенов являются приведенные ниже структуры
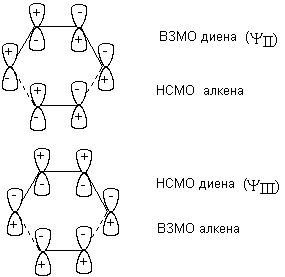
С точки зрения молекулярно-орбитального рассмотрения циклоприсоединение является согласованным, разрешенным по симметрии процессом. Из нижеприведенной молекулярно-орбитальной картины можно видеть, что симметрия ВЗМО бутадиена и НСМО этилена, а также ВЗМО этилена и НСМО бутадиена одинакова. В результате энергия возмущения велика и реакция циклизации может протекать как согласованный процесс.
Реакция Дильса-Альдера высокостереоспецифична, что проявляется в сохранении конфигурации диена и диенофила в продукте циклизации. Это наглядно видно на примере цис– и транс–дизамещенных алкенов, используемых в качестве диенофилов:
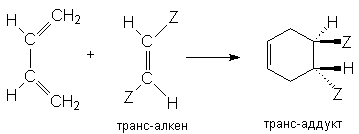
Области применения диенового синтеза
Реакция Дильса-Альдера находит широкое применение для синтеза сложных соединений. Это можно проиллюстрировать рядом реакций:
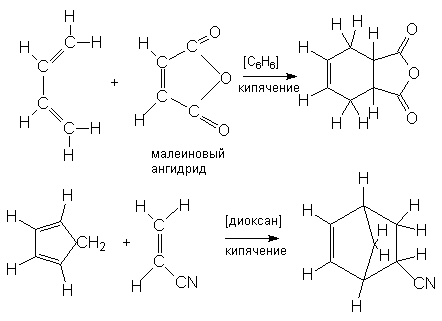
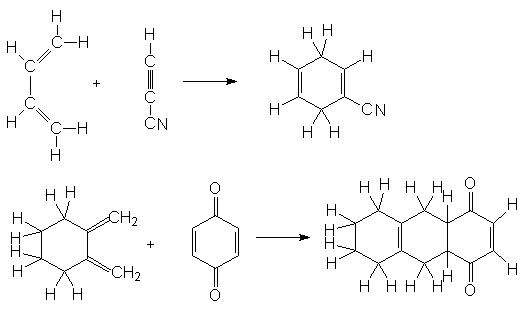
Как правило наиболее реакционноспособными диенофилами являются алкены, у которых двойная связь сопряжена с электроноакцепторными группами. К числу наиболее известных диенофилов относятся следующие соединения
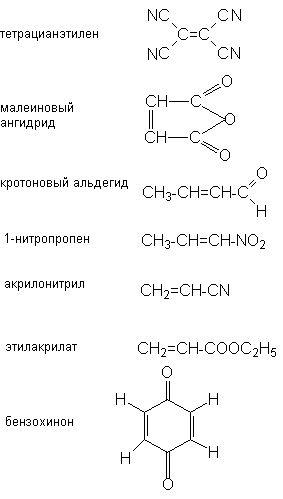
Поскольку комплементарная электронная природа обоих реагентов является главным условием протекания реакции циклоприсоединения, то наиболее реакционноспособными диенами в реакциях с перечисленными диенофилами являются диены, содержащие при двойных связях электронодонорные группы.
Способы получения
- Дегалогенирование вицинальных дигалогеналкенов цинком
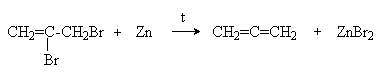
- Изомеризация алкинов
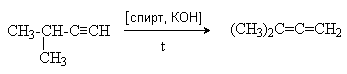
Физические свойства и структура алленов
Аллены – бесцветные газы (С3, С4) или жидкости со слабым запахом.
Углеродные атомы в молекуле аллена находятся в различных состояниях гибридизации: средний атом углерода – в sp–состоянии, два кратных – в sp2–состоянии. Поэтому p -связи, образуемые этими атомами с центральным находятся во взаимно перпендикулярных плоскостях
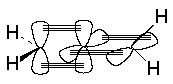
Благодаря такому строению все три атома углерода находятся на одной прямой, а заместители при крайних атомах углерода находятся во взаимно перпендикулярных плоскостях. В случае двузамещенных алленов для них возможны стереоизомеры.
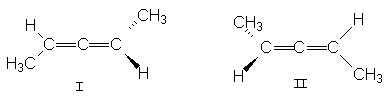
Можно видеть, что структура II является зеркальным отражением структуры I.
Реакции алленов
Аллены активны в различных реакциях, особенно в реакциях присоединения и полимеризации, однако они более реакционноспособны, чем алкены из-за напряжения, связанного с наличием двух двойных связей при центральном углеродном атоме. Наиболее типичными реакциями алленов являются:
1. Каталитическое гидрирование
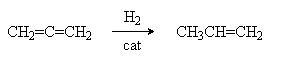
Cat: Ni, Pt, Pd
2. Изомеризация
![]()
3. Циклизация
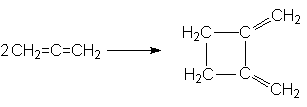
4. Реакции электрофильного присоединения
В этих реакциях центром электрофильной атаки является один из крайних атомов углерода
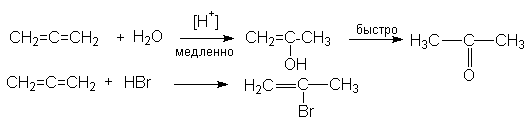
5. Реакции карбонилирования
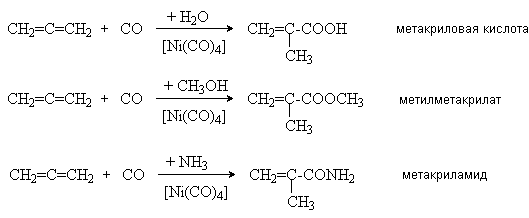
Получаемые при этом продукты используются в качестве мономеров при получении химических волокон и пластмасс.
Алкадиены с изолированными связями
Для алкадиенов этого типа характерны те же свойства, что и для алкенов, поскольку взаимное влияние двойных связей на расстоянии, более чем две С–С-связи пренебрежимо на фоне влияния ближнего структурного окружения двойной связи.