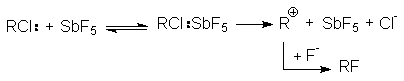Лекции №21-22
Закономерности реакций нуклеофильного замещения
План.
- Механизм реакций. Катализ.
Соотношение между механизмами SN1 и SN2.
- Влияние
строения реагентов на реакции нуклеофильного замещения.
- Конкуренция
реакций нуклеофильного замещения. Правило
Корнблюма.
Реакции некаталитического нуклеофильного замещения могут протекать в
зависимости от условий, характера реакционной среды, структуры субстрата и
природы нуклеофильного реагента по одностадийному или двухстадийному
механизмам.
Одностадийный процесс представляет собой
элементарную реакцию SN2-замещения, где индекс 2 указывает на
бимолекулярность реакции: 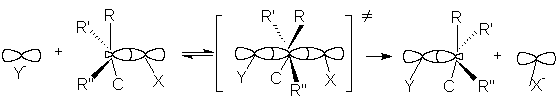
или более схематично
![]()
Можно видеть, что нуклеофил своей неподеленной парой электронов атакует углеродный атом в молекуле субстрата со стороны, противоположной замещаемой группе. При образовании активированного комплекса атакуемый атом углерода переходит из sp3-состояния в sp2-состояние. В результате углеродный атом оказывается в одной плоскости с группами R, R’ и R”, а нуклеофил и замещаемая группа связываются с ним за счет его р-орбитали. Распад активированного комплекса в продукт реакции сопровождается обратным переходом углеродного атома в sp3-состояние и обращением конфигурации исходного соединения, которое вызвано присоединением группы Y со стороны, противоположной разорвавшейся связи С-Х. Поэтому если объектом бимолекулярного нуклеофильного замещения является хиральный атом углерода, то в результате реакции происходит обращение оптической активности соединения. Скорость бимолекулярной реакции SN2 выражается уравнением
r = k[RX][Y-] (1)
При двухстадийном нуклеофильном замещении разрыв связи С-Х и образование связи С-Y происходит не одновременно. Первая элементарная стадия этой реакции - мономолекулярный гетеролитический разрыв связи С-Х с образованием карбкатиона
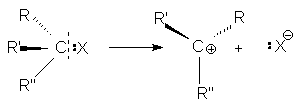
При этом центральный атом углерода переходит в состояние sp2-гибридизации и карбкатион приобретает плоское строение. Поэтому он с равной вероятностью атакуется нуклеофилом как со стороны отщепившейся группы, так и с противоположной стороны.
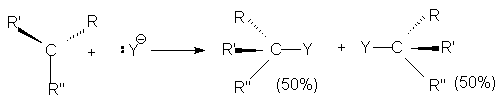
Поэтому, если объектом нуклеофильной атаки является хиральный атом углерода, то в результате реакции оптически активного субстрата образуется рацемическая смесь.
Первая стадия - мономолекулярная стадия гетеролиза - является скорость-определяющей. В связи с этим двухстадийный процесс нуклеофильного замещения обозначают символом SN1, где цифра 1 означает мономолекулярность скорость-определяющей стадии.
Скорость реакций SN1 в соответствии с характером скорость-определяющей стадии выражается уравнением
r = k[RX] (2)
В действительности механизм рассматриваемых реакций нуклеофильного замещения является более сложным.
В настоящее время общепринято, что разрыв связи С-Х существенно облегчается или вообще становится возможным лишь за счет взаимодействия замещаемой группы Х с электрофилами. Образование донорно-акцепторной связи I или водородной связи II
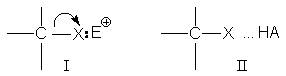
ведет к предварительной поляризации связи С-Х и облегчает ее последующий разрыв. Замещение некоторых групп (-OH, -OR, -SH, -SR, -NH2, -NHR, - NR2) вообще невозможно без их сильного взаимодействия с электрофилами. Например, замещение гидроксильной группы спирта при действии только бромид-аниона невозможно, но эту же реакцию легко осуществить в кислой среде. Предварительное протонирование гидроксильной группы меняет ее характер: в качестве уходящей группы выступает стабильная молекула воды, что делает энергетически выгодным гетеролиз связи С-ОН и облегчает атаку аниона брома
![]()
Аналогичным образом осуществляется
превращение простых эфиров, меркантанов и аминов.
Кроме сильных протонных кислот (НСl, H2SO4)
катализаторами реакций нуклеофильного замещения являются кислота Льюиса (Ag+,
Hg2+, HgCl, HgCl2, SnCl4, AlCl3,
SbCl5, Cu2Cl2, BF3 и др.). Их
действие зависит от природы отщепляемой группы. Например, протонные кислоты
существенно ускоряют замещение О-, S- и N-содержащих групп и мало влияют на
скорость замещения галогенов, поскольку последние являются слабыми основаниями
и плохо протонируются. Атомы галогенов дают, однако, прочные
донорно-акцепторные комплексы с некоторыми кислотами Льюиса, и их образование
облегчает разрыв связи С-Hal при последующей реакции замещения. Так,
аллилхлорид медленно гидролизуется водой, но в присутствии хлорида меди (I)
легко дает аллиловый спирт
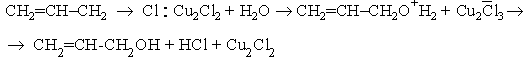
При этом может произойти изменение механизма SN2 в некаталитической реакции на SN1 - в каталитической:
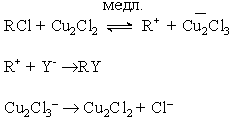
Ослабление связи С-Х и уменьшение энергии переходного состояния в реакциях нуклеофильного замещения происходит и при образовании водородных связей между уходящей группой и протонодонорным агентом.
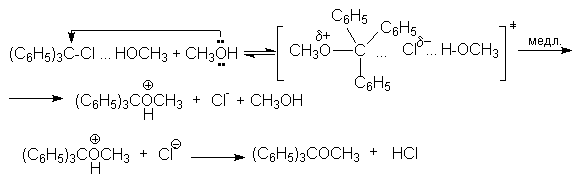
Так, скорость реакции метанолиза трифенилхлорметана
(C6H5)3CCl + CH3OH ® (C6H5)3COCH3 + HCl
описывается кинетическим уравнение третьего порядка:
r = k[(C6H5)CCl][CH3OH]2
Это согласуется с механизмом, согласно которому замещение хлора происходит только при условии его специфической сольватации другой молекулой спирта:
![]()
Образующийся ассоциат дает далее продукт замещения под действием второй молекулы нуклеофила - спирта
Противоположный эффект наблюдается при специфической сольватации нуклеофила, поскольку в результате образования водородных связей основность последнего утрачивается, что понижает его нуклеофильное сродство к положительно заряженному реакционному центру. При этом отрицательно заряженные нуклеофилы сольватируются сильнее нейтральных молекул или групп. Так, например, в реакции
CH3J + Br– ® CH3Br + J–
преобладающее влияние имеет сольватация бромид-атома, а не атома иода в молекуле СH3J. Это связано с большей электроотрицательностью брома по сравнению с иодом, что обусловливает большую прочность водородной связи с Br– по сравнению с отщепляющимся J–. В результате скорость этой реакции в метаноле в десятки тысяч раз меньше, чем в апротонных растворителях, где эффект специфической сольватации отсутствует.
Сольватация существенно влияет не только на общую скорость реакции, но и на соотношение механизмов SN1 и SN2. При прочих равных условиях первый из них тем более вероятен, чем выше полярность растворителя и его способность к специфической сольватации уходящей группы и чем выше кислотность катализатора. Такая роль катализаторов связана с выделением энергии сольватации, компенсирующей энергетические затраты на гетеролиз С-Х-связи.
В действительности SN1 и SN2-реакции не отделены друг от друга резкой гранью, между ними имеется область так называемых пограничных механизмов. При “чистом” SN2-механизме с отрицательно заряженным нуклеофилом реакционный центр в переходном состоянии имеет частичный отрицательный заряд, поскольку образование новой связи С-Y опережает разрыв старой связи С-Х. Если на эту реакцию начинают действовать факторы, благоприятствующие SN1-механизму (температура, сильносольватирующая среда, катализаторы –электрофилы) разрыв старой связи начинает опережать образование новой; реакционный центр в переходном состоянии приобретает положительный заряд и в пределе возникает ситуация, когда старая связь практически разорвана, а новая не образовалась, что соответствует чистому механизму SN1. Переход от механизма SN2 к механизму SN1 иллюстрируется следующей схемой:
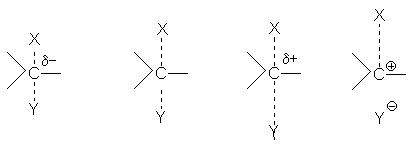
Влияние строения реагентов на реакции нуклеофильного замещения
Влияние структуры радикала R субстрата
Успех реакции SN2 определяется эффективностью атаки нуклеофила на положительно заряженный реакционный центр субстрата. При этом, чем выше этот положительный заряд, тем эффективнее взаимодействие. Поэтому электронодонорные заместители в радикале R, понижая положительный заряд на реакционном центре, замедляет нуклеофильную атаку. В то же время увеличению объема R затрудняет подход нуклеофила к реакционному центру. Совместное действие индуктивного и объемного эффектов определяет ряд реакционных способностей субстратов в реакциях нуклеофильного замещения:
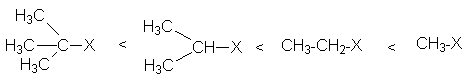
Введение электроакцепторных заместителей в радикал R приводит к увеличению положительного заряда на реакционном центре субстрата, что делает нуклеофильную атаку более эффективной. Так, аллилхлорид гидролизуется более эффективно, чем хлорпропан из-за активирующего действия отрицательного индуктивного эффекта винильной группы:
CH2 = CH ¬ CH2Cl
CH3CH2 ® CH2Cl
В реакциях SN1 скорость-определяющей стадией является образованием карбкатиона. В соответствии с постулатом Хэммонда высокая эндотермичность этой стадии обусловливает высокую степень разрыва связей в ее переходном состоянии
[ Rd + ............ Xd –] ¹
Поэтому структура фрагмента R в переходном состоянии приближается к структуре свободного карбкатиона и все факторы, стабилизирующие карбкатионы, будут стабилизировать переходное состояние а, следовательно, приводить к ускорению реакции.
Факторами стабилизации карбкатиона и, соответственно, переходного состояния гетеролиза связи С-Х являются увеличение объема заместителей при реакционном центре и их электронодонорные свойства. Так, ряд реакционной способности соединений R-X в SN1-реакциях
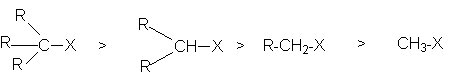
определяются совместным вкладом в стабилизацию соответствующих этому ряду карбкатионов
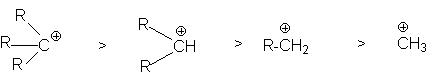
положительного индуктивного эффекта алкильных групп и увеличением объема алкильной группы за счет ее удлинения и разветвления.
Активирующее действие +М-эффекта на скорость SN1-реакций можно проиллюстрировать на примере гидролиза этоксиметилбромида и 2-бромпропана. Первое соединение обладает намного большей реакционной способностью из-за существенной стабилизации карбкатиона
![]()
Противоположное влияние индуктивного и объемного эффектов на реакции SN1 и SN2 может быть проиллюстрировано типичной зависимостью скорости реакций нуклеофильного замещения от числа алкильных заместителей при реакционном центре
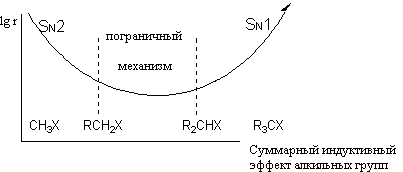
Можно видеть, что в области SN2-механизма электронодонорный и объемный эффект алкильных групп замедляет реакции, в области SN1 – ускоряет. Между этими предельными случаями находится область пограничных механизмов, когда факторы SN1 и SN2 реакций конкурируют между собой.
Влияние уходящей группы
При прочих одинаковых условиях нуклеофильное замещение как по SN1- так и по SN2-механизму должно протекать тем быстрее, чем ниже энергия гетеролитического разрыва связи С-Х. Понижение этой энергии во многом связано со стабилизацией образующегося аниона за счет его лучшей поляризуемости (в случае галогенид-анионов) или эффектов сопряжения (для эфиров сульфокислот и диалкилсульфенов)
В то же время у спиртов и эфиров в уходящих группах –ОН и –OR отсутствуют структурные возможности для стабилизации, поэтому их отщепление эффективно при действии кислотного катализа (см. выше).
Стабилизация уходящей группы гораздо рельефнее влияет на ускорение SN1-реакций по сравнению с реакциями SN2. Это связано с большей степенью разрыва связей в скорость-определяющей стадии SN1-реакции. Поэтому чем больше способность к стабилизации у уходящей группы, тем больше вероятность SN1-механизма.
Влияние нуклеофильного реагента
В случае SN1-реакций нуклеофильный реагент не участвует в скорость-определяющей стадии, поэтому его сила и концентрация не оказывают влияния на скорость этих реакций.
В случае SN2-механизма нуклеофильный реагент непосредственно участвует в реакции. Влияние его силы и концентрации суммируется в кинетическом уравнении (1)
Можно видеть, что скорость этих реакций линейно зависит от концентрации нуклеофильного реагента. Влияние силы нуклеофильного реагента отражается в значении константы скорости k. Силу нуклеофильного реагента определяется термином нуклеофильность. Нуклеофильность является результатом вклада двух факторов: основности и поляризуемости. Связь нуклеофильности с основностью определяется аналогией нуклеофильных реакций с протолитическими реакциями и фактически отражает сродство нуклеофила к положительно заряженному реакционному центру. В тех случаях, когда другие факторы, влияющие на нуклеофильность, остаются постоянными, наблюдается корреляция между константой скорости реакции SN2-замещения (нуклеофильностью) и константой основности нуклеофильного реагента (основностью). Количественно эта зависимость выражается уравнением Бренстеда
k = G × KBbили lgk = lgG + b lgKB
где k -константа скорости, KB - константа основности нуклеофила, G и b -эмпирические коэффициенты. Чем больше b , тем быстрее возрастает скорость с увеличением основности нуклеофила. По мере перехода от SN2 к SN1-механизму завязывание новой связи происходит на все большем расстоянии и величина b уменьшается. В пределе, когда реакция протекает по SN1-механизму, b =0.
Другим фактором нуклеофильности является поляризуемость. В ионах большого размера (HS–, J–, Br–) или при наличии в анионе кратных связей (CN– , NO2–) электроны легко смещаются в направлении положительно заряженного реакционного центра. Благодаря этому поляризованная нуклеофильная частица завязывает с ним связь на большем расстоянии и реагирует значительно быстрее нуклеофилов с близкой или даже большей основностью, но не способных к поляризации. Например, усредненная относительная нуклеофильность легко поляризуемых ионов С6H5S– в 470 раз выше для ионов С2H5O–, тогда как основность последних (рКВ= –2) на много порядков больше, чем для иона С6H5S– (рКВ= –4,6). Высокой нуклеофильностью обладают также ионы НS– и CN–, молекулы аммиака и аминов. В результате условия синтеза меркаптанов, сульфидов, аминов, нитрилов нуклеофильным замещением хлоралканов нередко оказываются даже более мягкими, чем условия их гидролиза щелочами.
Эдвардс предложил следующие уравнения для количественной оценки нуклеофильности
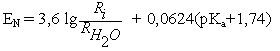
где Ri - рефракция (поляризуемость) нуклеофила, рКа -кислотность кислоты, сопряженной основанию-нуклеофилу. Стандартом служит вода, для которой нуклеофильность принята равной нулю.
Для аминов нуклеофильность изменяется в ряду: R2NH» RNH2>>NH3. При прочих равных условиях, чем сильнее нуклеофильность реагента, тем более вероятно протекание реакции по SN2-механизму. Наоборот, со слабыми нуклеофилами более быстрой может оказаться реакция SN1. Такая зависимость с обращением механизмов может быть продемонстрирована графиком зависимости скорости реакции от нуклеофильности
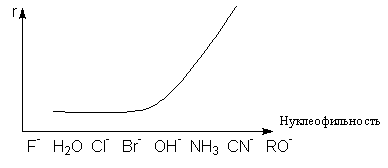
Анализ влияния природы нуклеофила и уходящей группы на скорость реакций нуклеофильного замещения показывает, что высокая поляризуемость увеличивает нуклеофильность частицы и одновременно делает ее хорошей уходящей группой. Это позволяет использовать такие частицы в качестве нуклеофильных катализаторов. Например, анион иода сильно ускоряет относительно медленные реакции гидролиза хлоралканов водой. Механизм нуклеофильного катализа этой реакции состоит в предварительном замещении хлорид-аниона иодом и последующем гидролизе образовавшегося иодалкана с образованием спирта и регенерацией J–:
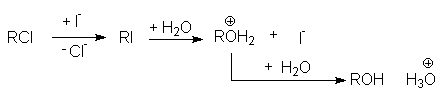
Конкуренция реакций нуклеофильного замещения
При проведении реакций нуклеофильного замещения в реакционных смесях могут присутствовать несколько нуклеофилов. В этих случаях имеет место конкуренция нескольких нуклеофильных реакций:
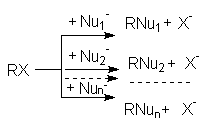
Из схемы конкуренции видно, что увеличение выхода любого из продуктов достигается увеличением избытка нуклеофила, ответственного за его образование. Так, при реализации щелочного гидролиза хлоралканов протекают следующие реакции
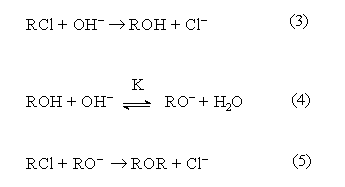
Можно видеть, что соотношение скоростей основной реакции (3) и побочной реакции образования простого эфира (5) определяется конкурентным взаимодействием
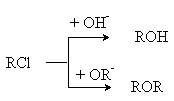
и увеличение выхода основного продукта,
спирта, может быть обеспечено увеличением избытка гидроксил-аниона. Поскольку
соотношение ![]() определяется в соответствие с равновесием (4)
равенством
определяется в соответствие с равновесием (4)
равенством
![]()
факторами увеличения выхода спирта являются увеличение избытка воды и снижение конверсии хлоралкана (что равносильно понижению концентрации спирта).
Некоторые нуклеофилы обладают двумя реакционными центрами и поэтому дают разные продукты замещения. При этом преимущественное образование продукта замещения по тому или иному реакционному центру определяется правилом Корнблюма: Если реакция протекает по SN2-механизму, то нуклеофил реагирует с субстратом своим более нуклеофильным (поляризуемым) центром. Если реакция протекает по SN1-механизму, то нуклеофил реагирует с субстратом своим более электроотрицательным основным центром. Примером ионов с двойственной реакционной способностью (амбидентных ионов) являются цианид-анион Сº N и нитрит-анион

Эти анионы в зависимости от механизма реакции, определяемого условиями их проведения и структурой субстрата, могут давать следующие продукты
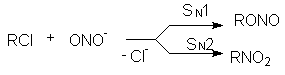
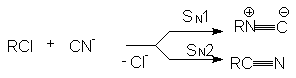
Подобная ситуация имеет место при обмене галогенов. Реакция SN2 всегда протекает в сторону замещения более электроотрицательного атома на более нуклеофильный (поляризуемый) (F и Cl на Br и J). Однако при SN1-замещении образуется продукт с более электроотрицательным заместителем (например, RF из RСl). Для изменения механизма используют соли или катализаторы с сильно электрофильным катионом (AgF, HgF2, SbF3, SbF5):