Лекция
№24
НУКЛЕОФИЛЬНОЕ АРОМАТИЧЕСКОЕ ЗАМЕЩЕНИЕ
План
Реакции
ароматического нуклеофильного замещения описываются следующей схемой:
ArX + Y: ® ArY + X:-
X=Hal, NO2, OR,
SO3H, N2+; Y= OH-, OR-,
NH2-, RS-, R3N и др.
Нуклеофильная атака незамещенного бензольного ядра протекает с гораздо большим трудом, чем электрофильная. Это связано с тем, что арены являются p -основаниями, а не кислотами, и поэтому не склонны к взаимодействию с нуклеофилами. Однако для ряда субстратов при определенных условиях такие реакции известны и их можно разделить на четыре основных типа: 1) реакции, протекающие в жестких условиях под действием сильных оснований; 2) реакции с участием субстратов, содержащих в ароматическом кольце активирующие электроноакцепторные заместители; 3) реакции, в которых участвуют субстраты с чрезвычайно легко уходящей группой; 4) реакции, инициируемые донорами электронов.
Единого механизма ароматического нуклеофильного замещения не существует. Каждый из приведенных типов реакций имеет свой механизм.
1. Механизм отщепления-присоединения
Данный механизм реализуется при взаимодействии неактивированных субстратов с сильными основаниями в жестких условиях, например, в реакциях галогенбензолов с концентрированными растворами щелочей или амидами металлов в жидком аммиаке. Механизм включает последовательные стадии отщепления и присоединения. На первой стадии нуклеофил действует как основание и отщепляет протон из орто-положения к атому галогена ароматического субстрата. Образовавшийся карбанион (I) быстро отщепляет галогенид-анион Х-, в результате чего образуется нестабильная частица (II), содержащая тройную связь в шестичленном цикле.
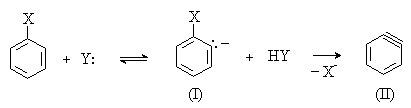
Далее следует стадия нуклеофильного присоединения к интермедиату (II) с образованием конечного продукта.
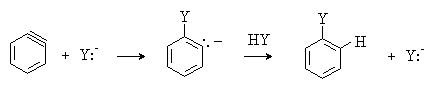
Интермедиат (II) называют дегидробензолом, а в общем случае – арином. В связи с этим рассмотренный механизм называют также ариновым механизмом.
Стадии отщепления протекают медленно и в зависимости от природы галогена одна из них является скоростьопределяющей. Присоединение к чрезвычайно реакционноспособному арину протекает быстро и не определяет скорость процесса в целом
Отличительной чертой реакций, протекающих по ариновому механизму, является то, что нуклеофил вступает не только на место уходящей группы, но и в соседнее по отношению к уходящей группе положение. Так, при использовании хлорбензола с изотопной меткой 14С в реакции с амидом калия образуется анилин, содержащий метку 14С как в положении 1, так и в положении 2, в примерно равных количествах.
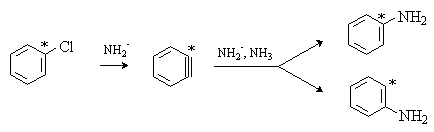
Нуклеофильное замещение в галогенбензолах, имеющих в ароматическом кольце помимо галогена другой заместитель, приводит к образованию изомеров. Так, при взаимодействии пара-хлортолуола с амидом натрия в жидком аммиаке получают смесь мета- (62%) и пара-толуидинов (38%):
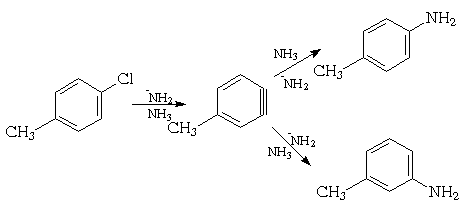
Если оба орто-положения по отношению к атому галогена заняты, то замещения в данных условиях вообще не идет.
Образующиеся в качестве интермедиатов арины не содержат полноценную тройную связь, так как присутствие тройной связи в шестичленном цикле должно приводить к очень большому напряжению. Более вероятно, что делокализованные p -орбитали ароматической системы в основном не затрагиваются, а лежащая в плоскости кольца локализованная p -связь образуется за счет частичного перекрывания sp2-гибридных орбиталей.
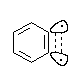
Перекрывание между этими орбиталями с учетом пространственных требований оказывается слабым, поэтому арины по структуре близки к бирадикалам, что обусловливает их чрезвычайно высокую реакционноспособнную способность.
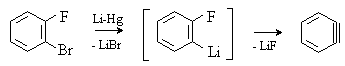
В настоящее время разработан ряд методов генерирования аринов. Дегидробензол образуется при взаимодействии о-дигалогенаренов с амальгамой лития или магния.
Наиболее удобный метод генерирования дегидробензола состоит в диазотировании антраниловой кислоты с последующим разложением образующейся внутренней соли диазония, которая при нагревании или облучении синхронно отщепляет азот и СО2.
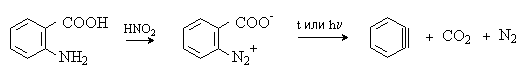
В связи с высокой реакционной способностью арины не могут быть выделены как индивидуальные вещества. Существование аринов доказано в экспериментах с их улавливанием. Так, генерирование дегидробензола в присутствии фурана приводит к получению аддукта реакции Дильса-Альдера:
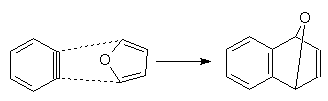
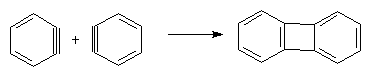
При генерировании дегидробензола в отсутствие частиц, способных с ним взаимодействовать, он очень быстро димеризуется в устойчивый бифенилен:
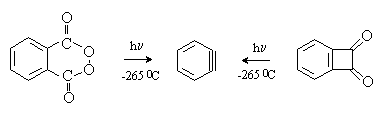
Дегидробензол в качестве индивидуального соединения, а не предполагаемого интермедиата, был зафиксирован при фотолизе фталоилпероксида или бензциклобутен-1,2-диона в твердой аргоновой матрице при –2650С.
2. Механизм присоединения-отщепления (SNAr)
Наличие в ароматическом кольце электроноакцепторных заместителей (NO2, CN, N2+ и др.) снижает основность аренов и повышает их реакционную способность по отношению к нуклеофильным реагентам. Ароматическое нуклеофильное замещение в этом случае протекает в гораздо более мягких условиях и по принципиально иному механизму. Реакция является бимолекулярной. Однако, в отличие от алифатического нуклеофильного замещения SN2, процесс включает две последовательные стадии - присоединение и отщепление. На первой стадии ароматический субстрат присоединяет нуклеофил с образованием анионного s -комплекса, который получил название комплекса Мейзенгеймера. На второй стадии происходит отщепление уходящей группы с образованием конечного продукта замещения.
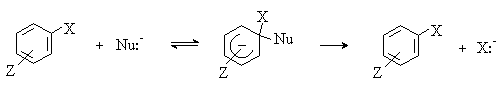
В пользу этого механизма собрано много доказательств. Одним из таких доказательств является выделение комплексов Мейзенгеймера в индивидуальном виде или идентификация их с помощью физико-химических методов в растворе. Такие относительно стабильные s -комплексы могут быть получены в том случае, если в орто- и пара-положениях к уходящей группе имеются сильные электроноакцепторные заместители (Z=NO2), а сама уходящая группа относится к разряду плохих уходящих групп (X=H, OR). Мейзенгеймер получил аддукты из метилового и этилового эфиров пикриновой кислоты, действуя на них, соответственно, этилатом или метилатом калия, и доказал идентичность соединений, полученных обоими путями.
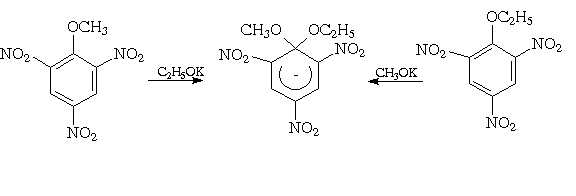
Анионные s -комплексы, которые можно
принять за модели переходного состояния, стабилизируются за счет делокализации
отрицательного заряда с участием электроноакцепторных группировок. Наибольшая
стабилизация достигается при наличие электроноакцепторных заместителей в орто-
и пара-положениях к уходящей группе, так как в этом случае акцепторная
группа находится в прямом полярном сопряжениии с отрицательно заряженным атомом
углерода.
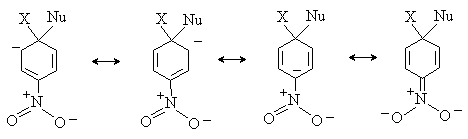
В большинстве случаев стадия образования s -комплекса является скоростьопределяющей. Об этом, а также о двухстадийном механизме реакции, свидетельствует влияние природы уходящей группы на скорость процесса. При ароматическом нуклеофильном замещении SNAr скорость реакции обычно уменьшается в ряду ArF>>ArCl>ArBr>ArI, что противоположно ряду реакционной способности алкилгалогенидов в SN-реакциях (I>Br>Cl>F). Поскольку энергия разрыва связи С-Hal наибольшая для фтора, это означает, что на скоростьопределяющей стадии разрыва этой связи не происходит. Лимитирующей является первая стадия, а роль уходящей группы сводится к стабилизации анионного s -комплекса за счет индуктивного эффекта, который у атома фтора наибольший.
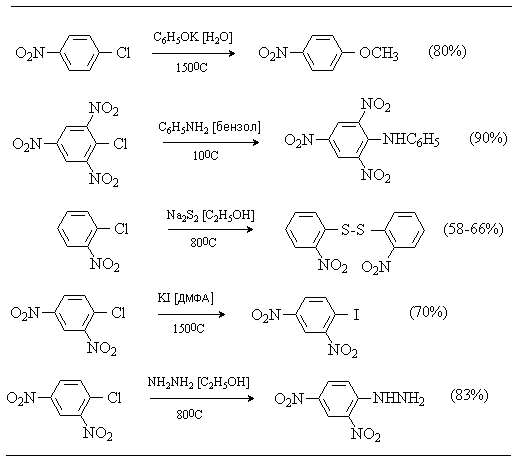
Наиболее распространенными субстратами в SNAr-реакциях являются
2-нитро-, 4-нитро-, 2,4-динитро- и 2,4,6-тринитрогалогенбензолы. Примеры
реакций с их участием приведены в таблице.
Реакции ароматического нуклеофильного замещения SNAr
3. SN1-механизм ароматического нуклеофильного замещения
SN1-механизм предполагает образование карбокатинного интермедиата и реализуется для субстратов, способных давать достаточно стабильный карбокатион. В случае ароматических субстратов при диссоциации связи Ar-X должен образоваться арил-катион. Его стабильность очень мала, поскольку sp2-гибридная вакантная орбиталь ориентирована ортогонально p -системе ароматического кольца и с ней не взаимодействует.
![]()
Это приводит к тому, что реакции мономолекулярного замещения в ароматическом ряду возможны только случае очень хороших уходящих групп. Наиболее типичный пример – гетеролитический распад диазосоединений, когда в результате диссоциации образуется бедная энергией молекула азота и процесс является выгодным термодинамически.
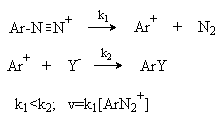
Реакции разложения ионов диазония имеют все характерные черты SN1-процессов. Разложение протекает как реакция первого порядка. Скорость реакции не зависит от концентрации присутствующих в реакционной среде нуклеофилов, но существует конкуренция нуклеофилов на стадии образования конечного продукта при взаимодействии с арил-катионом.
По такому механизму протекают реакции солей диазония с водой, спиртами и галогенид-анионами:
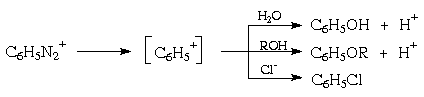
См. также лек.№ 29 и 43.
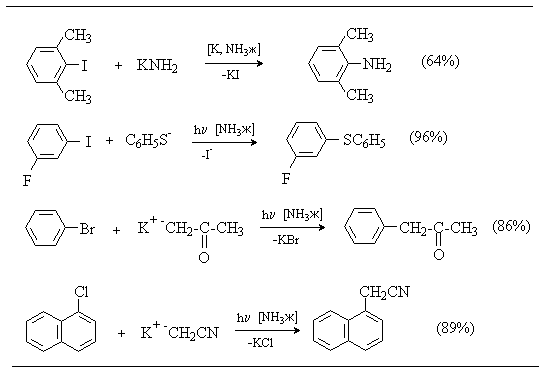
4. Механизм SRN1 в ароматическом ряду
Взаимодействие неактивированных арилгалогенидов с нуклеофилами может
протекать в мягких условиях через промежуточное образование ароматических
анион-радикалов. Такой процесс носит название радикально-нуклеофильного
мономолекулярного замещения (SRN1). Реакция инициируется путем
переноса одного электрона от восстановителя к субстрату. В качестве
восстановителя-инициатора может выступать “сольватированный электрон”,
образующийся при растворении металлических калия или натрия в жидком аммиаке.
Функцию одноэлектронного восстановителя может выполнять и сам нуклеофил в
условиях фотоинициирования.
На стадии инициирования за счет одноэлектронного переноса происходит
образование анион-радикала ArX-.. Далее
анион-радикал распадается на арильный радикал и анион Х-. При
взаимодействии арильного радикала с нуклеофилом происходит образование нового
анион-радикала ArY-..
Перенос электрона от анион-радикала ArY-.
к исходному субстрату приводит к образованию конечного продукта и регенерации
ион-радикала ArX-.. Три стадии
ион-радикального процесса могут быть выражены следующей последовательностью
превращений.
инициирование
ArX + e- ® (ArX)-.
развитие цепи
(ArX)-. ®Ar. + X-
Ar. + Y- ® (ArY)-.
(ArY)-. + ArX ® ArY + (ArX)-.
обрыв цепи
Ar. + растворитель ® ArH
Наряду
с фотоинициированием и стимулированием сольватированными электронами, в пользу
описанного механизма свидетельствует то, что добавки веществ, являющихся
ловушками свободных радикалов, ингибируют такого типа реакции.
Характерной особенностью процессов, протекающих по данному механизму, является нечувствительность к электронным и пространственным эффектам заместителей в ароматическом кольце. Сильные электроноакцепторные заместители, подобные нитро- или трифторметильной группе, не облегчают протекание реакции по механизму SRNAr; аминогруппа (донор электронов) не препятствует протеканию реакции по данному механизму.
Наиболее склонны к восстановлению до анион-радикалов арилиодиды. Однако арилбромиды и арилхлориды также способны вступать в SRNAr-реакции с подходящими нуклеофильными реагентами и при соответствующем способе инициирования.
Данный метод позволяет получать соединения, для которых трудно предложить какой-либо рациональный альтернативный метод получения.
Реакции нуклеофильного ароматического замещения по механизму SRN1