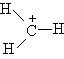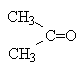Лекция № 3
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О СТРОЕНИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
План
- Теория
химического строения А.М. Бутлерова.
- Электронные
теории химической связи.
- Основные
принципы квантовой органической химии.
1. Теория химического строения А.М.
Бутлерова
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, которая состоит из следующих основных положений.
- В
молекулах веществ существует строгая последовательность химического
связывания атомов, которая называется химическим строением.
- Химические
свойства вещества определяются природой элементарных составных частей, их
количеством и химическим строением.
- Если у
веществ с одинаковым составом и молекулярной массой различное строение,
то возникает явление изомерии.
- Так как
в конкретных реакциях изменяются только некоторые части молекулы, то
исследование строения продукта помогает определить строение исходной
молекулы.
- Химическая
природа (реакционная способность) отдельных атомов в молекуле меняется в
зависимости от окружения, т.е. от того, с какими атомами других элементов
они соединены.
Теория
Бутлерова дает принципиальную возможность познания геометрии молекулы
(микроскопических свойств) через познание химических свойств (макроскопических
свойств). Основные положения теории строение сохраняют свое значение до сих
пор.
2. Электронные теории химической связи
Г.Льюисом и В.Косселем (1916 г.) была предложена электронная теория химической связи. Согласно этой теории ковалентная связь образуется за счет пары электронов, общей для двух связываемых атомов. Частица устойчива, если валентная оболочка элементов первого периода (Н) содержит два (правило дублета), а элементов второго периода (C, N, O, F) - восемь электронов (правило октета).
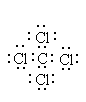
Электронное строение органических соединений изображают с помощью электронных формул Льюиса. В них с помощью точек указывают положение всех валентных электронов: электронов химических связей и неподеленных пар электронов. При этом считают, что неподеленные пары электронов составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи, являются частью внешней оболочки обоих атомов. Например, в приведенной ниже формуле Льюиса для тетрахлорметана все атомы имеют октет электронов.
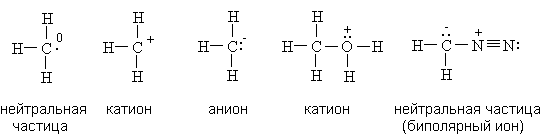
Для каждого атома в структуре Льюиса определяют формальный заряд. При этом полагают, что атому принадлежат все неподеленные электроны и половина электронов ковалентных связей. Избыток электронов, принадлежащих атому в молекуле по сравнению со свободным атомом, обусловливает отрицательный заряд, а недостаток - положительный заряд. Сумма формальных зарядов всех атомов дает заряд частицы в целом.
3. Основные принципы квантовой органической химии
Современные теории ковалентной связи основаны на представлениях квантовой механики. Согласно принципам квантовой механики состояние электрона в атоме определяется волновой функцией, которую называют атомной орбиталью. Образование химической связи между атомами рассматривается как результат взаимодействия двух орбиталей, на каждой из которых находится по одному электрону. При этом происходит образование молекулярных орбиталей (МО). Из двух атомных орбиталей образуются две молекулярные орбитали, одна из которых (связывающая) имеет более низкую энергию, а другая (разрыхляющая) – более высокую энергию, чем исходные АО.
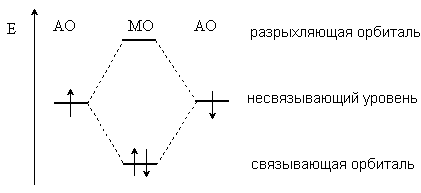
Электроны связи занимают более низкую по энергии связывающую орбиталь, таким образом, взаимодействие орбиталей приводит к выигрышу в энергии.
В зависимости от типа комбинирующихся атомных орбиталей образуются разные типы МО. Определяющую роль в этом играют симметрия и узловые свойства орбиталей. Атомные s-орбитали имеют симметрию шара и не имеют узловых поверхностей, проходящих через центр атома. Атомные p-орбитали имеют цилиндрическую симметрию и три состояния px, py и pz. Каждая p-орбиталь имеет узловую плоскость, проходящую через центр атома и перпендикулярную соответственно оси x, y или z.
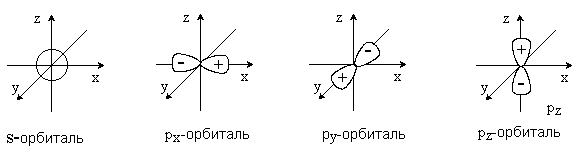
Узловая поверхность – это место, где вероятность нахождения электрона равна нулю, а волновая функция меняет знак. Чем больше узлов, тем выше энергия орбитали. Таким образом, p-орбиталь состоит из двух частей, в которых знаки волновых функций противоположны.
При комбинировании по оси х двух s-орбиталей, s-орбитали и px-орбитали или двух px-орбиталей образуются s -МО: связывающие (s ) и разрыхляющие (s *).
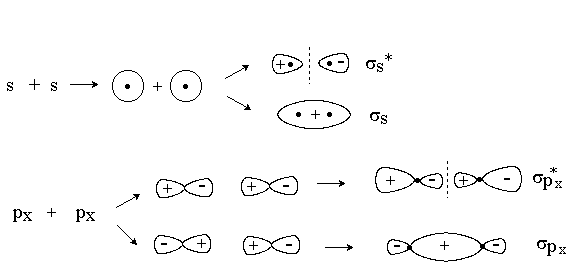
s -МО имеют цилиндрическую симметрию. Разрыхляющие s*-МО имеет узловую плоскость, проходящую между ядрами.
При комбинировании вдоль оси х двух ру или двух рz-орбиталей образуются МО p -типа.
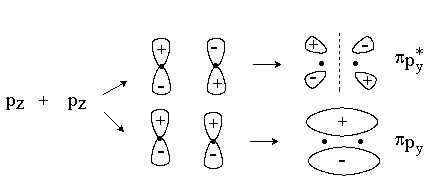
Связывающая p -МО имеет узловую плоскость, проходящую через линию, соединяющую ядра атомов. Разрыхляющая p *-МО имеет, кроме того, узловую плоскость, проходящую между ядрами.
При рассмотрении электронного строения многоатомных молекул необходимо использовать такой набор орбиталей, при котором достигается их максимальное перекрывание. В связи с этим водится понятие гибридизации орбиталей. Атом углерода в возбужденном состоянии содержит четыре неспаренных электрона на внешнем энергетическом уровне и способен образовать четыре ковалентных связи.
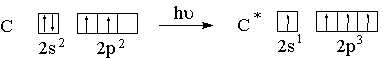
В образовании связей участвуют гибридные орбитали.
Первое валентное состояние – sp3-гибридизация. В результате гибридизации с участием одной s и трех p орбиталей атома углерода образуются четыре эквивалентные sp3-гибридные орбитали, направленные к вершинам тетраэдра под углами 109,5о:
В состоянии sp3-гибридизации атом углерода образует четыре s -связи с четырьмя заместителями и имеет тетраэдричекую конфигурацию с валентными углами, равными или близкими 109,5о:
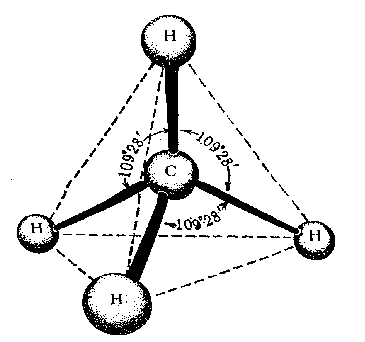
Метан
Второе валентное состояние – sp2-гибридизация. В результате гибридизации с участием одной s- и двух p-орбиталей атома углерода образуются три эквивалентные sp2-гибридные орбитали, лежащие в одной плоскости под углами 120о, а не участвующая в гибридизации p-орбиталь расположена перпендикулярно плоскости гибридных орбиталей.
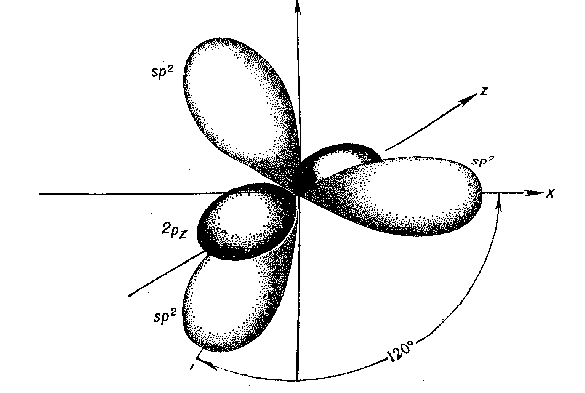
В состоянии sp2-гибридизации атом углерода образует три s -связи за счет гибридных орбиталей и одну p -связь за счет не участвующей в гибридизации p-орбитали и имеет три заместителя:
Этилен
Третье валентное состояние углерода – sp-гибридизация. В результате гибридизации с участием одной s- и одной p–орбитали образуются две эквивалентные sp-гибридные орбитали, лежащие под углом 1800, а не участвующие в гибридизации p-орбитали расположены перпендикулярно плоскости гибридных орбиталей и друг другу. В состоянии sp-гибридизации атом углерода образует две s -связи за счет гибридных орбиталей и две p -связи за счет не участвующих в гибридизации p-орбиталей и имеет два заместителя:

Ацетилен
Таблица 3.1. Зависимость структуры
соединений от типа гибридизации углерода.
|
Тип гибридизации |
Число заместителей |
Геометрия и валентный угол |
Примеры |
|
sp3 |
4 |
Тетраэдрическая 109,5 |
CH4,
CCl4, CH3OH
|
|
sp2 |
3 |
Тригональная 120 |
CH2=CH2,
|
|
sp |
2 |
Линейная
180 |
HCº CH CH3Cº N O=C=O CH2=C=O |