Лекция
№30
ПРОСТЫЕ ЭФИРЫ
План
Простые эфиры можно рассматривать как производные спиртов, в
которых атом водорода гидроксильной группы замещен на углеводородный радикал.
По характеру атомов углерода, связанных с кислородным атомом, простые эфиры можно подразделить на следующие типы:
1. Эфиры, содержащие связи С(sp3)¾O.
К ним относятся эфиры структуры ROR/и циклические эфиры.
![]()
2. Эфиры содержащие связь С(sp2)¾O
К ним относятся
- алкилалкениловые
(виниловые) эфиры
![]()
- диалкениловые эфиры
![]()
- алкилариловые эфиры
![]()
- диариловые эфиры
![]()
3. Эфиры, содержащие связь С(sp)¾O
RCº
C-OR/
Диалкиловые эфиры
Диалкиловые
эфиры являются наиболее важными представителями класса простых эфиров. Их
эмпирическая формула СnH2n + 2O или СnH2n
+ 1OCmH2m + 1.
Изомерия и номенклатура
Наименование диалкиловых эфиров по рациональной номенклатуре образуют путем перечисления заместителей и прибавления слова "эфир".
Номенклатура IUPAC рассматривает эфир как производное углеводорода, замещенного на алкоксигруппу, причем в основе названия лежит наиболее длинная углеводородная цепь.

Способы получения диалкиловых эфиров
- Синтез Вильямсона.
![]()
Можно видеть, что этот способ удобен для
получения несимметричных эфиров.
- Межмолекулярная дегидратация спиртов.
![]()
Реакция эффективна при получении симметричных
эфиров. Следует иметь в виду, что при повышении температуры будет
прогрессировать реакция нуклефильного отщепления, особенно если обьектом
дегидратации являются разветвленные спирты (вторичные и третичные)
- Алкилирование спиртов алкенами.
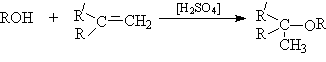
Функция кислоты – катализатора заключается в генерировании карбкатионов, которые эффективно атакуются нуклеофилом – спиртом:
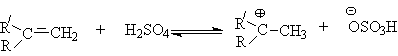
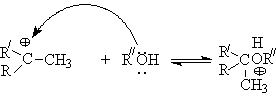
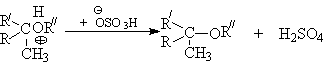
Эффективность реакции определяется стабильностью карбкатиона, поэтому соблюдается следующий ряд реакционной способности алкенов.
![]()
- Алкоксимеркурирование алкенов.
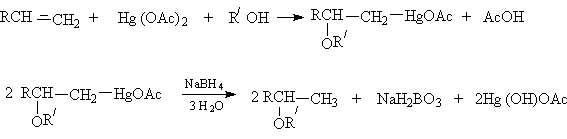
или суммарно
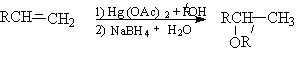
Физические свойства и строение
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира) со своеобразным запахом и низкими температурами кипения, что свидетельствует о слабом межмолекулярном взаимодействии. Это является показателем низкой полярности диалкиловых эфиров и отсутствия (в отличие от спиртов) предпосылок для образования водородных связей. В отличие от спиртов эфиры обладают более сильными электронодонорными свойствами, о чем свидетельствует значение потенциалов ионизации. Увеличение электронодонорных свойств обьясняется положительным индуктивным эффектом алкильных групп. Валентный угол приближается к тетраэдрическому и равен109–1120.
Химические свойства
- Основность
Основность простых эфиров проявляется в их взаимодействии с кислотами Бренстеда и Льюиса. С Бренстедовскими кислотами умеренной силы взаимодействие осуществляется посредством водородной связи.
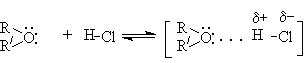
В случае сильных Бренстедовских кислот происходит протонирование эфиров и образование оксониевых кислот.
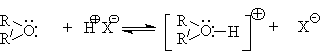
Простые эфиры – слабые основания и начинают протонироваться в ощутимых количествах в растворе 30 - 40%-ной серной кислоты.
С кислотами Льюиса диалкиловые эфиры образуют стабильные продукты присоединения – эфираты.
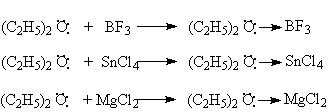
В этих соединениях образуется донорно–акцепторная связь за счет неподеленной пары атома кислорода.
Способность простых эфиров сольватировать катионы
различных металлов имеет исключительное значение для получения
металоорганических соединений в растворах диалкиловых эфиров или
тетрагидрофурана.
- Реакции при a - углеродном атоме
диалкиловых эфиров.
Простые эфиры могут вступать в реакции свободнорадикального хлорирования и автоокисления, причем обьектом этих реакций является a - углеродный атом эфиров.
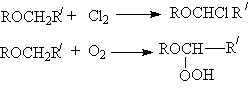
Основанием для такого направления является стабильность a - алкилалкоксирадикалов,
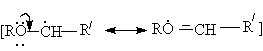
обуслoвливающая энергетическую выгодность реакции инициирования (в случае автоокисления) и развития цепей (в случае автоокисления и хлорирования)
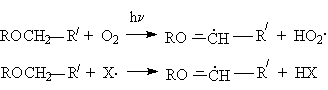
где Х. – радикал цепи при хлорировании (Cl.) и автоокислении
![]()
Образующиеся в результате автоокисления гидропероксиды
являются взрывчатыми веществами. Они могут образовываться в эфирах при хранении
в условиях доступа воздуха и в прозрачных бутылках. Поэтому эфиры после
длительного хранения перед употреблением подлежат обработке с целью разрушения
гидропероксидов.
- Реакции расщепления С ¾ О – связи
Эфиры
расщепляются под действием сильных кислот, например, иодоводородной,
бромоводородной, суперкислот:
![]()
![]()
При действии суперкислот на эфиры при низких температуах генерируются карбкатионы, которые могут претерпевать различные перегруппировки и распад до алкенов.
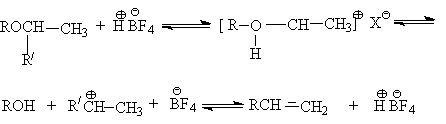
При
этом легче расщепляются простые эфиры, которые содержат разветвленные группы,
так как в результате протонирования образуются более устойчивые карбкатионы.
Алкилвиниловые эфиры.
Методы получения
- Винилирование спиртов
![]()
- Дегидрогалогенирование a - галогендиалкиловых
эфиров
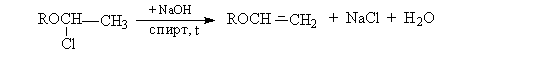
Химические свойства алкилвиниловых эфиров
Основными
реакциями алкилвиниловых эфиров являются:
- Электрофильное присоединение
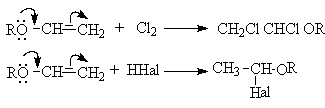
Можно показать, что порядок присоединения HНal и
других протонных кислот определяется стабильностью промежуточных карбкатионов.
- Полимеризация
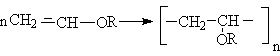
Эти реакции могут осуществляться по свободнорадикальному или карбкатионному механизмам. В первом случае в качестве инициаторов используют органические пероксиды или азобисизобутилонитрил, во втором - реакции катализируются протонными кислотами, причем во избежание электрофильного присоединения кислоты - катализатора НХ к двойной связи, кислоте должен соответствовать слабый нуклефил Х.
Циклические эфиры
Циклические
эфиры – производные алкандиолов, в которых эфирная связь образована
внутримолекулярно.
Циклические эфиры подразделяются на несколько групп в зависимости от величины цикла и числа кислородных атомов в цикле. Их часто называют оксидами.
В этом плане различают:

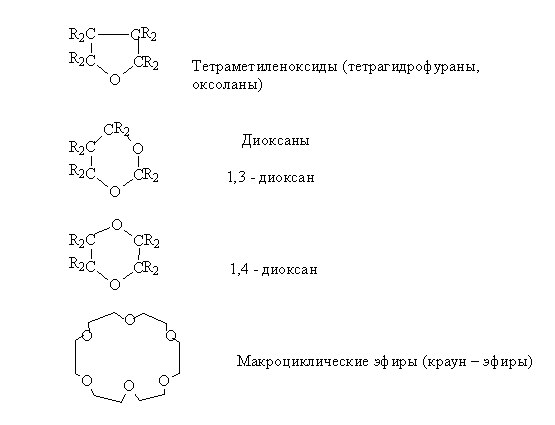
Эпоксиды (оксираны)
Основу
названия этих соединений составляет наименование углеводорода, а на присутствие
кислородного мостика указывает приставка "эпокси". Для простейших
соединений сохраняется название этиленоксид и пропиленоксид. Используется также
номенклатура гетероциклических соединений "оксираны". Например,
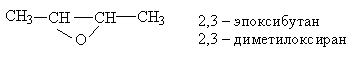
Методы получения
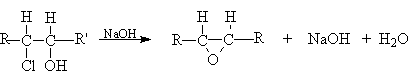
- Дегидрогалогенирование галогеналканолов
(галогенгидринов)
- Окисление (эпоксидирование) алкенов (реакция
Прилежаева)
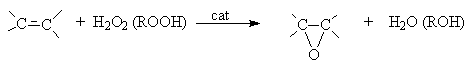
В качестве катализаторов используют кислые соли вольфрамовой кислоты (Н2О2) и соединений молибдена (ROOH). Реакцию можно осуществлять некаталитически, если в качестве эпоксидирующего агента использовать органические надкислоты.
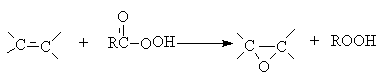
Первый член гомологического ряда этиленоксид, в промышленности получают парофазным окислением кислородом или воздухом.
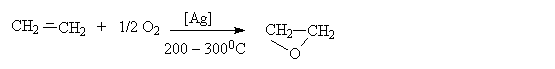
Химические свойства
Химическое поведение оксиранов определяется тремя факторами: поляризацией связей С ¾ О с образованием частичного положительного заряда на углероде оксидного цикла, электронодонорными свойствами атома кислорода и напряженностью оксидного цикла. Поэтому наиболее характерными реакциями оксиранов являются реакции нуклеофильного присоединения по положительно заряженному углероду цикла, сопровождающиеся разрывом связи С¾ О цикла, облегчаемым протонированием кислородного атома под действием протонодонорного агента.
Совместное действие этих факторов отчетливо проявляется в некаталитической реакции этиленоксида с водой
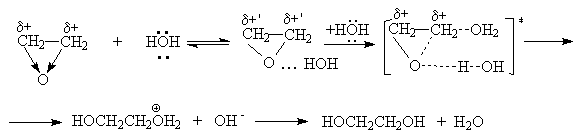
или суммарно:
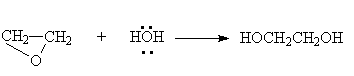
Эта реакция протекает медленно, поскольку вода является слабым протонодонорным агентом. Для ускорения этой реакции необходимо использовать высокую температуру и давление.
Другие более сильные нуклеофилы (NH3, RNH2, RMgX) реагируют более легко.
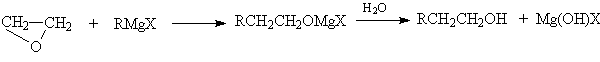
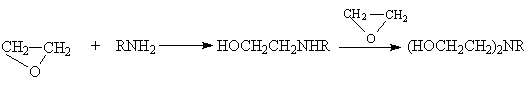
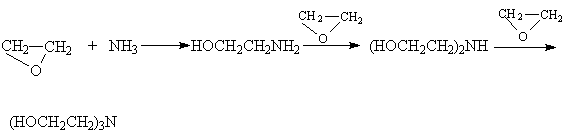
Приведенные реакции имеют важное препаративное и промышленное значение. Получаемый гидратацией этилена этиленгликоль являются антифризом и исходным веществом для синтеза лавсана, этаноламины используются в качестве абсорбентов для извлечения кислых примесей из газов. Оксиэтилирование реактивов Гриньяра – важный способ увеличения длины углеродной цепи органических соединений на два углеродных атома.
Если в реакциях нуклеофильного замещения оксиранов участвуют нуклеофилы HNu, обладающие слабой нуклефильной активностью и слабой кислотностью (H2O, H2S, RSN), то для эффективного проведения этих реакций используют кислотный или основной катализ. Например, кислотно–каталитическая реакция со спиртами связана с эффективным протонированием оксирана, приводящим к увеличению положительного заряда на его углеродных атомах и делающим атаку нуклеофила более эффективной:
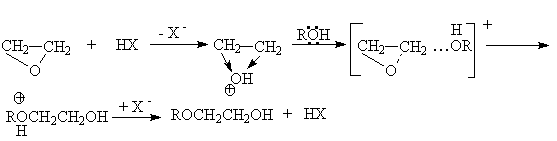
Или суммарно
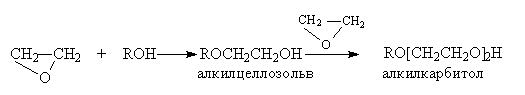
Образующиеся в этих реакциях целлозольвы и карбитолы – универсальные растворители.
При основном катализе под действием основания продуцируется более эффективный нуклеофил, например, в реакциях с ROH, RSH, H2S, HCN, эффективно атакующий углеродный атом оксиранового цикла:
![]()
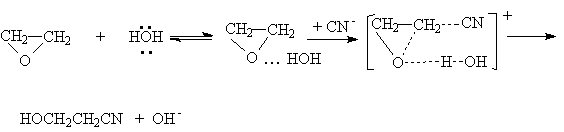
или суммарно:
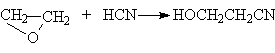
Краун – эфиры
Краун-эфиры - макроциклические полиэфиры с четырьмя и более кислородными атомами в цикле. В большинстве случаев они являются производными этиленгликоля. В названии соединений цифра в квадратных скобках указывает число атомов в макроцикле, а вторая - число кислородных атомов.
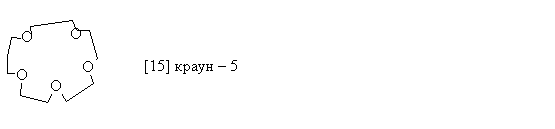
Краун - эфиры получают по реакции Вильямсона из соответствующих гликолятов и дигалогеналканов:
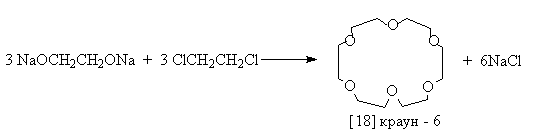
или галогенов b , b ’ – дигалогеналкиловых эфиров.
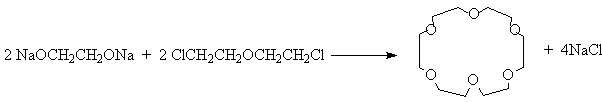
Самое важное свойство краун–эфиров – образование комплексов с катионами металлов.
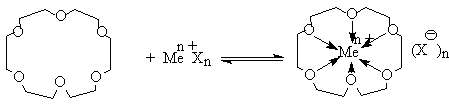
Ион металла находится в полости макроцикла и прочно удерживается благодаря донорно–акцепторным связям кислород – металл, причем чем ближе ионный диаметр металла к диаметру полости, тем устойчивее комплекс.
Краун – эфиры используют для улучшения растворимости неорганических солей в органических растворителях, в качестве межфазных катализаторов, для генерирования несольватированных анионов в неорганических растворителях. Благодаря этому можно ускорить реакцию нуклеофильного замещения этими анионами. Соединения типа краун – эфиров играют большую роль в биологических системах – они осуществляют транспорт ионов через биологические мембраны