Лекция
№34
1,3 дикетоны. a, b- Непредельные и ароматические альдегиды и кетоны.
План.
1,3–дикарбонильные соединения обладают высокоподвижным атомом водорода при центральном углероде. Как следствие, эти соединения легко подвергаются енолизации.
Енольная и кето-формы, а также енолят-анион являются ключевыми частицами, ответственными за реакции этих соединений.
К наиболее важным химическим свойствам 1,3-дикарбонильных соединений относятся:
1. Кислотность и енолизация
1,3
– дикетоны проявляют кислотные свойства, причем за кислотность отвечают две
формы – кето– и енольная. Равновесие между этими таутомерными формами
устанавливается через промежуточное образование енолят – аниона.
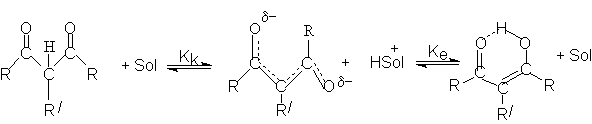
Дикарбонильняя форма является С-Н-кислотой, а енольная – ОН–кислотой. Каждая из
форм имеет свою константу кислотности: Кк и Ке. Чтобы
оценить Кк и Ке, необходимо знать соотношения таутомерных
форм, т.е константу таутомерного равновесия, Кт.
Кт = [E]/[K]
где [E] и [K] – концентрации таутомерных форм.
Можно показать, что
Кт = Кк / Ке
(1)
Из
соотношения (1) видно, что доминирующей таутомерной формой является та, которая
имеет меньшую кислотность. Так, для ацетилацетона рКк = 8,9, а рКе
= 8,2 , откуда следует, что Кт = 0,2, что соответствует содержанию
енола 16,5%. На соотношение констант кислотности таутомеров влияют растворитель
и структура соединения.
1. Влияние растворителя
В общем случае растворитель по-разному влияет на кислотность таутомерных форм, поэтому при переходе от одного растворителя к другому меняется соотношение таутомерных форм. Например, в водном растворе для ацетилацетона Кт = 0,2, а в растворе метанола Кт = 2,6 (72% енола). Такой результат можно обосновать с точки зрения различия в кислотностях воды и метанола. Так, вода, обладающая более высокой кислотностью, чем метанол, образует более прочные водородные связи с кето–формой ацетилацетона. В то же время кислотность растворителя не играет такой существенной роли в сольватации циклической енольной формы, так как в последней потенциал карбонильного атома кислорода использован для образования внутримолекулярной водородной связи. Как следствие, в воде более выгодной становится существенно сольватированная кето–форма.
2. Влияние структуры дикетона
Структура дикетонов в общем случае по–разному влияет на относительную устойчивость кето- и енольной форм. Так, шестичленные циклические транс– фиксированные b -дикетоны сильно енолизированы, так как у енольной формы идеально соблюдается условие компланарности для сопряжения, а, следовательно, стабилизации.
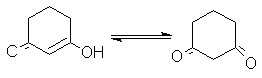
100% енола
В то
же время такие условия отсутствуют у бициклических 1,3–дикетонов с центральным
атомом углерода в голове моста.
3. Образование солей
Следствием
кислотности 1,3–дикетонов является образование ими солей при взаимодействии с
активными металлами или сильными основаниями.
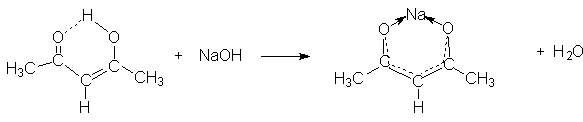
Особенно
характерны соли тяжелых металлов, которые в растворах практически не
диссоциируют. Благодаря этому в качестве реагентов для синтеза таких солей
можно использовать соли тяжелых металлов – сильные электролиты.
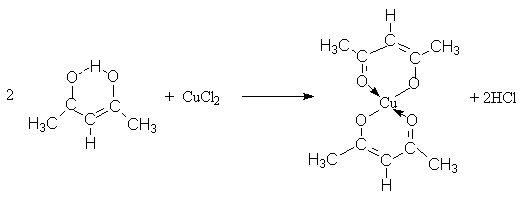
3. Взаимодествие с электрофильными реагентами.
Анион,
ионная пара соли или енольная форма восприимчивы к действию электрофильных
агентов. Примером могут быть реакции алкилирования или ацилирования. Как енол,
так и анион являются амбидентными частицами. Местом электрофильной атаки в них
могут быть кислородные атомы или углеродный атом между карбонильными группами
(активная метиленовая группа).
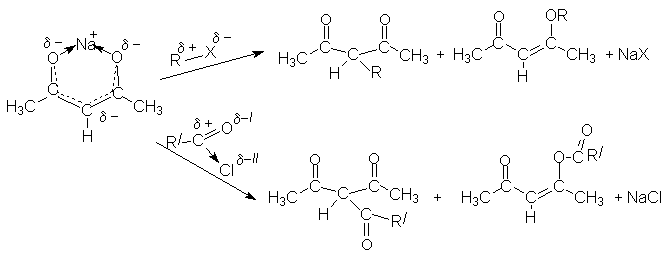
В общем случае получается смесь продуктов С- и О-алкилирования или
ацилирования. В случае 1,3–дикарбонильных соединений, образующих цис–енольную
форму, преимущественно образуются С-производные, так как атомы кислорода
значительно блокированны ионом металла. Если обьектом электрофильного замещения
являются транс- фиксированные 1,3–дикетоны, то преимущественно могут
получаться продукты О- замещения.
Взаимодействие с другими электрофильными реагентами (нитрование, сульфирование, галогенирование, нитрозирование, азосочетание) может быть изображено общей схемой.
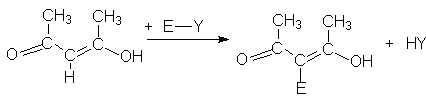
где Е – NO, NO2, ArN2,
SO3H, Cl, Br, I.
4. Взаимодействие с нуклеофильными реагентами.
Енольная
или дикарбонильная форма 1,3–дикетонов могут быть объектами нуклеофильной
атаки, причем атакуемым реакционным центром в этих реакциях выступает
карбонильный углерод. Если в реакциях участвуют слабые нуклеофилы (вода,
спирты, тиолы), то для успешной реализации реакции используют кислотный
катализ.
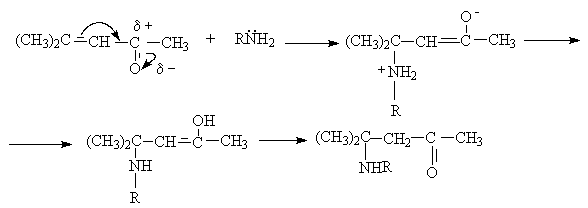
Примером нуклеофильной атаки является взаимодействие с аммиаком и аминами. Считается, что активной формой, реагирующей с RNH2, является дикарбонильная форма.
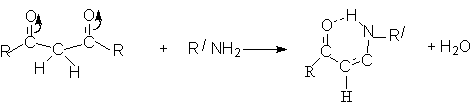
Результатом этих реакций является образование енаминов, стабилизированных за счет образования прочной внутримолекулярной водородной связи.
В случае реакции с гидроксиламином и гидразинами образуются гетероциклические соединения. Подробное описание этих реакций будет дано в материале по гетероциклическим соединениям.
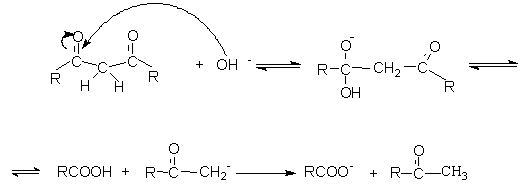
Примером другой реакции нуклеофильного замещения является щелочной гидролиз
1,3 – дикетонов.
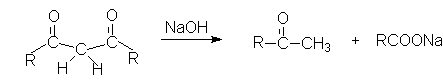
Реакция может быть представлена механизмами.
a ,b- Непредельные альдегиды и кетоны
Соединения этого ряда могут быть представлены структурой
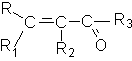
где R ,R1 ,R2 ,R3 - представляют собой алкильные группы или атом водорода.
Методы получения
1. Дегидратация альдолей, кротоновая конденсация
Альдоли - продукты альдольной конденсации, легко отщепляют воду, особенно
при кислотном катализе.
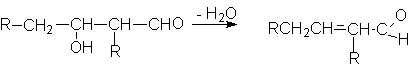
В результате дегидратации альдоля получается кротоновый альдегид, поэтому часто
этот процесс называют кротонизацией.
В ряде реакций карбонильных соединений, например, аренкарбальдегидов с
кетонами, продукт альдольного присоединения выделить не удается и сразу
получается ненасыщенные соединения. Такие реакции называют кротоновой
конденсацией.
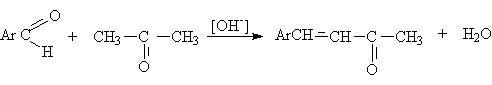
2. Реакции окисления алкенолов и алкинолов
Использование некоторых окислителей, например, CrO3 при низких
температурах, позволяет селективно окислять спиртовые группы до альдегидных и
кетонных:
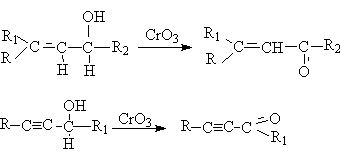
Другой вариант подобного синтеза – каталитическое окисление кислородом
![]()
Структурные особенности a, b- ненасыщенных карбонильных соединений
Соединения характеризуются полярной сопряженной системой. В виду
значительного индуктивного (- I) эффекта и большого изомерного (- М) эффекта
карбонильной группы двойная углерод – углеродная связь сильно поляризована.
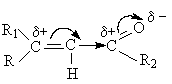
Дипольный момент таких соединений больше, чем для насыщенных карбонильных соединений. a,b-Ненасыщенные карбонильные соединения в молекуле имеют два электрофильных реакционных центра.
Химические свойства
a , b-Ненасыщенные карбонильные соединения могут вступать в обычные реакции присоединения и конденсации по карбонильной группе, такие как образование циангидридов и гидразонов и присоединение металлоорганических соединений. Эти реакции могут осложняться, а иногда перекрываться 1,4–присоединением.
1. Циангидринирование
Реакция
циановодорода с альдегидами протекает как 1,2–присоединение, так как этот путь
более выгоден с точки зрения скорости и с точки зрения равновесия, чем
1,4–присоединение.
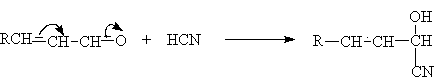
Образование циангидринов кетонов менее выгодно с точки зрения скорости и
равновесия и в результате 1,4–присоединение приводит к b -цианокетону (продукту
3,4-присоединения).
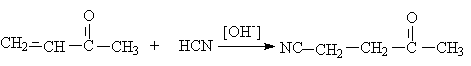
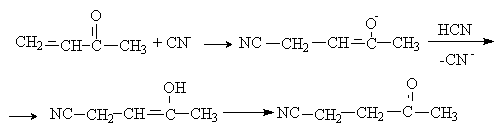
Механизм
2. Присоединение воды и галогеноводородов к a, b - енасыщеннымальдегидам и кетонам
В
кислой среде a,
b–ненасыщенные альдегиды и
кетоны присоединяют воду по связи С=С против правила Марковникова. Однако
первичным взаимодействием в этой реакции является 1,4–присоединение.
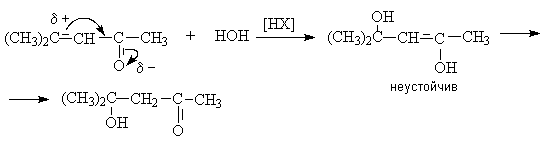
Аналогично идет присоединение кислот НХ.
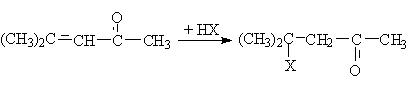
3. Реакции нуклеофильного присоединения
а)
взаимодействие с Mg–органическими соединениями
Альдегиды и кетоны ведут себя по разному с Mg–органическими соединениями. Альдегиды присоединяют их по >C=O связи, как и насыщенные альдегиды.
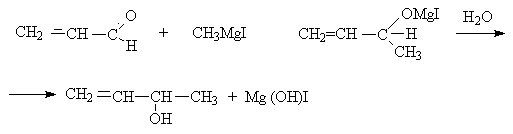
Кетоны реагируют по типу 1,4-присоединения.
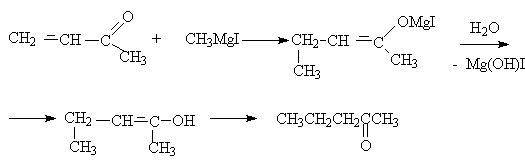
б) присоединение аммиака и аминов идет по типу 1,4–присоединения, которое в
силу неустойчивости интермедиатов превращается в продукт 3,4–присоединения.
в) присоединение триалкилборатов. Эта реакция приводит к образованию b -алкил- замещенных насыщенных альдегидов
или кетонов.
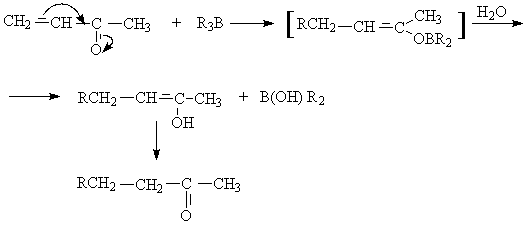
г) присоединение литийорганических соединений.
В отличие от триалкилборатов литийорганические соединения реагируют по типу присоединения по карбонильной группе:
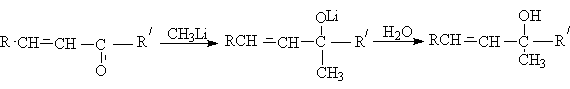
д) присоединение медь-органических соединений
Медь–oрганические соединения присоединяются по типу 1,4–присоединения.
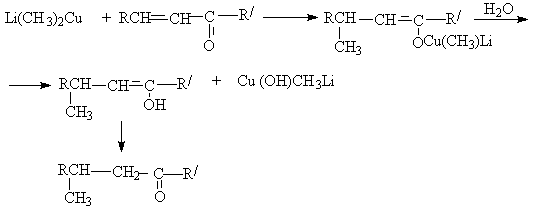
е) реакции Михаэля – сопряженное присоединение нуклеофилов к a,b -
ненасыщенным системам.
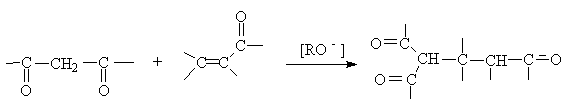
Механизм:
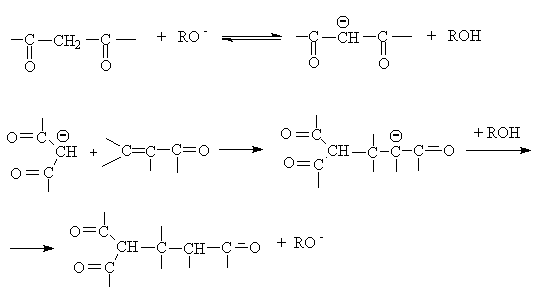
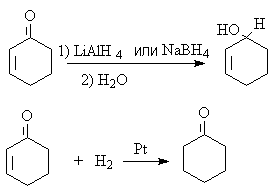
Восстановление a,b-ненасыщенных соединений осуществляется в
разных направлениях в зависимости от типа восстановителя.
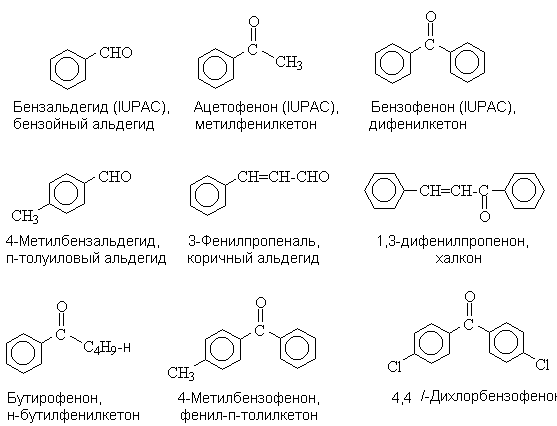
Ароматические альдегиды и кетоны
- Классификация и
номенклатура
Различают
следующие типы карбонильных соединений аренов.
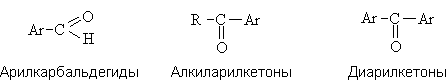
При составлении названий ароматических карбонильных соединений используют
заместительную номенклатуру IUPAC, рациональную номенклатуру и тривиальные
названия.