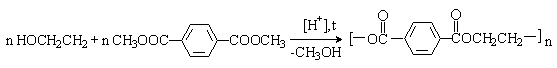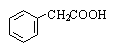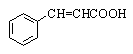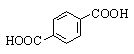Лекция
№38
Двухосновные, ненасыщенные и аренкарбоновые кислоты
План
Дикарбоновые
кислоты
Эти
соединения могут рассматриваться как результат замещения двух атомов водорода в
углеводородах на карбоксильные группы.
Дикарбоновые кислоты можно подразделить на три группы, в зависимости от
характера углеводородного остатка – насыщенные, ненасыщенные и арендикарбоновые
кислоты.
Методы получения насыщенных дикарбоновых кислот
- Окисление a , w -диолов.
![]()
В качестве окислителей можно использовать KMnO4 в нейтральной или кислой среде или K2Cr2O7 в кислой среде.
- Окисление циклоалкенов.
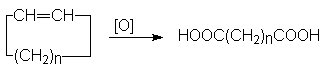
Реакцию проводят при повышенных температурах, используя в качестве окислителей
KMnO4 или K2Cr2O7 в кислой среде.
- Окисление циклических
кетонов.
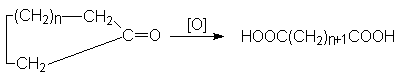
Окислители – те же, что и при окислении циклоалкенов. Температура 100-120оС.
- Гидролиз динитрилов
карбоновых кислот.
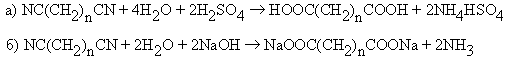
- Карбонилирование a, w -диолов.
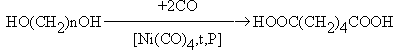
Свойства
дикарбоновых кислот
Кислотные свойства
Каждая карбоксильная группа действует на другую как электроноакцептор, повышая ее кислотность, причем с увеличением расстояния между карбоксильными группами их кислотность падает.
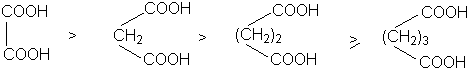
В
силу быстрого затухания индуктивного эффекта различие в кислотностях
дикарбоновых кислот с ростом длины полиметиленовой кислоты возрастает.
Вторая константа кислотности дикарбоновых кислот ниже, чем первая, поскольку карбоксилат-анион обладает +I – эффектом.
Наиболее важными среди дикарбоновых кислот являются щавелевая, малоновая, янтарная, глутаровая (этан-, пропан-, бутан- и пентандикарбоновая).
Щавелевая кислота – НООС-СООН, бесцветное кристаллическое вещество, растворимое в воде и спиртах и труднорастворимое в углеводородах.
Специфическим способом получения щавелевой кислоты является нагревание формиата натрия.
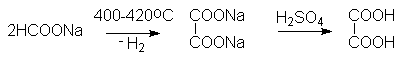
Специфическими реакциями щавелевой кислоты являются разложение в присутствии концентрированной серной кислоты и окисление:
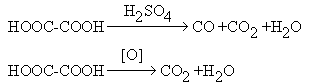
Щавелевую кислоту используют как протраву при крашении тканей и как аналитический агент. Возможно ее использование для получения полиэфиров. Из производных щавелевой кислоты интерес представляет диэтилоксалат С2Н5ООС-СООС2Н5. Для него характерны многие реакции сложных эфиров. Он вступает в реакцию сложноэфирной конденсации (см. конденсацию по Клайзену) в качестве реагента, не содержащего подвижные атомы водорода (см. синтезы на основе ацетоуксусного эфира). Подобный же вид конденсации протекает при взаимодействии диэтилоксалата с кетонами.
Малоновая кислота
НООС(СН2)СООН – бесцветное кристаллическое вещество, растворимое в воде.
Специфичный способ получения – из хлоруксусной кислоты
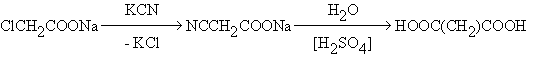
Малоновая кислота легко декарбоксилируется при нагревании выше 133-135оС или при кипячении водных растворов в присутствии кислот.
![]()
Малоновая кислота содержит очень активную метиленовую группу с подвижными атомами водорода. Поэтому малоновая кислота и ее эфиры вступают в реакции конденсации, протекающие по карбанионному механизму:
а) конденсация с альдегидами и кетонами (реакция Кневенагеля):
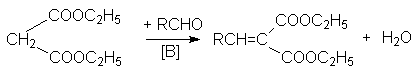
б) реакция Михаэля – сопряженное присоединение к a , b -ненасыщенным системам:
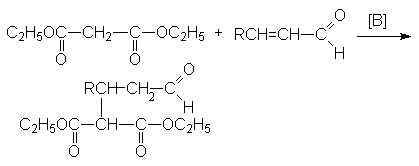
Янтарная кислота – HOOC(CH2)2COOH – бесцветное кристаллическое вещество, растворимое в воде и спиртах.
В промышленности ее получают гидрированием малеиновой кислоты
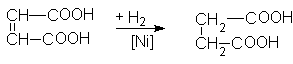
и карбонилированием этиленгликоля
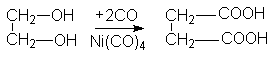
Для янтарной кислоты характерны все реакции карбоксильной группы. Особенность янтарной кислоты – способность к циклизации. Наиболее важными реакциями циклизации являются образование янтарного ангидрида
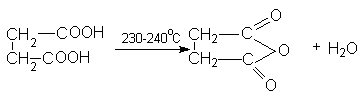
и сукцинимида:
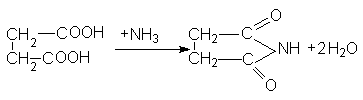
Важным производным сукцинимида является бромсукцинимид, который используется для окисления и бромирования органических соединений (см. аллильное бромирование алкенов).
Получается бромсукцинимид путем бромирования сукцинимида в присутствии щелочей.
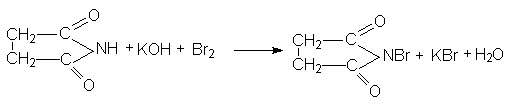
Молекула янтарной кислоты содержит две активированные метиленовые группы. Их активность уступает активности метиленовой группы в малоновой кислоте, но достаточна для осуществления реакций галогенирования и конденсации с альдегидами и кетонами в более жестких условиях.
Янтарная кислота и ее эфиры - исходные вещества для получения полиэфирных волокон и лекарственных веществ.
Адипиновая кислота.
Получается окислением циклогексанона азотной кислотой:
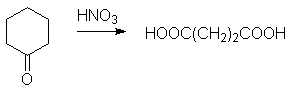
и карбонилированием 1,4-бутандиола и тетрагидрофурана:
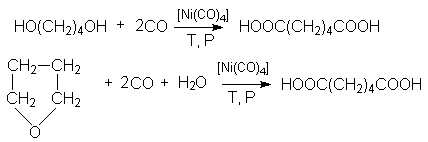
Адипиновая кислота используется для получения волокна найлон.
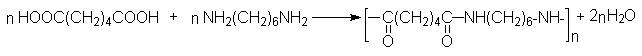
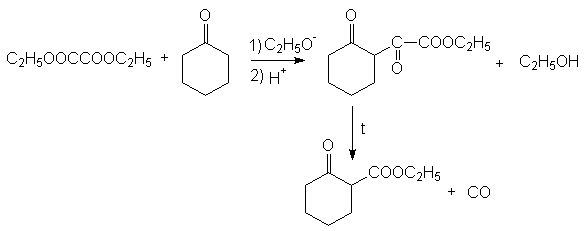
Эфиры адипиновой кислоты и ее ближайших гомологов используются для получения средних и больших циклов. В этом плане важными синтезами являются:
Ацилоиновая конденсация:
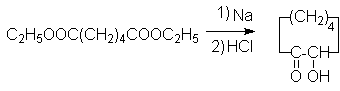
Конденсация по Дикману:
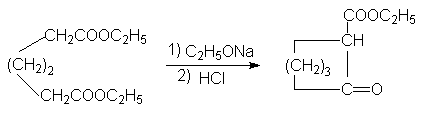
Механизм последней реакции подобен механизму конденсации по Кляйзену
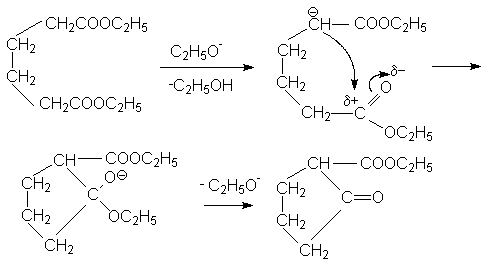
a ,b - Непредельные карбоновые кислоты.
Методы синтеза
- Дегидратация b -оксикислот
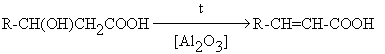
- Дегидрогалогенирование
солей галогенкарбоновых кислот
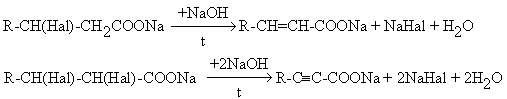
с последующим подкислением продуктов реакции.
- Гидрокарбоксилирование
алкинов
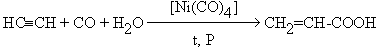
- реакция Кневенагеля
![]()
- реакция Виттига
(взимодействие альдегидов с алкоксикарбонилфосфоранами)
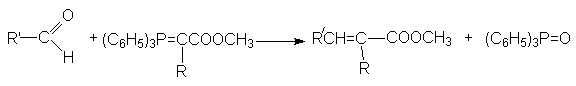
Химические свойства
Подобно
алкенам двойные связи a
,b - ненасыщенных кислот могут
присоединять бром, эпоксидироваться , гидробромироваться , хотя эти реакции
оказываются более медленными по сравнению с соответствующими реакциями алкенов,
что связано с дезактивирующим действием карбоксильной группы.
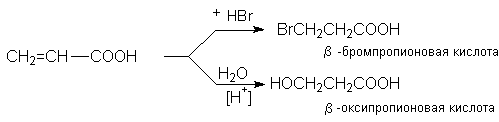
Присоединение воды, HBr и других реагентов, имеющих подвижный водород, идет против правила Марковникова
Первый акт взаимодействия связан с протонированием карбонильного кислорода, приводящего к образованию положительно заряженного реакционного центра на b - углеродном атоме:
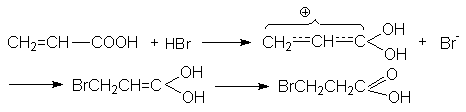
Присоединение галогенов идет стерeоспецифично через образование неклассического циклического катиона с последующим присоединением галогенид-аниона в транс-положение
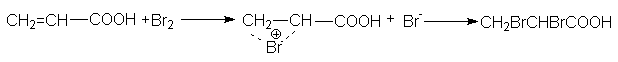
Эпоксидирование происходит с сохранением конфигурации алкена: из цис-алкенов образуются цис-эпоксиды, из транс-алкенов – транс-эпоксиды, например
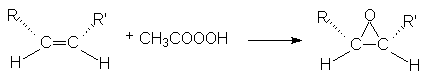
Ненасыщенные дикарбоновые кислоты
Важнейшими из соединений этого ряда являются малеиновая кислота и фумаровая кислота, которые относятся друг к другу как цис- и транс- изомеры.
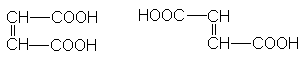
Малеиновая кислота получается каталитическим парофазным окисление бензола и бутена –2.
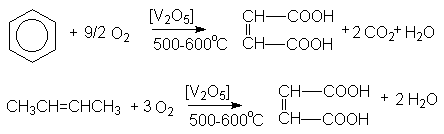
Фумаровая кислота получается фотохимической изомеризацией малеиновой кислоты.
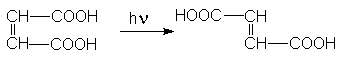
Фумаровая и малеиновая кислоты могут использоваться в качестве сырья для получения полиэфирных волокон.
![]()
Аренкарбоновые кислоты
Классификация, номенклатура, изомерия.
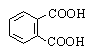
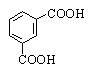
Аренкарбоновые кислоты содержат карбоксильную группу в ароматическом кольце
или боковой цепи. По количеству карбоксильных групп различают моно-, ди- и
поликарбоновые кислоты. Примеры номенклатуры аренкарбоновых кислот и их
замещенных приведены в таблице.
|
Формула |
Тривиальное
название |
Систематическое
название |
|
|
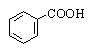
Бензойная |
Бензолкарбоновая |
|
|
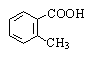
о-Толуиловая |
2-Метилбензойная |
|
|
Фенилуксусная |
Фенилэтановая |
|
|
Коричная |
3-Фенилпропеновая |
|
|
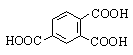
Фталевая |
1,2-Бензолдикарбоновая |
|
|
Изофталевая |
1,3-Бензолдикарбоновая |
|
|
Терефталевая |
1,4-Бензолдикарбоновая |
|
|
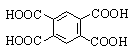
Тримеллитовая |
1,2,4-Бензолтрикарбоновая |
|
|
Пиромеллитовая |
1,2,4,5-Бензолтетракарбоновая |
|
|
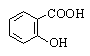
Салициловая |
2-Гидроксибензойная |
|
|
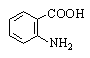
Антраниловая |
2-Аминобензойная |
Аренмонокарбоновые кислоты
1. Методы получения
1)Реакции окисления
Аренкарбоновые кислоты, содержащие карбоксильую группу, связанную с
ароматическим кольцом, получают окислением алкиларенов (см. лекцию №17).
![]()
В качестве окислителей используют KMnO4, Na2Cr2O7, кислород в присутствии солей Co и Mn.
Метилкетоны также могут быть окислены в кислоты, лучше всего действием галогенов в щелочной среде (галоформная реакция):
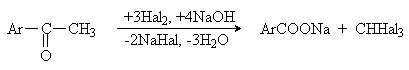
2) Реакции гидролиза
Наиболее широко используют гидролиз нитрилов, которые могут быть получены из
галогенаренов или солей арилдиазония:
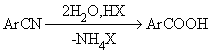
3) Карбоксилирование магний- и литийорганических соединений
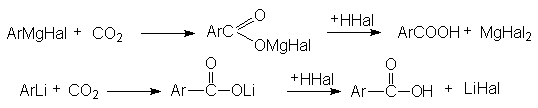
4) Карбоксилирование фенолятов (реакция Кольбе-Шмидта)
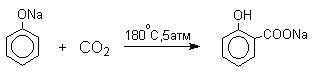
2. Физические свойства и строение
Аренмонокарбоновые
кислоты – бесцветные кристаллические вещества.
Бензольное кольцо и карбоксильная группа образуют сопряженную систему. Карбоксильная группа действует как электроноакцептор (-I и –M-эффекты).
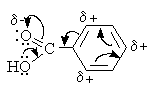
3. Химические свойства
Реакции
аренкарбоновых кислот по карбоксильной группе аналогичны соответствующим
превращениям алифатических карбоновых кислот.
Кислотные свойства
Аренкарбоновые кислоты превышают по кислотности насыщенные и a ,b -непредельные карбоновые кислоты. На силу аренкарбоновых кислот влияет природа и положение заместителя в ароматическом кольце. Это влияние согласуется с электронными эффектами заместителей.
Значения рКа для замещенных бензойных кислот X-C6H4-COOH.
|
X |
CH3 |
F |
Cl |
Br |
I |
OH |
OCH3 |
NO2 |
|
Положение |
|
|||||||
|
мета |
4,24 |
3,86 |
3,83 |
3,81 |
3,86 |
4,08 |
4,09 |
3,45 |
|
пара |
4,34 |
4,14 |
3,99 |
4,00 |
3,92 |
4,58 |
4,47 |
3,43 |
Для бензойной кислоты рКа=4,17.
Таким образом, заместители, проявляющие –М- и –I-эффекты (NO2), увеличивают кислотность, причем из пара-положения в большей степени, чем из мета-положения. Заместители с +М-эффектом, превышающим –I-эффект (OH, OCH3), из пара-положения уменьшают, а из мета-положения увеличивают кислотность. Заместители с –I-эффектом, превышающим +М-эффект (галогены), увеличивают кислотность, причем из мета-положения в большей степени, чем из пара-положения.
При оценке влияние положения заместителя на кислотность следует иметь в виду, что пара-положение находится в сопряжении с карбоксильной группой, что обеспечивает влияние мезомерного эффекта заместителя, находящегося в этом положении, на кислотный центр. Из мета-положения М-эффект заместителя передается только на атомы углерода ароматического кольца.
Реакции замещения в ароматическом кольце
Аренкарбоновые кислоты вступают в реакции с электрофилами с образованием продуктов электрофильного замещения (нитрования, сульфирования, галогенирования) в бензольном кольце. Реакции протекают в жестких условиях, заместитель вступает преимущественно в мета-положение к карбоксильной группе.
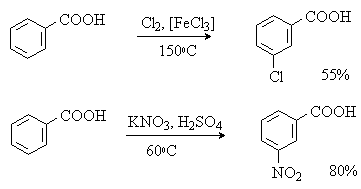
4. Важнейшие представители
Бензойная килота и ее производные.
Бензойная
кислота
– бесцветное
кристаллическое вещество, легко возгоняется. В промышленности ее получают
окислением толуола кислородом в присутствии бензоатов Co и Mn. Обладает всеми
свойствами монокарбоновых кислот. Используется как исходное вещество в синтезе
красителей, душистых веществ, лекарственных препаратов. Обладает бактерицидными
свойствами. Используется как консервант пищевых продуктов.
Бензоилхлорид – высококипящая бесцветная жидкость, лакриматор. Бензоилхлорид получают:
- из бензойной кислоты и фосгена
![]()
- неполным гидролизом бензтрихлорида
![]()
- хлорированием бензальдегида
![]()
Используется
как бензоилирующий агент. Хлорангидриды ароматических карбоновых кислот
обладают большей устойчивостью к гидролизу, чем их алифатические аналоги.
Поэтому бензоилирование спиртов и аминов бензоилхлоридом проводят по методу
Шоттен-Баумана – в присутствии водного раствора щелочи, которая является
акцептором образующейся в реакции соляной кислоты:
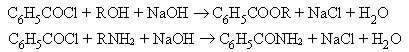
Процесс ацилирования в случае бензоилхлорида и других ароилхлоридов протекает быстрее, чем процесс их гидролиза.
Бензоилированием пероксида водорода по методу Шоттен-Баумана получают бензоилпероксид:
![]()
Бензоилпероксид представляет интерес как инициатор свободно-радикальных процессов, так как при нагревании претерпевает распад по схеме:
![]()
Пероксибензойная кислота – бесцветное кристаллическое вещество, слабо растворимо в воде. Получают ацилированием пероксида водорода бензойной кислотой в присутствии минеральной кислоты:
![]()
Пероксибензойную кислоту используют в органическом синтезе для эпоксидирования алкенов. м-Хлорпероксибензойную кислоту применяют для окисления ариламинов в ароматические нитросоединения.
Арендикарбоновые кислоты
1. Методы получения
Основной метод получения – окисление диметиларенов.
Фталевую кислоту в виде ангидрида в промышленности получают окислением о-ксилола или нафталина кислородом воздуха в присутствии катализаторов на основе V2O5-TiO2 при 350-4000С:
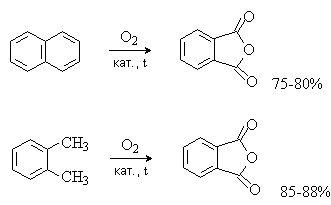
Терефталевую кислоту получают окислением п-ксилола кислородом в уксусной кислоте в присутствии солей Co и Mn:
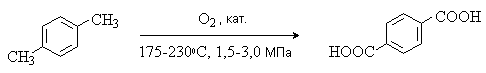
Другой промышленный метод получения терефталевой кислоты – изомеризация дикалиевой соли о-фталевой кислоты:
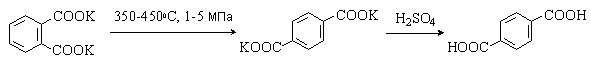
2. Химические свойства
Химические
свойства арендикарбоновых кислот в основном аналогичны свойствам монокарбоновых
кислот. Они дают все реакции, характерные для карбоксильной группы.
Арендикарбоновые кислоты по первой ступени являются более сильными кислотами,
чем монокарбоновые:
|
|
рКа1 |
рКа2 |
|
Бензойная
кислота |
4,17 |
- |
|
Фталевая
кислота |
2,95 |
5,41 |
|
Изофтелевая
кислота |
3,46 |
4,46 |
|
Терефталевая
кислота |
3,51 |
4,82 |
3. Важнейшие представители
Фталевая
кислота и ее производные
Фталевая кислота – бесцветное кристаллическое вещество, мало растворима в воде. При нагревании в присутствии дегидратирующих агентов легко превращается во фталевый ангидрид:
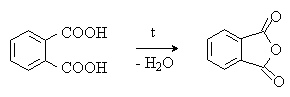
Практическое применение имеют производные фталевой кислоты – ангидрид, имид, сложные эфиры.
Фталевый ангидрид – бесцветное кристаллическое вещество, легко возгоняется.
При взаимодействии со спиртами в присутствии серной кислоты дает сложные моно- и диэфиры:
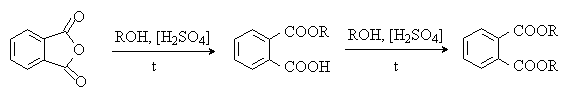
Диалкиловые эфиры фталевой кислоты (диалкилфталаты) используют как пластификаторы полимеров, высококипящие растворители, репелленты.
С многоатомными спиртами фталевый ангидрид образует полиэфиры. Например, на основе фталевого ангидрида и глицерина получают алкидные (глифталевые) смолы:
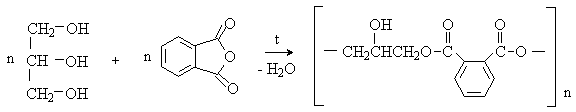
С аммиаком и первичными аминами фталевый ангидрид в зависимости от условий дает фталиминовую кислоту, фталимид или диамид фталевой кислоты:
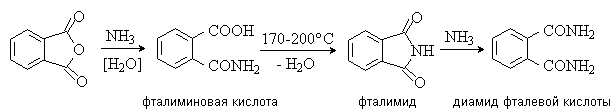
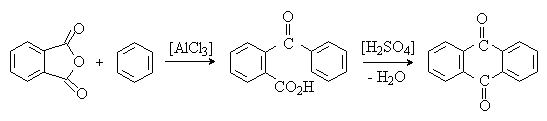
Ацилирование фталевым ангидридом бензола и алкилбензолов приводит к о-ароилбензойным кислотам и далее к антрахинонам:
При конденсации фталевого ангидрида с фенолами образуются производные
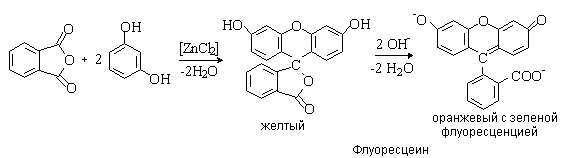
трифенилметана, которые называют фталеинамина. Их используют как индикаторы и
красители (фенолфталеин, флуоресцеин):
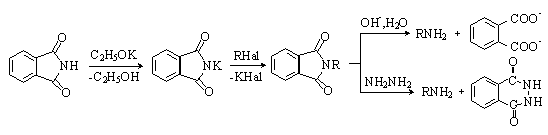
Фталимид – бесцветное кристаллическое вещество, легко возгоняется.
Фталимид является NH-кислотой (рКа=9,9). Он растворяется в водных растворах щелочей. При этом происходит его постепенный гидролиз с раскрытием цикла и образованием фталиминовой кислоты. В безводных средах под действием оснований образуются соли фталимида, которые используются в органическом синтезе для получения первичных аминов (синтез Габриэля):
Терефталевая кислота – бесцветное кристаллическое вещество, мало растворима в воде и органических растворителях. Крупнотоннажный промышленный продукт. Её диметиловый эфир (диметилтерефталат) используется для получения полиэтилентерефталата, который применяют для изготовления синтетического волокна лавсан: