Лекция
№43
ДИАЗОСОЕДИНЕНИЯ
План
Диазосоединения
содержат группу N2, причем один атом азота связан с органическим
радикалом, а другой - с гетероатомом. Ароматические и алифатические
диазосоединения сильно различаются по строению, стабильности и реакционной
способности.
1. Ароматические диазосоединения
Классификация и номенклатура
Ароматические диазосоединения имеют общую формулу ArN2X. В зависимости от типа связи между фрагментамиArN2 и X различают следующие типы диазосоединений.
Соединения, содержащие ионную связь (соли диазония):
ArN2+X-
X- – анион сильной кислоты с низкой нуклеофильностью, в том числе комплексный ион (Cl-, Br- HSO4-, BF4-, SbF6-, PF6-), например:

Соединения, содержащие ковалентную связь:
Ar-N=N-X
X= -CN, -OCOCH3,
-I, -SO3H, -OH, -OAr, -NH-Ar
Например:
|
C6H5-N=N-CN |
C6H5-N=N-OH |
C6H5-N=N-O-
Na+ |
|
бензолдиазоцианид |
бензолдиазогидроксид |
бензолдиазотат
натрия |
Основной тип ароматический диазосоединений – соли арендиазония.
Методы получения солей арендиазония
Основной метод получения солей арендиазония – диазотирование. Процесс диазотирования выражается следующим суммарным уравнением.
ArNH2 + NaNO2
+ 2 HX ® ArN+=N X - +
NaX + 2 H2O
(X= Cl, HSO4, BF4 и др.)
Механизм реакции диазотирования
Механизм включает cтадии нитрозирования амина. Нитрозирующими агентами являются соединения общей формулы O=N-X. Сама азотистая кислота (X=OH) является слишком слабым электрофильным реагентом, поэтому для ускорения процесса требуется присутствие сильной кислоты, в водном растворе которой азотистая кислота частично протонируется с образованием очень активного электрофильного агента - нитрозацидий-катиона:
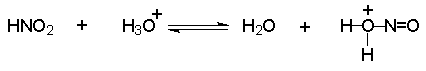
Этот катион гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с амином. В результате образуются новые нитрозирующие реагенты: азотистый ангидрид, хлористый или бромистый нитрозил.
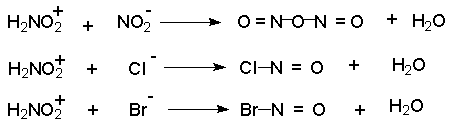
В разбавленных водных растворах серной, фосфорной, хлорной и других кислот с малонуклеофильными анионами нитрозирующим агентом является азотистый ангидрид N2O3 . При диазотировании в растворах HCl и HBr электрофильными агентами являются соответственно NOCl и NOBr. В сильно кислой среде активной частицей является, вероятно, катион H2NO2+. Наиболее активный нитрозирующий агент - нитрозилсерная кислота получается при взаимодействии нитрита натрия с концентрированной серной кислотой.
2 H2SO4
+ NaNO2 --- O=N-OSO3H + NaHSO4 + H2O
Диазотирование всегда проводят в кислой среде, где протолитическое равновесие сильно смещено вправо.
![]()
Тем не менее диазотированию подвергается амин в виде свобoдного основания.
Механизм диазотирования включает образование нитрозамина, таутомерное превращение его в диазогидроксид, протонированная форма которого отщепляет молекулу воды с образованием катиона диазония.
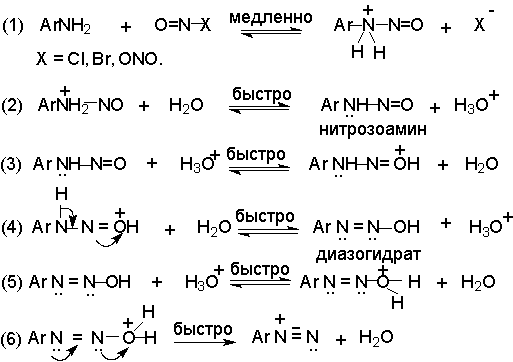
Лимитирующей стадией процесса является образование катиона N-арилнитрозоаммония. Далее следует ряд быстрых протолитических равновесий. На стадии (4) происходит отщепление протона от азота или кислорода, поскольку исходный катион формально является аналогом аллильного катиона. Депротонирование кислорода приводит к исходному субстрату - нитрозамину, тогда как депротонирование азота ведет к образованию конечного продукта - соли арендиазония.
Условия проведения реакции диазотирования
Диазотирование - экзотермическая реакция, сопровождающаяся выделением большого количества теплоты, поэтому процесс проводят при охлаждении, поддерживая температуру в интервале 0-5о, чтобы не допустить разложения термически неустойчивой соли арендиазония.
В реакции используют избыток минеральной кислоты, так чтобы по окончании диазотирования рН не превышал 0,5-1,5. Высокая кислотность среды необходима для подавления побочных процессов с участием образующегося катиона арендиазония и исходного ароматического амина.
азосоединение
В
растворе с низким значением рН резко снижается концентрация свободного амина и
тем самым подавляются оба нежелательных процесса с его участием.
От кислотности среды зависит скорость процесса диазотирования. С увеличением кислотности растет концентрация образующихся из азотистой кислоты активных нитрозирующих агентов, что должно приводить к увеличению скорости. Однако одновременно снижается концентрация свободного амина, что замедляет реакцию. Для успешного проведения процесса необходимо поддерживать оптимальную концентрацию кислоты, соизмеряя ее с основностью амина.
Диазотирование осуществляется четырьмя основными методами, выбор каждого из которых определяется природой исходного амина.
1. Метод "прямого" диазотирования применим для диазотирования анилина, алкил-, галоген - и алкоксианилинов. Раствор одного эквивалента нитрита натрия при охлаждении до 0 - 5о постепенно добавляют к водному раствору одного эквивалента амина с тремя эквивалентами сильной минеральной кислоты.
2. "Обратный" метод диазотирования используют для плохо растворимых в кислотах аминов, например, сульфаниловой и антраниловой кислот, для которых характерно образование внутренних солей. В этом случае щелочной раствор диазотируемого амина и нитрита натрия постепенно вводят в водный раствор охлажденной до +5о разбавленной минеральной кислоты.
3. Для диазотирования аминофенолов, которые легко окисляются азотистой кислотой, реакцию проводят с добавлением солей меди, препятствующих окислению амина.
4. Для диазотирования слабоосновных аминов, содержащих одну или несколько нитрогрупп, три- или тетрагалогенанилинов (Hal=Cl,Br), амин растворяют в смеси концентрированных H2SO4 - H3PO4 или H2SO4 - CH3COOH и полученный раствор при охлаждении прибавляют к нитрозилсерной кислоте.
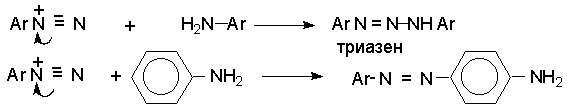
Полученный одним из описанных выше методов водный раствор соли диазония сразу используют для дальнейших превращений. Предварительно следует убедиться в полноте протекания диазотирования, т.е. проверить отсутствие в реакционной массе непрореагировавших исходных веществ. При добавлении к порции диазораствора ацетата натрия, снижающего кислотность среды, при наличии исходного амина образуется триазен – нерастворимый в воде оранжевый осадок.
![]()
Азотистую кислоту обнаруживают с помощью иодкрахмальной бумаги. Избыток азотистой кислоты удаляют добавлением мочевины до прекращения выделения газообразных продуктов из реакционной смеси.
Физические свойства и строение
Соли арендиазония – бесцветные кристаллические вещества. Хлориды, гидросульфаты и нитраты хорошо растворимы в воде и используются в основном в виде водных растворов. В твердом виде они неустойчивы и взрываются от трения и от нагревания. Соли арендиазония с некоторыми комплексными анионами (PF6-, SbF6-, BF4-) нерастворимы в воде и достаточно стабильны при хранении их в сухом виде в течение длительного времени.
В целом соли арендиазония гораздо устойчивее алифатических аналогов, что обусловлено стабилизирующим влиянием p -системы ароматического ядра, которое участвует в делокализации положительного заряда.
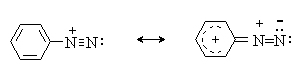
Электронодонорные заместители в о- и п-положениях обеспечивают дополнительную стабилизацию арендиазониевого катиона.
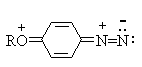
Сама диазониевая группа может быть представлена набором из двух резонансных структур.
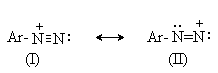
Наибольший вклад в резонанс вносит структура (I). По данным рентгеноструктурного анализа связь азот-азот по длине соответствует тройной (0,11 нм). ИК-спектры содержат полосу поглощения в области 2100-2300 см-1, что соответствует валентным колебания связи Nº N. Второй атом азота несет частичный положительный заряд (структура (II)) и является электрофильным центром в реакциях диазониевых солей.
Диазониевая группа является сильнейшим электроноакцептором и превосходит в
этом отношении нитрогруппу.
Химические свойства
1. Равновесия между различными формами диазосоединений в
водных растворах. Образование и строение диазотатов
Форма
существования диазосоединений в растворе зависит от рН. Катионы диазония могут
существовать в кислой среде и в средах, близких к нейтральной. При обработке
растворов солей диазония щелочью образуются диазотаты.
ArN2+X- + 2NaOH ® Ar-N=N-O- Na+ + NaX + H2O
Процесс протекает в две стадии. Сначала катион диазония, как кислота Льюиса, взаимодействует с гидроксид-ионом с образованием диазогидроксида, который, будучи кислотой Бренстеда, быстро реагирует с еще одним эквивалентом щёлочи с образованием диазотат- аниона
![]()
![]()
Для приведенных выше равновесий К2>К1, поэтому концентрация диазогидрата в водном растворе очень мала.
Диазотат-анионы существуют в анти- и син-формах. При взаимодействии катиона арендиазония со щелочью первоначально образуется менее стабильный син-диазотат, который медленнно изомеризуются в более стабильную анти-форму. Изомеризацию ускоряет нагревание и присутствие в бензольном кольце электроноакцепторных групп. Обратная изомеризация наблюдается только при УФ облучении.
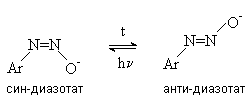
Диазотат-ионы являются амбидентными ионам с двумя нуклеофильными центрами - кислородом и азотом. анти-Диазотат протонируется исключительно по атому азота с образованием N-нитрозоамина.
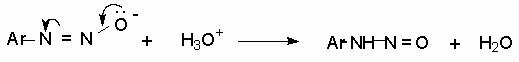
Далее N-нитрозоамин в кислой среде медленно превращается в катион арендиазония, как это было описано ранее в соответствии со стадиями (2 - 6) при обсуждении механизма диазотирования.
син-Диазотаты при протонировании образуют диазогидраты в результате протонирования по кислороду. Диазогидрат далее очень быстро превращается в кислой среде в катион арендиазония.
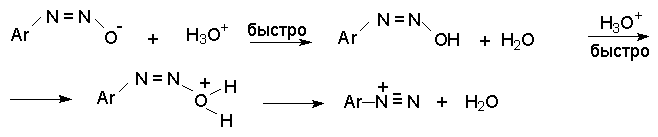
Общую схему протолитических превращений ароматических диазосоединений в водном растворе можно представить следующим образом.
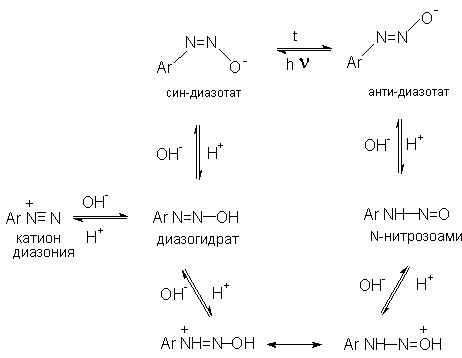
2. Реакции солей арендиазония
Все реакции солей диазония можно разделить на четыре большие группы, различающиеся по механизму взаимодействия катиона диазония с нуклеофильным агентом Х-.
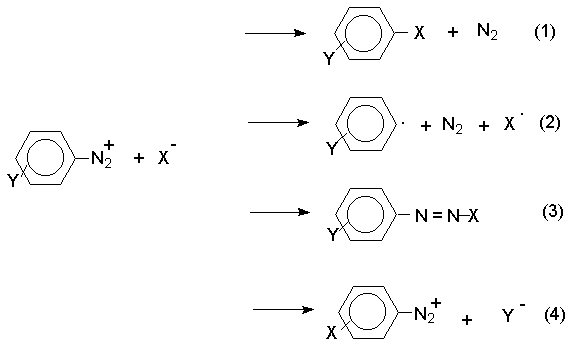
Реакции типа (1) и (4) - нуклеофильное ароматическое замещение. В реакциях группы (1) имеет место замещение самой диазогруппы. В реакциях типа (4) диазогруппа, как очень сильный акцептор, активирует нуклеофильное замещение группы Y в орто- или пара-положении к диазогруппе. В реакциях группы (2) происходит радикальный распад соли диазония. Образующийся при этом арильный радикал Ar претерпевает затем дальнейшее превращение. Третий тип реакций предполагает атаку нуклеофильным агентом крайнего атома азота диазониевого катиона.
По формальному признаку реакции солей диазония можно разделить на две большие группы: реакции идущие с выделением (1,2) и без выделения (3,4) азота.
Реакции, идущие с выделением азота
Замещение диазогруппы – один из основных методов введения заместителей в ароматическое кольцо. Замещение протекает как по гетеролитическому, так и по гомолитическому механизму. Характер разрыва связи углерод-азот в катионе арендиазония зависит прежде всего от природы нуклеофильного агента. Гетеролиз связи С-N имеет место при взаимодействии с жесткими нуклеофильными агентам - водой, фторид-ионом и при проведении реакции в растворителях с электрофильными или малонуклеофильными свойствами. Гомолитическому расщеплению связи углерод-азот благоприятствует рост нуклеофильных свойств растворителя и использование мягких нуклеофильных агентов (J- , SCN-). Все эти анионы относятся к сильным восстановителям, что облегчает перенос одного электрона от реагента к катиону диазония. Эту же функцию в отдельных случаях может выполнять и растворитель.
Для многих реакций переход от гетеролитического к гомолитическому механизму происходит очень легко при введении в раствор солей одновалентной меди.
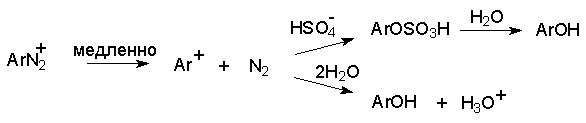
а) Замещение диазогруппы на гидроксил.
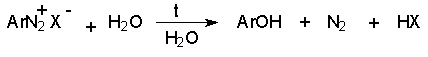
Реакцию обычно проводят путем разложения соли диазония в 40-50 %-ном растворе серной кислоты. Реакция протекает как процесс мономолекулярного ароматического нуклеофильного замещения (SN1). Для получения фенолов используют соли диазония с малонуклеофильными или комплексными анионами (X=HSO4-, BF4-), что избежать образования продуктов арилирования противоиона промежуточно образующимся арилкатионом. Образующийся из Ar+ и HSO4- эфир серной кислоты ArОSO3H в условиях реакции гидролизуется до фенола. Как во всех процессах SN1 - типа стадия, определяющая скорость реакции, и стадия, определяющая состав продуктов реакции, не совпадают.
б) Замещение диазогруппы на фтор (реакция Шимана).
Замещение диазогруппы на фтор происходит при термическом разложении тетрафторборатов арендиазония.
ArN2 +BF4 - ® ArF + N2 + BF3
Реакция протекает, вероятно, через промежуточное образование арилкатиона.
Выходы арилфторидов сильно колеблются в зависимости от природы заместителя в
бензольном кольце арендиазокатиона. Увеличению выхода способствует наличие в
бензольном кольце электронодонорных заместителей. Реакция Шимана – один из основных
методов введения фтора в ароматическое кольцо.
с) Замещение диазогруппы на иод
ArN2 +X - + KI ® ArI + N2 + KX
Замещение диазогруппы на йод осуществляется по принципиально иному механизму и представляет собой ион-радикальный процесс, в котором иодид-ион выступает в роли одноэлектронного восстановителя.
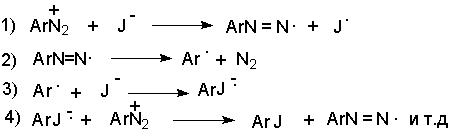
В препаративном отношении это одна из самых простых реакций ароматических диазосоединений.
д) Замещение диазогруппы на хлор-, бром-, циан- и нитрогруппу (реакция Зандмейера).
Выходы арилхлоридов, арилбромидов и арилцианидов в реакциях солей арендиазония с хлорид-, бромид- и цианид-ионами в отсутствие катализаторов невелики и редко превышают 20%. Для получения этих соединений используют реакцию Т. Зандмейера, который обнаружил, что такое замещение эффективно катализируется солями меди (I). Для введения хлора и брома используют раствор галогенида меди (I) в соответствующей галогеноводородной кислоте.
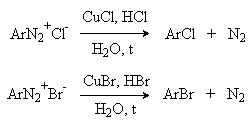
Для введения цианогруппы нейтральный раствор соли диазония смешивают с раствором комплексного цианида.
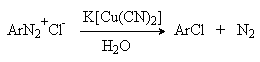
Механизм реакции Зандмейера достоверно не установлен. Считается, что катион меди (I) выступает в роли восстановителя катионов диазония, поскольку сами ионы Cl- и Br- в отличие от иодид-ионов трудно окисляются. Образующиеся при одноэлектронном восстановлении арилрадикалы Ar или арилдиазорадикалы Ar - N = N далее окисляются солью двухвалентной меди. Предполагают, что радикалы образуются и реагируют в реакционном комплексе соль диазония–соль меди и в растворе как кинетически независимые частицы не появляются.
![]()
Вместо солей меди (I) может использоваться медный порошок (реакция Гаттермана). Метод дает особенно хорошие результаты при замене диазогруппы в тетрафторборатах или гексафторфосфатах арендиазония на нитрогруппу.
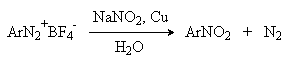
е) Замещение диазогруппы на водород (дезаминирование первичных ароматических аминов).
Замещение диазогруппы на водород происходит при действии восстановителей. В качестве восстановителей используют спирты.
ArN2+X- + RCH2OH ® ArH + R-CH=O + N2 + HX
Реакция протекает по цепному радикальному механизму.
Зарождение цепи:
ArN2+ + CH3OH ® ArN2. + CH3OH.+
ArN2. ® Ar. + N2
CH3OH. + ®.CH2OH + H+
Развитие цепи :
Ar. + CH3OH ® ArH + .CH2OH
.CH2OH + ArN2+® ArN2.
+ CH2OH+
т.е. (H2-C=O+H)
CH2OH+
® H-C(H)=O + H+
ArN2. ® Ar . + N2 и т.д.
Параллельно протекает замещение диазозогруппы на алкоксильную.
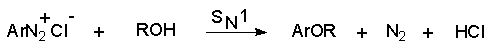
Эта реакция, также как и взаимодействие катиона диазония с водой, протекает по гетеролитическому мономолекулярному механизму. Соотношение продуктов в двух конкурирующих процессах - гетеролитическом и гомолитическом - зависит от природы заместителя в бензольном кольце катиона арендиазония и от рН среды. Протеканию гомолитического процесса восстановления способствует наличие электроноакцепторных заместителей в ароматическом кольце и среда, близкая к нейтральной, в которой доминируют гомолитические процессы разложения ковалентных форм диазосоединений. В общем же случае образуется смесь эфира фенола и углеводорода, поэтому восстановительное дезаминирование осуществляют другими методами.
Универсальным восстановителем при замещении диазогруппы на водород является фосфорноватистая кислота H3PO2.
![]()
Замещение дизогруппы на водород широко применяется в органическом синтезе, так как позволяет получать арены, которые трудно или вообще невозможно синтезировать другими методами.
ж) Получение биарилов (реакция Гомберга - Бахмана).
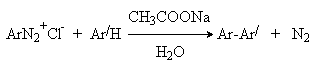
При разложении солей диазония в слабощелочной среде в присутствии аренов образуются биарилы. Процесс протекает через промежуточное образование арилрадикалов и является примером радикального ароматического замещения. Реакция используется для синтеза несимметричных биарилов.
Реакции, идущие без выделения азота
а) Реакция азосочетания
Соли диазония реагируют с фенолами и ароматическими аминами с образованием ярко окрашенных азосоединений.
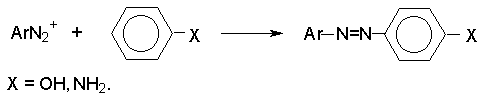
Азосочетание относится к типичным реакциям электрофильного ароматического замещения, скорость которых зависит от электрофильных свойств катиона диазония (диазосоставляющей) и от электронодонорных свойств ArX (азосоставляющей).
Катион арендиазония относится к числу слабых электрофильных агентов, так как его положительный заряд делокализован за счет сопряжения с ароматическим кольцом. Как слабый электрофильный катион диазония взаимодействует только с такими производными бензола и нафталина, которые содержат сильные электронодонорные заместители.
Реакционная способность азосоставляющей уменьшается в ряду:
X = O- > NR2
> NHR > NH2 > OH~OR >> Alk.
Реакционная способность катиона арендиазония в большой степени зависит от природы заместителей в бензольном кольце. Электроноакцепторные заместители увеличивают, а электронодонорные уменьшают электрофильные свойства катиона диазония.
Активной формой фенола в качестве азосоставляющей является фенолят – анион, поэтому сочетание с фенолами проводят в слабоосновной среде. Однако рН раствора в этом случае поддерживают в интервале 8-10, избегая более высокой основности раствора. Это объясняется тем, что при значениях рН>12 резко уменьшается концентрация единственной активной в реакциях азосочетания формы катиона диазония ArN2+ и растет концентрация нереакционноспособного диазотат-аниона
Ar – N = N – O-.
Сочетание с ароматическими аминами проводится в слабокислой среде с рН 3 – 5, где катион диазония реагирует с активированным к электрофильному замещению свободным амином.
Азосочетание отличается от других реакций электрофильного ароматического замещения чрезвычайно высокой селективностью. Азосочетание с фенолят-ионами и аминами осуществляется в пара-положение к гидроксильной группе или аминогруппе и только в том случае, если пара-положение занято, сочетание идет в орто-положение.
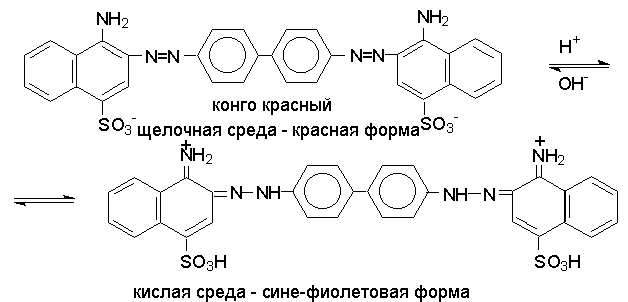
Реакция азосочетания имеет большое практическое значение, так как азосоединения используются как красители (азокрасители). В результате комбинации солей диазония из различных ароматических аминов с различными азосоставляющими и подбора условий могут быть получены самые разнообразные азокрасители.
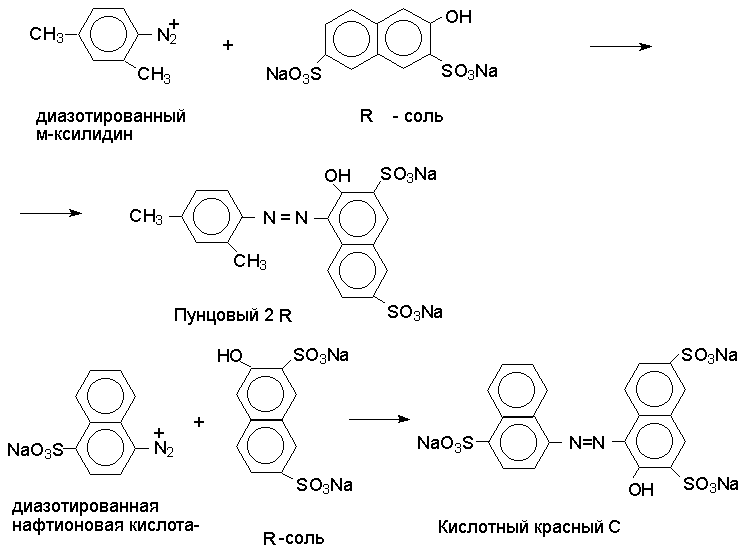
Многие азокрасители в зависимости от рН среды изменяют строение, а, следовательно, и окраску. Такие азокрасители находят применение в качестве индикаторов (метилоранж, метаниловый желтый, метиловый красный, конго красный и др.).
б) Восстановление солей арендиазония в арилгидразины.
Существует два общих метода восстановления солей диазония до арилгидразинов.
Первый способ заключается в восстановлении катиона арендиазония смесью сульфита и гидросульфита натрия. На первой стадии образуется ковалентный диазосульфонат, который далее восстанавливается до соли арилгидразин-N–N/-дисульфокислоты, гидролизующейся далее до арилгидразина.
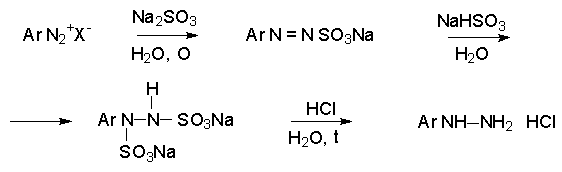
Другой способ состоит в восстановлении солей диазония двухлористым оловом в соляной кислоте.
![]()
2. Алифатические диазосоединения.
Соли алкандиазония крайне нестабильны. Относительно устойчивыми
диазосоединениями алифатического ряда являются диазоалканы, которые можно
рассматривать как внутренние соли алкандиазония.
|
CH2N2 |
(CH3)2CN2 |
|
диазометан |
2-диазопропан |
Строение и физические свойства
Диазоалканы – газообразные или жидкие вещества желтого цвета, взрывоопасные и ядовитые. Газообразный диазометан разлагается со взрывом при комнатной температуре при соприкосновении со шлифованной или шероховатой поверхностью, поэтому его используют и хранят в виде раствора в эфире при низких температурах.
Диазоалканы имеют структуру внутренних солей, которая может быть представлена набором резонансных структур.
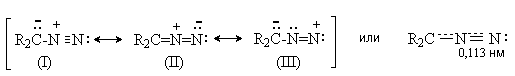
Длина связи N-N близка к тройной, т.е. структура диазоалканов близка к структуре биполярного иона (I).
Производные диазоалканов с электроноакцепторными группами - a -диазоэфиры, a -диазокарбонильные соединения более стабильны за счет делокализации заряда с участием карбонильной группы.
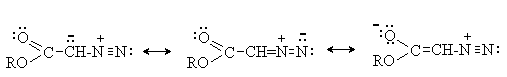
Методы получения
Диазоалканы не могут быть получены нитрозированием первичных аминов, так как образующиеся алкандиазониевые соли спонтанно разлагаются с выделением азота (см. лек.№42). Диазометан получают обработкой N-нитрозометилмочевины или N-нитрозометилуретана щелочью.
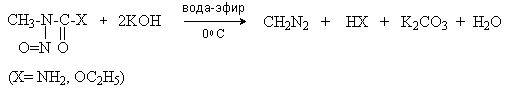
При взаимодействии a -аминоэфиров с азотистой кислотой дезаминирования не происходит. Из a -положения, активированного карбонильной группой, отщепляется протон и образуются a -диазоэфиры.
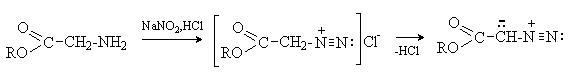
Нитрозированием a -аминокетонов получают a -диазокетоны. Другой способ получения a -диазокетонов – ацилирование диазометана ацилгалогенидами (см. далее).
Химические свойства
1) Реакции с протонными кислотами
Диазоалканы являются С-основаниями и легко реагируют с соединениями, содержащими кислый водород. Реакция протекает через стадию протонирования диазоалкана с образованием нестабильного катиона алкандиазония, который реагирует с нуклеофилом с выделением азота.
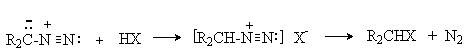
Таким образом диазометан количественно реагируют с гидроксильной группой карбоновых кислот и фенолoв. Обладающие меньшей кислотностью спирты реагируют при катализе эфиратом трехфтористого бора.
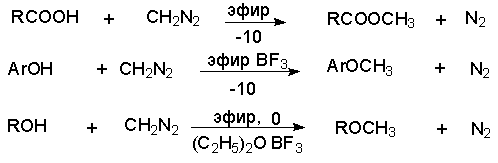
a -Диазоэфиры реагируют аналогично, но в силу меньшей основности менее реакционноспособны.
2) Реакции с карбонильными соединениями
Диазоалаканы как нуклеофилы присоединяются по карбонильной группе альдегидов и кетонов. Менее реакционноспособные a -диазоэфиры реагируют только с альдегидами. Дальнейшие превращения приводят в случае альдегидов к метилкетонам, из кетонов образуются их гомологи. В обоих случаях побочно образуются оксираны.
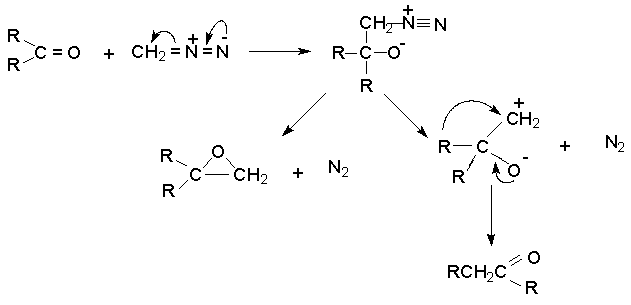
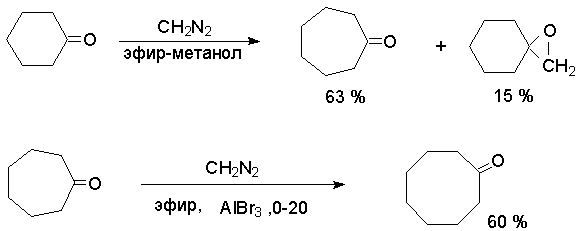
Реакция имеет препаративное значение для синтеза некоторых циклических кетонов как метод расширения цикла.
Взаимодействие диазометана с хлорангидридами приводит к a -диазокетонам.
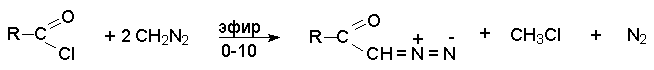
В этом случае от продукта присоединения диазометана к карбонильному атому углерода отщепляется не азот, хлороводород и образуется относительно устойчивый диазокетон. Избыток диазометана необходим для связывания образующегося HCl.
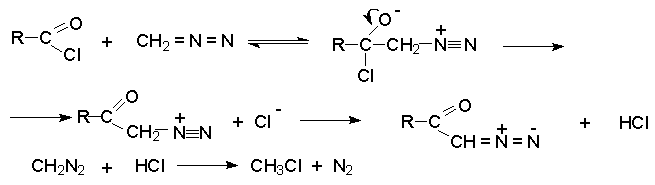
a -Диазокетоны являются важными промежуточными продуктами. Они могут быть восстановлены в аминокетоны, превращены в a -галогенкетоны действием Hнal. При катализе ионами серебра или при облучении диазокарбонильные соединения превращаются в кетены (перегруппировка Вольфа). Эта перегруппировка лежит в основе общего метода синтеза карбоновых кислот по Арндту – Эйстерту.
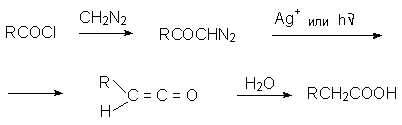
3) Реакции биполярного присоединения
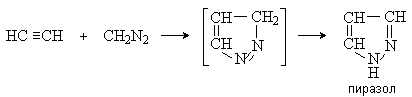
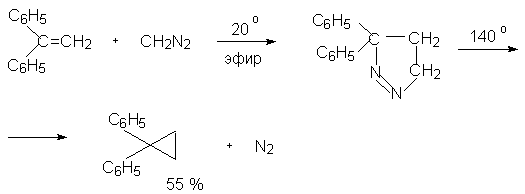
Диазоалканы реагируют с активированными алкенами с образованием пиразолинов, а с ацетиленом дают пиразолы. При повышенных температурах пиразолины отщепляют азот и превращаются в производные циклопропана.
4) Фотохимическое и термическое разложение
При облучении или нагревании диазоалканы разлагаются с образованием карбенов. Диазометан при облучении разлагается на карбен - метилен и азот.
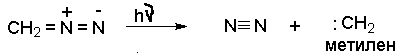
Карбены – высокореакционноспособные частицы, которые претерпевают дальнейшие превращения, например, присоединяются к двойной связи алкенов с образованием производных циклопропана. Разновидностью этого способа генерации карбена является каталитическое разложение диазосоединений, и в первую очередь, диазоуксусного эфира в присутствии солей меди, а также ионов других переходных металлов.