Л е к ц и и 50-51
Физические и физико-химические методы исследования в органической химии
План
- Спектроскопические методы анализа органических
соединений и полимеров.
- Атомный
анализ
- Молекулярные
спектры
- Фотометрия.
- Ультрафиолетовая и видимая спектроскопия
- ИК-
спектроскопия и спектроскопия комбинационного рассеяния
- Спектроскопия
ядерного магнитного резонанса
- Спектроскопия
электронного парамагнитного резонанса
- Масс-спектрометрия.
1.Спектроскопические методы
анализа органических
соединений
Спектроскопические методы анализа органических соединений и полимеров основаны на использовании различных явлений и эффектов, возникающих при взаимодействии вещества и электромагнитного излучения.
Электромагнитное излучение возникает при замедлении движения электрических заряженных частиц (в основном электронов) с другой стороны оно может поглощаться в процессе ускорения таких частиц. В соответствии с этим различают эмиссионные и абсорбционные методы анализа, которые основаны на измерении различных параметров
Для химика важно деление спектра ЭМИ на области, потому что в каждой из них взаимодействие с химической системой протекает по различным механизмам и дает различную информацию.
Таблица
|
Область |
Границы в используемых единицах измерения |
Длины волн в метрах |
Уровень перехода |
|
1 |
2 |
3 |
4 |
|
Рентгеновская |
10-2 - 102 А |
10-12 - 10-8 |
K и L - электроны |
|
Дальняя УФ |
10 - 200 нм |
10-8 2*10-7 |
Средние е- |
|
Ближняя УФ |
200 - 400 нм |
2*10-7 - 4*10-7 |
Валентные е- |
|
Видимая |
400 - 750 нм |
4*10-7 - 7,5*10-7 |
Валентные е- |
|
Ближняя и средняя ИК |
0,75 - 50 мкм |
7,5*10-7 - 5*10-5 |
Молекулярные колебания |
|
Дальняя ИК |
5*10-5 - 1000 мкм |
5*10-5 - 1*10-3 |
тоже |
|
Микроволная |
0,1 - 100 см |
1*10-3 - 1 |
Молекулярные вращения |
|
Радиоволновая |
1 - 1000 м |
1*103 |
Ядерный магнитный резонанс |
Всем областям электромеханического спектра соответствуют специальные названия методов анализа (ИКС, ААС, УФ-спектрофотометрия и тд.)
Кроме того, взаимодействие электромагнитного излучения возможно со всем объемом вещества. Методы, основанные на закономерностях, проявляющихся при таком взаимодействии, подразделяются на рефрактометрияю, полятиметрию, нефело- и турбидиметрию.
2. Атомный анализ
В качестве примера рассмотрим атом натрия (электронная конфигурация ...3s1) При облучении потоком энергии, включающем длины волн 589,00 и 589,59нм внешние электроны многих атомов поглощая фотоны, возбуждаются и переходят на 3р. Возбужденный электрон стремится вернуться в свое нормальное состояние на 3s, при этом он испускает квант энергии, соответствующий величине перехода (т.е. тем же длинам волн).
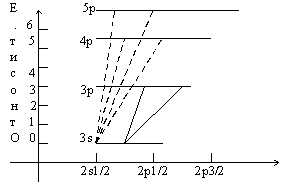
“Символ терма” - Цифровое обозначение различных энергетических уровней.
В приведенном примере испускаемое множеством атомов излучение обуславливает желтый цвет натриевого пламени. В этом простом случае, когда электрон переходит на внешний энергетический уровень, а затем возвращается на исходный, излучение называют резонансным или резонансной флуоресценцией.
Если сообщить электрону более высокую энергию, то он, возможно, перейдет на более высокий, чем 3р уровень. В этом случае он может вернуться не в результате единичного перехода, а задержаться на промежуточных в соответствии с правилом отбора (запрещенных и разрешенных переходов). Под действием источника возбуждения способны осуществлять такие переходы на только электроны внешнего уровня любого элемента.
В результате испускаемое излучение может состоять из нескольких тысяч дискретных линий соответствующих конкретным длинам волн, конкретного перехода.
Если возбуждение осуществить с еще большей энергией, то возбужденный электрон может вообще оторваться от своего атома, а его место займет электрон с более высокого энергетического уровня, то такой “дальний переход” сопровождается излучением с большей n и меньшей l (большая Е ). Так происходит получение рентгеновского излучения при бомбардировке атомов потоком быстрых электронов.
Атомная спектроскопия.
Принцип анализа методом атомной эмиссионной спектроскопии заключается в измерении 2-х параметров спектральных линий: длины волны и интенсивности излучения.
Существование качественного анализа (обнаружения и идентификации) заключается в сопоставлении спектра пробы и спектров стандартных образцов индивидуальных элементов по l .
Общее число линий многих элементов очень высоко (U более 5000), однако нет необходимости определять l всех линий. На практике устанавливают наличие или отсутствие аналитических или последних линий.
При уменьшении концентрации элемента в пробе интенсивность большинства линий в его спектре будет уменьшаться и при какой-то концентрации их останется очень мало. Эти линии хорошо изучены, их интенсивности для каждого элемента известны).
Для расшифровки спектра и установления длины волны линии пользуются спектрами сравнения, в которых длинны волн определенных линий хорошо известны. Чаще всего это спектр железа, который имеет характерные группы линий в различных областях спектра железа. Для установления длины волны выбранной линии l x измеряют с помощью измерительного микроскопа расстояние а1 и а2 до линий Fe с точно известными длинами волн.
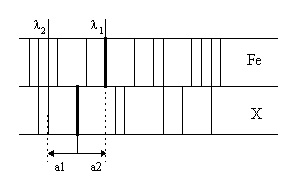
![]()
Спектроскопические методы анализа органических соединений и полимеров.(абсорбционные ) на пропорциональной зависимости между ослаблением Э.М. излучения, проходящего через совокупность атомов или молекул (в ограниченном объёме) от количества этих атомов и молекул, т.е.от их концентрации.
В зависимости от того, какими частицами поглощается излучение, различают молекулярные и атомные абсорбционные методы. Поскольку методы основаны на поглощении излучения в УФ, видимой и ближней ИК областях спектра, для простоты и наглядности будем называть его светом.
Уменьшение интенсивности излучения, прошедшего через слой поглощающих частиц характеризуются коэффициентом пропускания [T] света:
T = I/I0 — отношение интенсивности излучения начального и прошедшего.
Другая характеристика ослабления светового потока — оптическая плотность — отрицательный lgT:
lgT = -lg I/I0 = lgI0/I
= A
Уменьшение интенсивности светового потока при прохождении его через поглощающий слой подчиняется закону Бугера - Ламберта - Бера:
I
= I0*10-abc
где a - коэфф. поглощения (зависит от природы в-ва);
I/I0 = 10-abc
b - толщина слоя поглощаемого в-ва;
lgI/I0
= A = abc
c - концентрация.
Физический
смысл коэффициента светопоглощения становится ясным при подставке в з-он Б-Л-Б
еденичных значений концентрации и толщины поглощающего слоя — ( а ) равен
оптической плотности слоя в 1 см. и при ( с ) поглощающих частиц равным также
1.
Оптическая плотность обладает свойством аддитивности, т.е. если в слое через который пропускают излучени находятся атомы или молекулы различных элементов или веществ то каждое из них, независимо от других, будут давать свой аддитивный вклад в общую ( эксперементально установленную ) оптическую плотность А:
A=A1 + A2 + ... + An
Закон Бугера - Ламберта - Бера имеет некоторые ограничения, которые зависят от условий проведения эксперемента, т.е. от метода анализа и его особенностей.
3. Молекулярные спектры.
Если атомные спектры имеют исключительно электронную природу, т.е. обусловлены переходами электронов между двумя орбиталям, то природа происхождения молекулярных спектров более сложна.
Поглощение энергии частицей состоящей из нескольких или многих атомов так же обусловлена дискретностью энергетических состояний этих частиц и квантовой природой электромагнитного излучения. Однако увеличение внутренней энергии частицы складывается из энергии вращения как целого, энергии колебания атомов и движения электронов:
Е = Евр + Екол + Ее
При этом количественно:
Евр < Екол < Ее
Вращательные переходы происходят при поглощении в дальней ИК и электромагнитной области Э.М.С., т.е. > 100 мкм. (см. табл. Э.М.С.).Вращательные спектры в аналитической химии пока не применяются.
Колебательные переходы лежат в области близкого и среднего ИК излучения. Исследование колебательных спектров показывают, что их частота соответствует колебаниям отдельных атомов или групп атомов в молекуле. Эти характеристические частоты нашли широкое применение в ИК — спектроскопии для качественного анализа и изучения строения молекулы.
Электронные спектры. При увеличении энергии возбуждения свыше 60 кДж/моль приведет к электронным переходам.
В соответствии с методом МО электроны в молекуле могут находиться на связывающих, не связывающих и разрыхляющих орбиталях. Различные спектропереходы неравнозначны по энергетике и, следовательно, наблюдаются при различных длинах волн.
4. Фотометрия.
Методы абсорбционной фотометрии применяются в основном для анализа растворов. При этом следует иметь в виду, что кристаллические вещества можно переводить в растворы путем растворения, а вещества, содержащиеся в газах — путем поглощения.
В зависимости от аппаратурного оформления различают спектрофотометрию — анализ по параметрам поглощения монохроматического света и фотоколориметрию — анализ немонохроматического света.
Полихроматический — называется световой поток содержащий широкий спектр длин волн.
Монохроматический — поток имеющий одну частоту (или длину волны).
Оба метода основаны на применении закона Б-Л-Б, т.е. зависимости оптической плотности от его концентрации.
Т.к. концентрацию растворов (особенно в теории методов) принято выражать в моль/дм3, то коэффициент поглощения получил название молярного коэффициента поглощения ( e ).
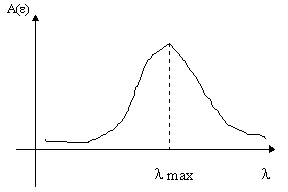
По известным вам уже причинам, свет поглощается раствором вещества избирательно при некоторых длинах волн он поглощается интенсивно, при других — нет.
Графическая зависимость оптической плотности (А) или (e ) от длины волны падающего света называют спектральной характеристикой раствора или в-ва, если она индивидуально находится в растворе.
По сути, для индивидуального вещества — это спектр поглощения.
Принципиальная схема фотометра
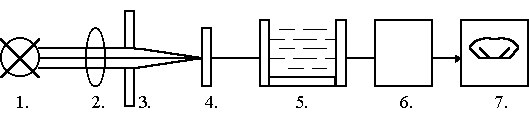
Условные обозначения:
1. Источник света.
Для УФ — дейтериевая или ртутная лампа.
Для видимого света — вольфрамовая лампа накаливания.
Для ИК — штифт Нерста (спресованные оксиды редкоземельных
материа- лов) или лампа Глобара (карборунд SiC).
2. Оптическая система.
3. Оптическая щель.
4. Светофильтры.
5. Кювета с исследуемым раствором ( KBr ,KCl — для ИК лучей).
6. Рецептор (фотоэлемент).
7. Регистрирующий прибор.
Требования к фотометрическим измерениям:
1.Получение окрашенного соединения одного состава;
2.Устойчивость во времени;
3.Избирательность поглощения.
При наличии в растворе одного светопоглощающего вещества аналитическую длину волны выстраивают на максимум светопоглощения, т.к. она обеспечивает большую чувствительность определения. На практике ввиду возможности перекрывания полосы поглощения определяемого вещества сопутствующими, такой выбор часто нецелесообразен.
Светопропускание ( оптическая плотность ) — А — теоретически может принимать значения от 0 до ¥ . Однако, диапазон в котором обеспечивается необходимая точность измерений находится в пределах 0,01 - 2.
5. Ультрафиолетовая и видимая спектроскопия
Применение электронной спектроскопии в ультрафиолетовой и видимой областях спектра для анализа функциональных групп ограничено тем, что соответствующие спектры имеют небольшое число полос поглощения. Их преимущество в сравнении со спектроскопией в ИК-области спектра заключается в большей чувствительности, что позволяет исследовать очень разбавленные растворы. Имеющиеся недорогие, простые в обращении современные записывающие спектрофотометры дают возможность быстро обнаруживать присутствие сильных хромофорных групп в образце.
Например, сильное поглощение соединения в области 220— 250 нм позволяет предположить, что имеется сопряженная система из двух связей (например, диен или a, b - ненасыщенный кетон). Сопряженные системы, содержащие 3, 4 и 5 двойных связей, обладают более сильным поглощением в области 260, 300 и 330 нм соответственно. Появление полосы средней интенсивности с тонкой структурой в области 250—270 нм обусловлено поглощением бензольного кольца. Наличие полярных заместителей приводит к значительному сдвигу полосы и одновременно к исчезновению тонкой структуры. При этом интенсивность полосы также увеличивается по меньшей мере на порядок. Кетоны и альдегиды дают полосу поглощения слабой интенсивности при 290 нм. Следовательно, если исследуемый образец не поглощает в области спектра выше 220 нм, то присутствие указанных выше групп можно исключить.
В насыщенных молекулах некоторые гетероатомы (S, N и I) сильно поглощают при длине волны около 200 нм. Примером служат CH2I2 ,C2H5SH, C2H5SC2H5и ациклические дисульфиды (например, C2H5SSC2H5), растворенные в насыщенных углеводородах.
УФ-спектры, содержащие две или большее количество интенсивных полос поглощения, позволяют достаточно надежно доказать идентичность образца, в особенности если имеется спектр эталонного образца (или соответствующие литературные данные).
6. Инфракрасная спектроскопия и спектроскопия
комбинационного рассеяния
ИК-спектроскопия позволяет идентифицировать почти все функциональные группы и с успехом применяется для качественного исследования органических соединений.
К недостатку этого метода следует отнести возможность исследования, как правило, лишь неводных растворов образцов, а также применение более сложной и дорогостоящей аппаратуры по сравнению с используемой в методе УФ-спектрофотометрии. Кроме того, при интерпретации ИК-спектров требуются более глубокое знание теории и хорошие практические навыки.
Наиболее однозначный способ идентификации неизвестного чистого соединения состоит в сравнении его ИК-спектра с описанным спектром. В настоящее время выпущен ряд каталогов спектров.
При исследовании неизвестного вещества, когда нет возможности сравнить его с описанным веществом, сначала желательно исследовать его химическими методами, провести качественный и количественный элементный анализ, а также определить молекулярную массу. После установления эмпирической формулы типы связей и функциональные группы можно идентифицировать по положению полос поглощения в ИК-области спектра.
Характеристические частоты отдельных связей и функциональных групп можно определить из спектров различных соединений известной структуры. Несмотря на то, что такое эмпирическое определение дает лишь возможность сделать предварительную оценку, его с успехом применяют на практике. Присутствие индивидуальных функциональных групп можно подтвердить химическими аналитическими методами. Качественное определение этих групп в молекуле проводят методами функционального анализа.
ИК-спектры неизвестного вещества анализируют по следующей методике. Сначала проводят отнесение полос поглощения сильной и средней интенсивности. На первом этапе исследуются ОН-, NH- и СН-валентные колебания, проявляющиеся в области 3600—2800 см-1, что дает определенную информацию о присутствии или отсутствии ОН- или NН-групп в молекуле (в случае перекрывания этих полос, что случается редко, могут возникнуть затруднения).
Частоты колебаний СН-связей в алифатических и ароматических молекулах в большинстве случаев также легко установить. Затруднения возникают в тех случаях, когда из-за низкой интенсивности ароматические СН-валентные колебания перекрываются более интенсивными полосами. СН-валентные колебания ненасыщенных групп также оказываются в области ароматических СН-валентных колебаний. В связи с этим идентификацию дополняют исследованием деформационных колебаний, положение полос которых позволяет установить присутствие насыщенных, ненасыщенных и ароматических СН-групп.
В области 2850—1850 см-1 находится совсем немного полос поглощения. Они относятся к поглощению карбоновых кислот, гидрохлоридов, SH-группы, тройных и сопряженных двойных связей и a-аминокислот. Здесь также могут наблюдаться некоторые комбинационные полосы и обертоны.
В области 1850—1470 см-1 поглощают двойные связи, и наблюдаются колебания ароматического скелета и деформационные колебания NН-связи. Для того чтобы сделать правильное отнесение частот, в других областях спектра находят дополнительные полосы поглощения групп, присутствие которых предполагают на основании положения полос в основной области спектра (например, карбоксильных, ароматических, амино- и нитрогрупп).
Обычно наблюдаемый спектр наиболее сложен в области 1500—650 см-1. Идентифицировать все полосы, как правило, не представляется возможным, и такие попытки не предпринимаются. В этой области проявляется множество валентных, деформационных и групповых колебаний. Совпадение спектров в данной области при обычном их сравнении свидетельствует об идентичности веществ, поэтому ее справедливо называют областью “отпечатков пальцев”, и спектр в этой области сильно зависит от структуры молекулы. Следовательно, эта область спектра более характеристична для молекулы, чем области больших длин волн, где проявляются характеристические частоты связей, на которые оказывают меньшее влияние другие части молекул.
Проведение полного отнесения полос сильной и средней интенсивности является наиболее трудной задачей, так как возникающие при этом комбинационные полосы и обертоны часто имеют такую же интенсивность, как и слабые основные полосы, и их можно отличить только с большим трудом, если это вообще удается сделать.
При анализе ИК-спектров необходимо иметь в виду, что положение полосы изменяется в результате сопряжения и образования ассоциированных структур, а также в зависимости от аппаратуры, используемой для записи спектра. Появление полосы с данной частотой не всегда связано с присутствием данной группы; поэтому в спектре необходимо идентифицировать другие полосы, характеристичные для этой группы. С другой стороны, отсутствие полосы с ожидаемой частотой не исключает присутствия искомой группы, так как сильные взаимодействия, образование хелатов и сильных водородных связей могут приводить к значительному сдвигу полосы или ее исчезновению в данной области спектра. Оценка интенсивности полос может сильно облегчить идентификацию.
Спектры смесей или образцов, содержащих примеси, можно расшифровать, но с большим трудом. Поэтому перед записью спектра необходимо провести разделение смеси или очистку вещества физическими или химическими методами.
По сравнению с ИК-спектроскопией спектроскопия комбинационного рассеяния обладает тем преимуществом, что позволяет исследовать водные растворы, поскольку в ней используется видимый (монохроматический) свет. Спектры регистрируются на фотопластинке или посредством детекторов на основе фотоумножителя. При этом они оказываются менее сложными, легче поддаются расшифровке, частоты можно определить очень точно.
В
органическом химическом анализе спектроскопия комбинационного рассеяния не
заменяет ИК-спектроскопию, а дополняет ее. Некоторые связи, например С=С, С=С,
С-С и S-Н, обладающие слабым поглощением или не поглощающие в ИК-области, дают
интенсивные сигналы в спектре комбинационного рассеяния. С помощью
спектроскопии комбинационного рассеяния можно легко исследовать область низких
частот (650 см-1), в то время как ИК-метод требует для этого
специального оборудования.
Недостатком метода комбинационного рассеяния является очень высокая стоимость приборов. Кроме того, исследуемый раствор должен быть очень тщательно очищен от пыли, окрашенных и флуоресцирующих веществ. Для определений требуется довольно большое количество образца (0,05—10 г). Этот вид спектроскопии находится в стадии разработки, и пока еще имеется относительно мало стандартных спектров.
7. Спектроскопия ядерного магнитного резонанса
Спектроскопия ядерного магнитного резонанса (ЯМР) весьма эффективна при идентификации функциональных групп, в особенности при выяснении структуры сложных молекул. Однако приборы с высоким разрешением очень дороги, а расшифровка спектров ЯМР требует более глубокого знания теории и лучших практических навыков, чем в случае применения ИК- и УФ-спектроскопии. Здесь будут лишь кратко обсуждены основные принципы метода.
Спектроскопия ЯМР основана на том, что магнитный момент атомного ядра образует определенный угол с силовыми линиями внешнего магнитного поля. В квантовых состояниях, соответствующих различным направлениям магнитного момента, энергия системы различна. Для изменения квантового состояния затрачивается определенная энергия, и, когда она подводится к системе в виде излучения, изменение направления магнитного момента ядра происходит при поглощении излучения данной частоты. Частоты, соответствующие различным изменениям состояния, определяют поглощение в микроволновой области электромагнитного спектра (доходящей до ИК-области), которое зависит от напряженности приложенного магнитного поля. Практически напряженность магнитного поля подбирают такой, чтобы облучение происходило в области радиочастот.
Резонансное поглощение атомных ядер измеряют следующим образом. Ампулу с образцом (или раствором образца) помещают в катушку радиочастотного контура и все это располагают между полюсами электромагнита, имеющего сильное и однородное магнитное поле (104—109 Гс). При изменении частоты тока в катушке или чаще всего напряженности магнитного поля в определенный момент внезапно происходит увеличение потерь переменного тока. При правильной регулировке потенциал на выходе отражает поглощение образца, помещенного в переменное поле, и наблюдаемые изменения можно зарегистрировать как функцию частоты. Частота ядерного резонанса сильно зависит от окружения данного ядра, и расщепление сигнала также происходит под влиянием соседних атомов.
В аналитических целях используют значения химических сдвигов парамагнитного резонанса. Положение резонансной линии поглощения протона в различных веществах отличается от положения сигнала в идеальной спиновой системе, содержащей только протоны, т. е. линии протонного магнитного резонанса функциональных групп сдвинуты относительно линии поглощения протона. Химические сдвиги легко измерить приборами высокого разрешения и, таким образом, идентифицировать определенные группы, например —СНз, =СН2 и —ОН-группы, которые наблюдаются в виде четко разделенных сигналов. Интегральная интенсивность сигналов (площадь под кривой) зависит от числа эквивалентных атомов водорода в группе, например сигнал группы —СНз в три раза интенсивнее сигнала ОН-группы.
Химический сдвиг измеряют относительно сигнала стандартного вещества (внутреннего эталона), в качестве которого обычно используют тетраметилсилан (СН3)4Si. Это вещество химически инертно, легко смешивается с большинством веществ, магнитно изотропно и дает легко идентифицируемый резкий сигнал протонного резонанса.
Химические сдвиги, обычно измеряемые в единицах частоты (герцах), намного меньше измеренной частоты. Значение химического сдвига для линии (в миллионных долях) рассчитывают по уравнению
d(млн-1) = ((ne - ni)/n0)*106
где (ne - ni) — сдвиг между неизвестной группой и стандартной линией, измеренный в герцах; no—частота генератора.
По техническим причинам при записи спектра ЯМР магнитное поле измеряют при фиксированной частоте vo, а расстояние между линиями выражают в герцах. Так как сдвиг может быть и положительным, и отрицательным, положению линии внутреннего эталона приписывают значение 10 и после вычитания из :нее величины 6 рассчитывают величину относительного сдвига т по формуле
t = 10 -d = 10 - ((ne - ni)/n0)*106
Таким образом, значения t обычно имеют положительную величину.
Величины химических сдвигов для индивидуальных групп приведены в литературе. Спектроскопия протонного магнитного резонанса используется не только для анализа функциональных групп, но и для стереохимических исследований.
8. Спектроскопия электронного парамагнитного резонанса
Спектроскопия электронного парамагнитного
резонанса (ЭПР) в принципе имеет сходство со спектроскопией ЯМР. При изучении
спиновых переходов электронов требуется применение микроволновых частот в
однородном магнитном поле напряженностью 3000—13000 Гс, поэтому радиочастотную
технику, используемую в спектроскопии ЯМР, здесь заменяют на микроволновые
методы. Так как электронный парамагнитный резонанс происходит только при
наличии неспаренных электронов, этот метод пригоден только для изучения
свободных радикалов, парамагнитных соединений и некоторых металлоорганических
веществ, однако при изучении свободных радикалов он незаменим.
8. Масс-спектрометрия
Масс-спектрометрия является наиболее современным методом определения молекулярной массы, дающим очень точные результаты. Прибор с простой фокусировкой обеспечивает точность 0,2%, а с двойной — менее 0,01 %.
Принцип метода заключается в следующем. Образец испаряют и вводят в ионизационную камеру прибора (если определяется молекулярная масса, то вещество в этих условиях должно оставаться стабильным). В ионизационной камере молекулы вещества под действием электронов различной энергии (50—70 эВ) превращаются в положительные молекулярные ионы:
![]()
Молекулярные ионы образуются вблизи от положительно заряженного ускоряющего электрода, имеющего потенциал около 2 кВ. Положительные ионы под действием электростатических сил отталкиваются от электрода и с помощью вспомогательных электродов формируются в ионный пучок, который фокусируется на выходную щель ионизационной камеры. Затем ионный пучок проходит через магнитное поле, создаваемое электромагнитом. В результате этого направление пучка обычно изменяется на 90° и молекулярные ионы начинают двигаться по разным траекториям, определяемым отношением массы т к заряду е:
M/e = H2r2/2V
где H —напряженность магнитного поля, r—радиус орбиты, V— потенциал ускоряющего электрода..
Ускоряющий потенциал и напряженность магнитного поля подбирают таким образом, чтобы пучок определенных ионов (частиц, имеющих почти одинаковые величины т/е) проходил через выходную щель и попадал на коллектор ионов. Величина ионного тока составляет около lO-12 A. Затем этот ток усиливается с помощью электронного умножителя. Измеряемый ток пропорционален количеству исследуемых ионов. В приборах с двойной фокусировкой разделение ионного пучка последовательно проводится в электростатическом и магнитном анализаторах. В результате этого направление движения ионов меняется почти на 180° и достигается более высокое разрешение.
Масс-спектр получают при регистрации величин т/е ионных пучков, прошедших через щель. Для получения масс-спектра изменяют напряженность магнитного поля при постоянном ускоряющем напряжении, в результате чего в коллектор попадают ионы с различным отношением m/е. На диаграммной ленте получают зависимость относительной интенсивности ионного пучка от m/е. Высота пика пропорциональна относительному количеству частиц данного вида (в процентах). Так, с помощью простейшего прибора можно различить 1,2-бензантрацен и 1,5-дифенилбензол (см. упрощенный спектр на рис.).
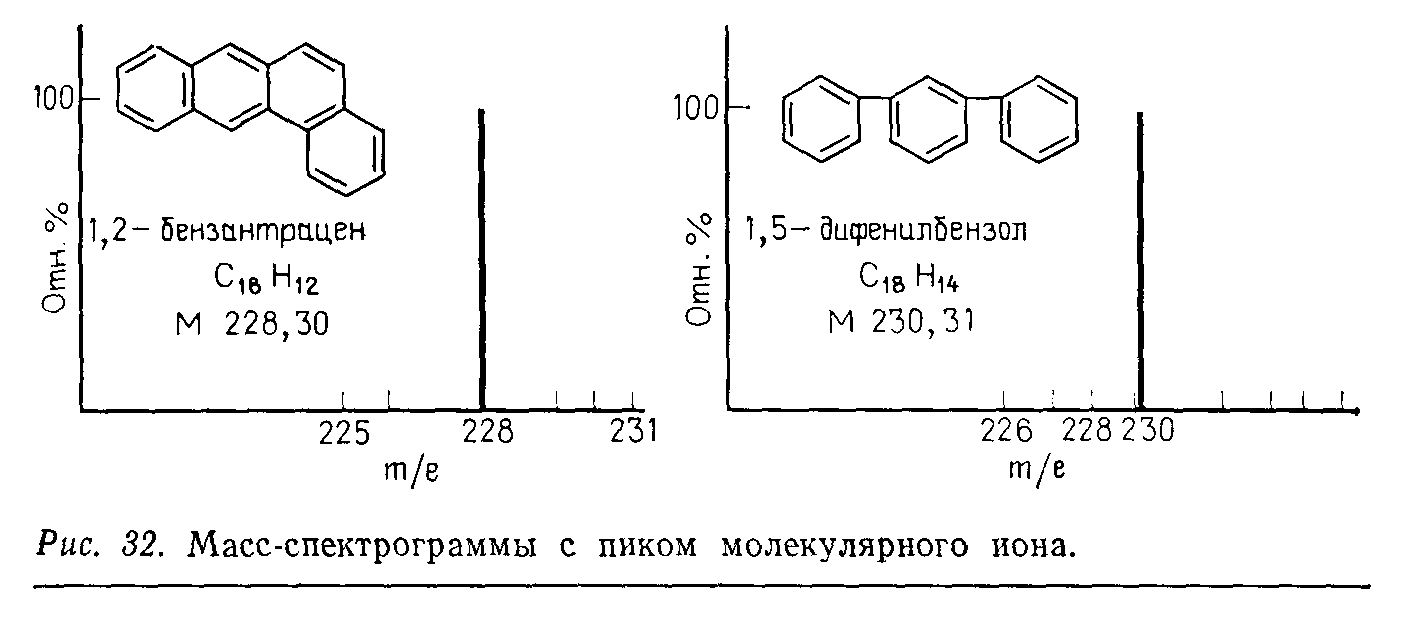
Приборы с двойной фокусировкой значительно более эффективны. Например, при исследовании алкалоидов с высокой молекулярной массой на основании данных элементного анализа им можно было приписать формулы C45H54N4O8 (мол. масса 778) или C42H48N4O6 (мол. масса 722). На масс-спектрометре среднего разрешения было установлено, что молекулярная масса равна 718. На основании этих данных были предложены две возможные молекулярные формулы: C43H50N4O6 (мол. масса 718, 373)или C42H46N4O7 (мол. масса 718,336). Точная масса молекулярного иона, полученная на масс-спектрометре высокого разрешения, равна 718,3743, что подтверждает первую из предложенных формул.