Лекции №7-9
ОСНОВЫ СТЕРЕОХИМИИ
План
1. Конформации (поворотная изомерия).
3. Оптическая изомерия (энантиомерия).
5. Методы получения стереоизомеров
Стереохимия - часть химии, посвященная изучению пространственного строения молекул и влияния этого строения на физические и химические свойства вещества, на направление и скорость их реакций.
1. Конформации (поворотная изомерия)
Переход от простейшего органического углеводорода - метана, к его ближайшему гомологу - этану ставит проблемы пространственного строения, для решения которых недостаточно знать рассмотренные ранее параметры. Не меняя ни валентных углов, ни длин связей, можно представить себе множество геометрических форм молекулы этана, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их связи С-С. В результате такого вращения возникают поворотные изомеры (конформеры). Энергия различных конформеров неодинакова, но энергетический барьер, разделяющий различные поворотные изомеры, для большинства органических соединений невелик. Поэтому при обычных условиях, как правило, нельзя зафиксировать молекулы в одной строго определенной конформации. Обычно в равновесии сосуществуют несколько легко переходящих друг в друга поворотных форм.
Рассмотрим способы графического изображения конформаций и их номенклатуру. Для молекулы этана можно предвидеть существование двух максимально различающихся по энергии конформаций. Они изображены ниже в виде перспективных проекций (1) ("лесопильные козлы"), боковых проекций (2) и формул Ньюмена(3).
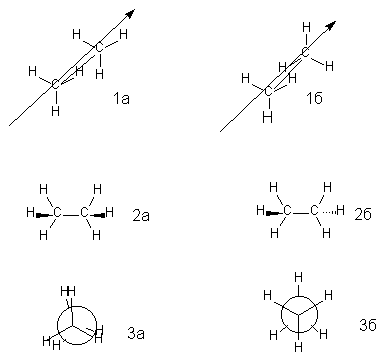
В перспективной проекции (1а, 1б) связь С-С надо представить себе уходящей вдаль; стоящий слева углеродный атом приближен к наблюдателю, стоящий справа - удален от него.
В боковой проекции (2а, 2б) четыре Н-атома лежат в плоскости чертежа; атомы углерода на самом деле несколько выходят из этой плоскости, но обычно упрощенно считают их также лежащими в плоскости чертежа. "Жирные" клиновидные связи утолщением клина показывают на выход из плоскости по направлению к наблюдателю того атома, к которому обращено утолщение. Пунктирные клиновидные связи отмечают удаление от наблюдателя.
В проекции Ньюмена (3а, 3б) молекулу рассматривают вдоль связи С-С (в направлении, указанном стрелкой на формулах 1а,б). Три линии, расходящиеся под углом 120о из центра круга, обозначают связи ближайшего к наблюдателю углеродного атома; линии, "высовывающиеся" из-за круга - связи удаленного углеродного атома.
Изображенную слева конформацию называют заслоненной. Это название напоминает о том, что атомы водорода обеих СН3-групп находятся друг против друга. Заслоненная конформация имеет повышенную внутреннюю энергию, и поэтому невыгодна. Конформацию, изображенную справа, называют заторможенной, подразумевая, что свободное вращение вокруг связи С-С "тормозится" в этом положении, т.е. молекула существует преимущественно в этой конформации.
Минимум энергии, необходимый для полного вращения молекулы вокруг
определенной связи называется барьером вращения для данной связи.
Барьер вращения в молекуле, подобной этану, может быть выражен через изменение
потенциальной энергии молекулы как функции изменения двугранного
(торсионного) угла системы. Двугранный угол (обозначаемый t ) изображен на рисунке, приведенном ниже:
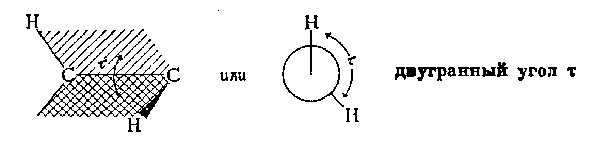
Энергетический профиль вращения вокруг связи С-С в этане показан на
следующем рисунке 7.1. Вращение "заднего" атома углерода изображено
изменением двугранного угла между двумя показанными атомами водорода. Для
простоты остальные атомы водорода опущены. Барьер вращения, разделяющий две
формы этана, составляет только 3 ккал/моль (12.6 кДж/моль). Минимумы кривой
потенциальной энергии соответствуют заторможенным конформациям, максимумы -
заслоненным. Поскольку при комнатной температуре энергия некоторых столкновений
молекул может достигать 20 ккал/моль (около 80 кДж/моль), то этот барьер в 12.6
кДж/моль легко преодолевается и вращение в этане рассматривают как свободное.
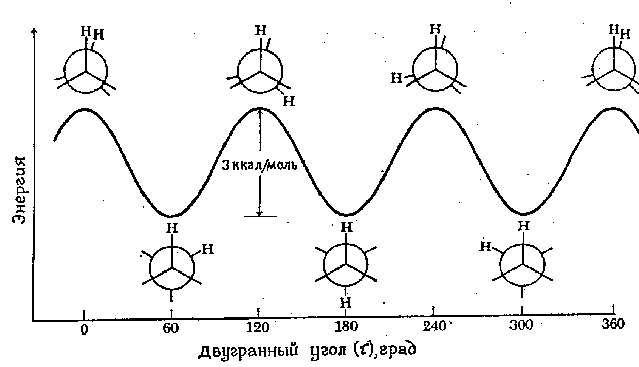
Рис.7.1. Диаграмма потенциальной энергии конформаций этана.
Каждая точка на кривой потенциальной энергии соответствует определенной конформации. Точки, соответствующие минимумам, отвечают конформационным изомерам, то есть преобладающим компонентам в смеси всех возможных конформаций.
С усложнением молекулы число возможных конформаций возрастает. Так, для н-бутана можно изобразить уже шесть конформаций, отличающихся взаимным расположением СН3-групп, т.е. поворотом вокруг центральной связи С-С. Ниже конформации н-бутана изображены в виде проекций Ньюмена. Изображенные слева (заслоненные) конформации энергетически невыгодны, практически реализуются лишь заторможенные.
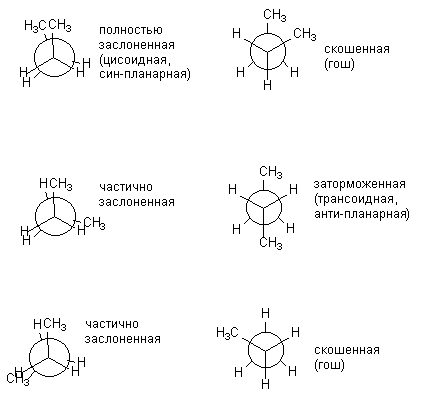
Различные заслоненные и заторможенные конформации бутана неодинаковы по энергии. Соответствующие энергии всех конформаций, образующихся при вращении вокруг центральной С-С связи, представлены на рис. 7.2.
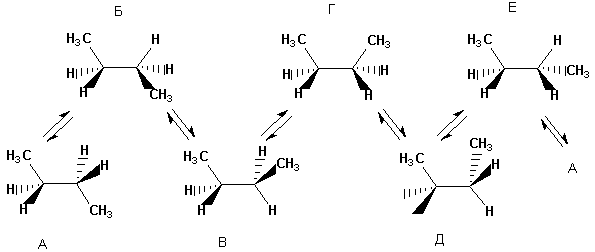
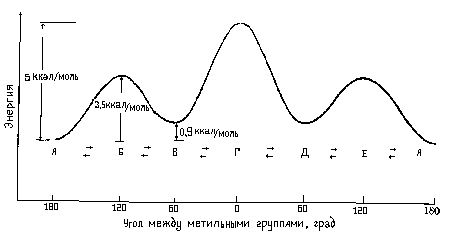
Рис. 7.2. Диаграмма потенциальной энергии конформаций н-бутана.
Итак, конформации - это различные пространственные формы молекулы, имеющей определенную конфигурацию. Конформерами являются стереоизомерные структуры, соответствующие энергетическим минимумам на диаграмме потенциальной энергии, находящиеся в подвижном равновесии и способные к взаимопревращению путем вращения вокруг простых связей.
Иногда барьер таких превращений становится достаточно высоким, чтобы разделить стереоизомерные формы (пример - оптически активные дифенилы). В таких случаях говорят уже не о конформерах, а о реально существующих стереоизомерах.
2. Геометрическая изомерия
Важное следствие жесткости двойной связи (отсутствия вращения вокруг нее) - существование геометрических изомеров. Самые распространенные из них - это цис-,транс-изомеры соединений этиленового ряда, содержащих у ненасыщенных атомов неодинаковые заместители. Простейшим примером могут служить изомеры бутена-2.

|
цис-Бутен-2 |
транс-Бутен-2 |
|
Т.пл.
-138.9 оС |
-105.6
оС |
|
Т.кип.
3.72 оС |
1.0
оС |
|
d 0.724 |
0.604 |
|
nD-20 1.3946 |
1.3862 |
Геометрические изомеры имеют одинаковое химическое строение, различаясь по пространственному расположению атомов, т.е. по конфигурации. Это различие и создает разницу в физических (а также химических свойствах). Геометрические изомеры, в отличие от конформеров, могут быть выделены в чистом виде и существуют как индивидуальные устойчивые вещества. Для их взаимного превращения необходима энергия порядка 125-170 кДж/моль, которую можно сообщить нагреванием или облучением.
В простейших случаях номенклатура геометрических изомеров не представляет затруднений: цис-формами называют геометрические изомеры, у которых одинаковые заместители лежат по одну сторону от плоскости пи-связи, транс-изомеры имеют одинаковые заместители на разных сторонах от плоскости пи-связи. В более сложных случаях применяется Z,E-номенклатура. Ее главный принцип: для обозначения конфигурации указывают цис- (Z, от немецкого Zusammen - вместе) или транс- (Е, от немецкого Entgegen - напротив) расположение старших заместителей при двойной связи.
В Z,E-системе старшими считаются заместители с большим атомным номером. Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы, то переходят ко "второму слою", в случае необходимости - к "третьему слою" и т.д.
Рассмотрим применение правил Z,E-номенклатуры на двух примерах.

|
I |
II |
Начнем с формулы I, где все решается атомами "первого слоя". Расставив их атомные номера, получим, что старшие заместители каждой пары (бром в верхней части формулы и азот в нижней) находятся в транс-положении, отсюда следует стереохимические обозначение Е:
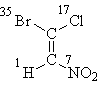
Е-1-бром-1-хлор-2-нитроэтен
Для определения стереохимического обозначения структуры II необходимо искать различие в "высших слоях". По первому слою группы СН3, С2Н5, С3Н7 не отличаются. Во втором слое у группы СН3 сумма атомных номеров равна трем (три атома водорода), у групп С2Н5 и С3Н7 - по 8. Значит, группа СН3 не рассматривается - она младше двух других. Таким образом, старшие группы - это С2Н5 и С3Н7, они находятся в цис-положении; стереохимическое обозначение Z.
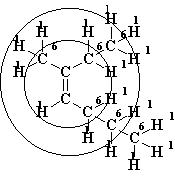
Z-3-метилгептен-3
Если бы понадобилось определить, какая группа старше - С2Н5 или С3Н7, пришлось бы перейти к атомам "третьего слоя", сумма атомных номеров в этом слое для обеих групп оказались бы соответственно равными 3 и 8, т.е. С3Н7 старше, чем С2Н5. В более сложных случаях определения старшинства надо учитывать дополнительные условия, как-то: атом, связанный двойной связью, считается дважды, связанный тройной - трижды; из числа изотопов старше более тяжелый (дейтерий старше водорода) и некоторые другие.
Отметим, что обозначения Z не является синонимами цис-обозначений, как и обозначения Е не всегда соответствуют расположению транс-, например:

|
цис-1,2-дихлорпропен-1 |
цис-1,2-дихлор-1-бромпропен-1 |
|
Z-1,2-дихлорпропен-1 |
Е-1,2-дихлор-1-бромпропен-1 |
3. Оптическая
изомерия (энантиомерия)
Среди органических соединений встречаются вещества, способные вращать плоскость поляризации света. Это явление называют оптической активностью, а соответствующие вещества - оптически активными. Оптически активные вещества встречаются в виде пар оптических антиподов - изомеров, физические и химические свойства которых в обычных условиях одинаковы, за исключением одного - знака вращения плоскости поляризации. (Если один из оптических антиподов имеет, например, удельное вращение +20о, то другой - удельное вращение -20о).
Оптическая изомерия появляется тогда, когда в молекуле присутствует асимметрический атом углерода. Так называют атом углерода, связанный с четырьмя различными заместителями. Возможны два тетраэдрических расположения заместителей вокруг асимметрического атома. Обе пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой.
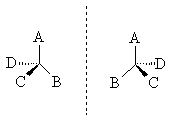
Рассмотренный вид изомерии называют оптической изомерией, зеркальной
изомерией или энантиомерией. Обе зеркальные формы
составляют пару оптических антиподов или энантиомеров.
Проекционные
формулы
Для
условного изображения асимметрического атома на плоскости пользуются проекционными
формулами Э.Фишера. Их получают, проецируя на плоскость атомы, с которыми
связан асимметрический атом. При этом сам асимметрический атом, как правило,
опускают, сохраняя лишь перекрещивающиеся линии и символы заместителей. Чтобы
помнить о пространственном расположении заместителей, часто сохраняют в
проекционных формулах прерывистую вертикальную линию (верхний и нижний
заместитель удалены за плоскость чертежа), однако часто этого не делают. Ниже
приведены различные способы записи проекционной формулы, отвечающей левой
модели на предыдущем рисунке:
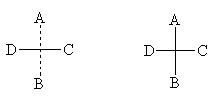
Приведем несколько примеров проекционных формул:
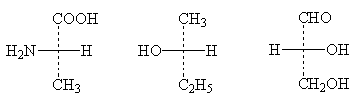
|
(+)-аланин |
(-)2-бутанол |
(+)-глицериновый альдегид |
При названиях веществ приведены их знаки вращения. Это значит, например, что левовращающий антипод бутанола-2 имеет пространственную конфигурацию, выражаемую именно приведенной выше формулой, а ее зеркальное изображение отвечает правовращающему бутанолу-2. Определение конфигурации оптических антиподов проводится экспериментально.
В принципе, каждый оптический антипод может быть изображен двенадцатью (!) различными проекционными формулами - в зависимости от того, как расположена модель при построении проекции, с какой стороны мы смотрим на нее. Чтобы стандартизировать проекционные формулы, введены определенные правила их написания. Так, главную функцию, если она находится в конце цепи, принято ставить наверху, главную цепь изображать вертикально.
Для того чтобы сопоставлять "нестандартно" написанные проекционные формулы, надо знать следующие правила преобразования проекционных формул.
1. Формулы можно вращать в плоскости чертежа на 180о, не меняя их стереохимического смысла:
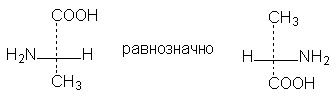
2. Две (или любое четное число) перестановки заместителей у одного
асимметрического атома не меняют стереохимического смысла формулы:
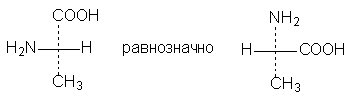
3. Одна (или любое нечетное число) перестановок заместителей у асимметрического центра приводит к формуле оптического антипода:
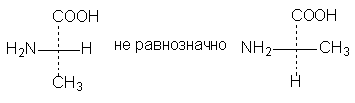
4. Поворот в плоскости чертежа на 90о превращает формулу в антиподную, если только при этом одновременно не изменить условие расположения заместителей относительно плоскости чертежа, т.е. не считать, что теперь боковые заместители находятся за плоскостью чертежа, а верхний и нижний - перед ней. Если пользоваться формулой с пунктиром, то изменившаяся ориентация пунктира прямо напомнит об этом:
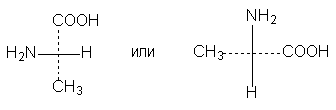
5. Вместо перестановок проекционные формулы можно преобразовывать путем вращения любых трех заместителей по часовой стрелке или против нее; четвертый заместитель при этом положения не меняет (такая операция эквивалентна двум перестановкам):
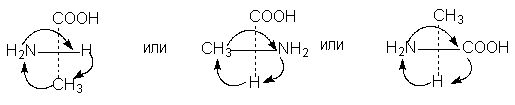
6. Проекционные формулы нельзя выводить из плоскости чертежа.
Рацематы
Если в формуле вещества есть асимметрический атом, это отнюдь не означает, что такое вещество будет обладать оптической активностью. Если асимметрический центр возникает в ходе обычной реакции (замещение в группе СН2, присоединение по двойной связи и т.п.), то вероятность создания обеих антиподных конфигураций одинакова. Поэтому, несмотря на асимметрию каждой отдельной молекулы, получающееся вещество оказывается оптически неактивным. Такого рода оптически неактивные модификации, состоящие из равного количества обоих антиподов, называются рацематами..
Другие типы оптически активных веществ
В этом разделе перечислены некоторые другие классы органических соединений, также обладающих оптической активностью (т.е. существующие в виде пар оптических антиподов).
Атом углерода не обладает монополией на создание хиральных центров в молекулах органических соединений. Центром хиральности могут быть также атомы кремния, олова, четырехковалентного азота в четвертичных аммониевых солях и окисях третичных аминов:
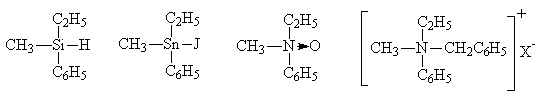
В этих соединениях центр асимметрии имеет тетраэдрическую конфигурацию, как и асимметрический атом углерода. Существуют, однако, и соединения с иной пространственной структурой хирального центра.
Пирамидальную конфигурацию имеют хиральные центры, образованные атомами трехвалентного азота, фосфора, мышьяка, сурьмы, серы. В принципе, центр асимметрии можно считать тетраэдрическим, если в качестве четвертого заместителя принять неподеленную электронную пару гетероатома:
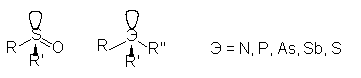
Оптическая активность может возникать и без хирального центра, за счет хиральности структуры всей молекулы в целом (молекулярная хиральность или молекулярная асимметрия). Наиболее характерными примерами являются наличие хиральной оси либо хиральной плоскости.
Хиральная ось возникает, например, в алленах, содержащих различные заместители при sp2-гибридных углеродных атомах. Легко видеть, что приведенные ниже соединения являются несовместимыми зеркальными изображениями, а значит оптическими антиподами:
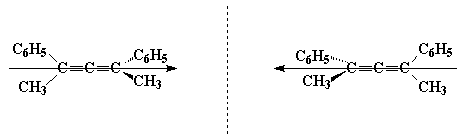
Другой класс соединений, имеющих хиральную ось - оптически активные бифенилы, которые имеют в орто-положениях объемистые заместители, затрудняющие свободное вращение вокруг С-С связи, соединяющей бензольные ядра:
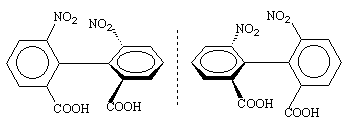
Хиральная плоскость характеризуется тем, что у нее можно различить "верх" и "низ", а также "правую" и "левую" стороны. Примером соединений с хиральной плоскостью могут служить оптически активный транс-циклооктен и оптически активное производное ферроцена:
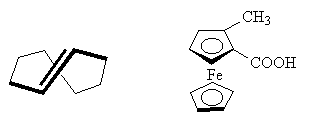
Соединения с несколькими асимметрическими атомами обладают важными особенностями, отличающими их от рассмотренных ранее более простых оптически активных веществ с одним центром асимметрии.
Допустим, что в молекуле некоего вещества имеются два асимметрических атома;
обозначим их условно А и Б. Легко видеть, что возможны молекулы со следующими
комбинациями:
|
|
(-) |
(-) |
|
(-) |
(+) |
|
Молекула
1 |
А |
Б |
Молекула
3 |
А |
Б |
|
|
(+) |
(+) |
|
(+) |
(-) |
|
Молекула
2 |
А |
Б |
Молекула
4 |
А |
Б |
Молекулы 1 и 2 представляют собой пару оптических антиподов; то же самое относится и к паре молекул 3 и 4. Если же сравнивать друг с другом молекулы из разных пар антиподов - 1 и 3, 1 и 4, 2 и 3, 2 и 4, то мы увидим, что перечисленные пары не являются оптическими антиподами: конфигурация одного асимметрического атома у них совпадает, конфигурация другого - не совпадает. Это пары диастереомеров, т.е. пространственных изомеров, не составляющих друг с другом оптических антиподов.
Диастереомеры отличаются друг от друга не только оптическим вращением, но и всеми другими физическими константами: у них разные температуры плавления и кипения, разные растворимости и др. Различия в свойствах диастереомеров зачастую ничуть не меньше, чем различия в свойствах между структурными изомерами.
Примером соединения рассматриваемого типа может случить хлоряблочная кислота.
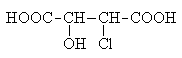
Ее стереоизомерные формы имеют следующие проекционные формулы:
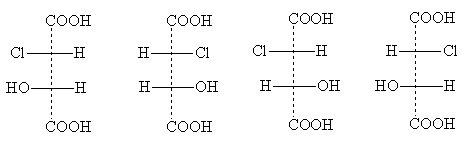
|
эритро-формы |
трео-формы |
Названия эритро- и трео- происходят от названий углеводов эритрозы и треозы. Эти названия употребляют для указания взаимного положения заместителей у соединений с двумя асимметрическими атомами: эритро-изомерами называют те, у которых два одинаковых боковых заместителя стоят в стандартной проекционной формуле на одной стороне (справа или слева); трео-изомерыимеют одинаковые боковые заместители на разных сторонах проекционной формулы. Два эритро-изомера представляют собой пару оптических антиподов, при их смешении образуется рацемат. Парой оптических изомеров являются и трео-формы; они тоже дают при смешении рацемат, отличающийся по свойствам от рацемата эритро-формы. Таким образом, всего существуют четыре оптически активных изомера хлоряблочной кислоты и два рацемата.
При дальнейшем росте числа асимметрических центров число пространственных изомеров возрастает, причем каждый новый асимметрический центр вдвое увеличивает число изомеров. Оно определяется формулой 2n, где n - число асимметрических центров.
Число стереоизомеров может уменьшаться из-за частичной симметрии, появляющейся в некоторых структурах. Примером может служить винная кислота, у которой число индивидуальных стереоизомеров сокращается до трех. Их проекционные формулы:
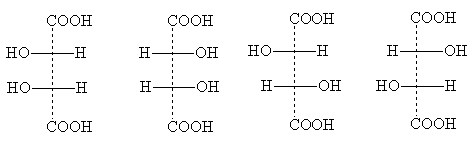
|
I |
Iа |
II |
III |
Формула I идентична с формулой Iа, так как превращается в нее при повороте на 180о в плоскости чертежа и, следовательно, не изображает нового стереоизомера. Это оптически неактивная модификация называется мезо-форма. Мезо-формы имеются у всех оптически активных веществ с несколькими одинаковыми (т.е. связанными с одинаковыми заместителями) асимметрическими центрами. Проекционные формулы мезо-форм всегда можно узнать по тому, что их можно разделить горизонтальной линией на две половины, которые по записи на бумаге формально идентичны, в действительности же зеркальны:
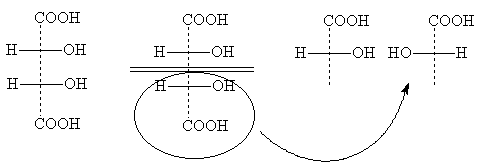
Формулы II и III изображают оптические антиподы винной кислоты; при их
смешении образуется оптически неактивный рацемат - виноградная кислота.
Номенклатура оптических изомеров
Самая простая, наиболее старая, однако и ныне еще употребляемая система номенклатуры оптических антиподов, основана на сравнении проекционной формулы называемого антипода с проекционной формулой некоего стандартного вещества, выбранного в качестве "ключа". Так, для a -оксикислот и a -аминокислот ключом является верхняя часть их проекционной формулы (в стандартной записи):

|
L-оксикислоты (Х = ОН) |
D-оксикислоты (Х = ОН) |
|
|
Конфигурацию всех a -оксикислот, имеющих в стандартно написанной проекционной формуле Фишера гидроксильную группу слева, обозначают знаком L; если же гидроксил расположен в проекционной формуле справа - знаком D
Ключом для обозначения конфигурации сахаров служит глицериновый альдегид:
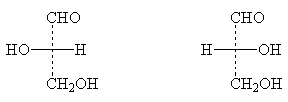
|
L-(-)-глицериновый альдегид |
D-(+)-глицериновый альдегид |
В молекулах сахаров обозначение D- или L- относится к конфигурации нижнего асимметрического центра.
Система D-,L-обозначений имеет существенные недостатки: во-первых, обозначение D- или L- указывает конфигурацию только одного асимметрического атома, во-вторых, для некоторых соединений получаются разные обозначения, в зависимости от того, взят ли в качестве ключа глицериновый альдегид или оксикислотный ключ, например:
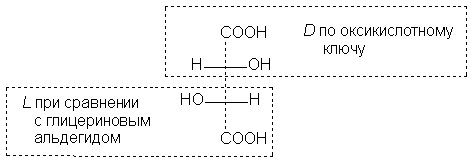
Эти недостатки системы ключей ограничивают ее применение в настоящее время тремя классами оптически активных веществ: сахарами, аминокислотами и оксикислотами. На общее же применение рассчитана R,S-система Кана, Ингольда и Прелога.
Для определения R- или S-конфигурации оптического антипода необходимо расположить тетраэдр заместителей вокруг асимметрического углеродного атома таким образом, чтобы младший заместитель (обычно это водород) имел направление "от наблюдателя". Тогда, если движение при переходе по кругу трех остальных заместителей от старшего к среднему по старшинству и затем к самому младшему происходит против часовой стрелки - это S-изомер (ассоциируется с таким же движением руки при написании буквы S), если по часовой стрелке - это R-изомер (ассоциируется с движением руки при написании буквы R).
Для определения старшинства заместителей у асимметрического атома используются правила подсчета атомных номеров, уже рассмотренные нами в связи с Z,E-номенклатурой геометрических изомеров.
Для выбора R,S-обозначений по проекционной формуле необходимо путем четного числа перестановок (не изменяющих, как мы знаем, стереохимического смысла формулы) расположить заместители так, чтобы младший из них (обычно водород) оказался внизу проекционной формулы. Тогда старшинство остальных трех заместителей, падающее по часовой стрелке, соответствует обозначению R, против часовой стрелки - обозначению S:
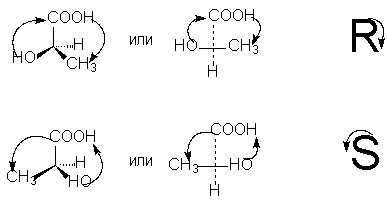
5. Методы получения стереоизомеров
Получение чистых стереоизомеров – важная задача, так как, как правило, только одна из стереоизомерных форм является биологически активной. Между тем, в обычных условиях образуются, как правило, смеси стереоизомеров - диастереомеров или оптических антиподов. Для получения чистых стереоизомерных форм эти смеси необходимо разделять.
Так как диастереомеры различаются по физическим свойствам, разделение их смесей обычно не вызывает затруднений. В отличие от этого, получение оптически активных веществ - более сложная задача, потому что оптические антиподы не различаются ни по растворимости, ни по температурам кипения, ни по адсорбционному сродству к обычным адсорбентам, т.е. обычными методами пару оптических антиподов разделить нельзя. Во всех случаях оптически активное вещество генерируется только под действием другого оптически активного вещества (реагента, растворителя, адсорбента) и антиподы проявляют различия в свойствах только при действии других оптически активных веществ (реагентов, растворителей, адсорбентов или плоскополяризованного света).
Важным источником оптически активных вещвств является живая природа: оптической активностью обладают белки и составляющие их природные аминокислоты, углеводы, многие природные оксикислоты (винная, яблочная, миндальная), терпеновые углеводороды, терпеновые спирты и кетоны, стероиды, алкалоиды и др. Синтетическое получение оптически активных веществ основано на использовании двух методов.
1. Расщепление рацематов, т.е. отделение друг от друга оптических антиподов, входящих в состав рацемата.
2. Асимметрический синтез - проведение стереоспецифичных реакций, в ходе которых преимущественно образуется (или преимущественно разрушается) один из антиподов.
Расщепление рацематов
А. Расщепление рацематов отбором кристаллов и самопроизвольной кристаллизацией
Впервые оптически активное вещество из неактивного получил Пастер в 1848 году путем отбора кристаллов, так как кристаллы оптических изомеров отличаются друг от друга по форме. Вручную разделив оба вида кристаллов и приготовив из них водные растворы, Пастер обнаружил, что в отличие от исходной соли эти растворы оптически активны: один вид кристаллов дал левовращающий, а другой правовращающий раствор.
К методу расщепления рацематов отбором кристаллов примыкает расщепление кристаллизацией, протекающее как бы "самопроизвольно". Чаще всего такого рода "самопроизвольное" выделение одного из антиподов из раствора рацемата удается вызвать, внося в пересыщенный раствор рацемата "затравку" одного из антиподов.
Б. Расщепление через диастереомеры.
Способ расщепления через диастереомеры является практически наиболее важным для получения оптически активных веществ. В определенных случаях с ним может конкурировать лишь биохимический метод. Суть способа может быть выражена следующей схемой:
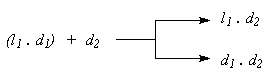
На расщепляемый рацемат ll . d1 действуют оптическим активным реагентом d2, в результате чего получается новая пара веществ l1 . d2 и d1 . d2, уже не находящиеся друг с другом в отношениях антиподов. Эти вещества диастереомерны, а значит различаются по физическим свойствам.
Практически чаще всего используют диастереомерные соли. Для расщепления рацемических кислот необходимы оптически активные основания, для расщепления рацемических оснований - оптически активные кислоты.
Для расщепления рацемических аминокислот можно использовать как солеобразование по карбоксильной группе, так и солеобразование по аминогруппе
В. Адсорбционное расщепление.
Оптические антиподы по-разному сорбируются на оптически активном адсорбенте. Так, кварц, способный образовывать хиральные кристаллы, имеет разную адсорбционную способность по отношению к оптическим антиподам. В качестве органических асимметрических адсорбентов используются лактоза, бруцин, крахмал. Можно использовать синтетические полимеры, в состав которых ведены остатки оптически активных аминов или кислот.
Д. Биохимическое получение оптически активных веществ.
Еще в 1857 году Пастером было замечено преимущественное разрушение некоторыми микроорганизмами (например, плесневым грибком Penicillum glaucum) правовращающей формы винной кислоты. Если же действию грибка подвергался рацемат, то не затрагиваемый левовращающий антипод можно было накопить и получить в чистом виде.
Биохимический метод особенно успешно используется для получения оптически активных аминокислот. Так, дрожжи в процессе брожения перерабатывают преимущественно L-формы аминокислот, а D-антиподы накапливаются и могут быть выделены. В настоящее время используют выделенные из микроорганизмов ферментативные препараты, что позволяет получить в чистом виде оба антипода (см. лек.47).
Асимметрический синтез
Асимметрический синтез - второй важнейший путь получения оптически активных веществ. Сущность асимметрического синтеза состоит в проведении реакций, в ходе которых антиподы образуются или разрушаются в неравных количествах. Различают следующие типы асимметрических синтезов:
1. Частичный асимметрический синтез, осуществляемый при участии вспомогательных оптически активных веществ, созданных живой природой. Обычно они используются в качестве катализаторов и приводят к асимметрическому синтезу без участия живых организмов.
2. Абсолютный асимметрический синтез - процессы получения оптически активных веществ без участия вспомогательных оптически активных веществ или каких-либо иных факторов, зависящих от живой природы. Такие синтезы осуществлены при использовании в качестве хиральных вспомогательных систем – либо циркулярнополяризованного света, либо поверхностей (правой или левой модификаций) кристаллов кварца с нанесенными на них катализаторами. Осуществление абсолютного асимметрического синтеза имеет принципиальное значение, так как связано с ответом на вопрос о возникновении первичной асимметрии и, следовательно, о происхождении живой материи.