Термодинамика
растворов. Коллигативные свойства растворов. Осмос. Законы Рауля. Классификация
растворов.
Общие (коллигативные) свойства растворов.
Общие свойства растворов не зависят от природы
растворенного вещества.
Закон
Рауля (не накладывает ограничения
для летучих веществ).
Давление
пара растворителя над раствором прямо
пропорционально молярной доле растворителя.
![]()
N1 –
молярная доля растворителя (отношение числа моль растворителя к числу моль раствора);
N2 –
молярная доля растворенного вещества;
![]() - давление пара над
чистым растворителем.
- давление пара над
чистым растворителем.
Давление пара над раствором меньше, чем давление пара
над чистым растворителем.
N1 + N2
= 1
N1 = 1 –
N2
![]()
![]()
![]()
Понижение давления пара
![]()
Понижение давления пара растворителя над раствором по
сравнению с давлением пара над чистым растворителем прямо пропорционально молярной
доле растворенного вещества.
![]() – относительное
понижение давления пара.
– относительное
понижение давления пара.
В таком виде закон Рауля справедлив для разбавленных
растворов неэлектролитов.
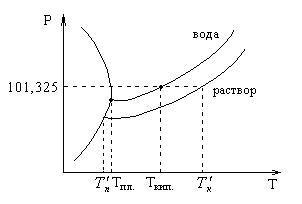
![]()
![]() – температура кипения
раствора;
– температура кипения
раствора;
![]() – температура
замерзания раствора.
– температура
замерзания раствора.
![]()
![]()
К – криоскопическая постоянная;
Е – эбулиоскопическая постоянная;
m – моляльность (моляльная концентрация) раствора.
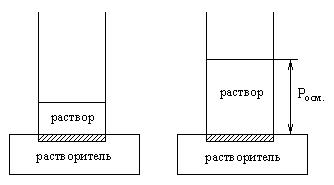
Осмотическое давление растворов.
Осмотическое давление – равновесное давление раствора, препятствующее
диффузии растворителя через пористую перегородку.
![]() - закон Вант - Гоффа.
- закон Вант - Гоффа.
с – концентрация.
Чем выше концентрация, тем выше осмотическое давление.
Все ограничения, относящиеся к закону Рауля, относятся и к закону Вант – Гоффа.
Будем изучать истинные
растворы, т.е. растворы, имеющие молекулярно – атомные виды частиц растворённого
вещества.
В ходе исследования свойств растворов возникает
необходимость теоретической и математической обработки различных опытных
данных, которые получены экспериментально. Различные растворы описываются различными
закономерностями. В связи с этим для математической обработки пользуются
свойствами растворов или системами с узко ограниченными характеристиками.
Например: истинные растворы делятся на
идеальные и реальные, в свою очередь реальные подразделяются на бесконечно
разбавленные, совершенные, регулярные, атермальные.
Классификация растворов.
Идеальный
раствор – гомогенная однородная
система.
Модель идеального раствора:
1.Частицы растворенного вещества и растворителя
рассматривают как математические точки без размера, поэтому при образовании
раствора изменение объема системы равно нулю.
2.Взаимодействие между частицами отсутствует, поэтому DН = 0.
3.Степень хаотичности в растворе выше, чем в отдельных
компонентах (DS > 0). Такие растворы описываются своими
законами. При изучении реальных систем смотрят, насколько они отличаются от
систем идеальных. Вскрываются причины отклонения от законов идеальных
растворов.
ΔG = ΔН – ТΔS
ΔG = –TΔS
Другой особенностью идеальных растворов является то,
что в нём 2 компонента подчиняются одним и тем же законам, для реальных систем
растворитель и растворённое вещество подчиняются разным законам.
В реальных системах иногда удаётся составить из
реальных компонентов идеальные растворы.
Реальные
растворы:
1. совершенные,
2. бесконечно разбавленные,
3. регулярные,
4. атермальные,
Совершенные реальные растворы – такие растворы, которые во всём диапазоне
концентраций подчиняются законам идеальных растворов. Примеры – смеси близких по
составу углеводородов.
Отличительная особенность: их очень мало, частицы, из
которых состоит такой раствор, математически неточны, значит, их нельзя назвать
идеальными с точки зрения термодинамики: ΔH = 0,
ΔV = 0,
ΔS > 0, ΔG < 0.
К совершенным растворам относятся такие системы, в
которых размеры и свойства частиц мало отличаются друг от друга. Так что
эффектами взаимодействия и изменения объема можно пренебречь.
Атермальные растворы.
DV ¹ 0, DН = 0, DS > 0, DG < 0
У атермальных растворов мольные объёмы компонентов
резко отличаются по свойствам, т.е. размеры их частиц резко отличаются друг от
друга, – в этом причина неподчинения законам идеальных растворов.
Бесконечно разбавленные – мольные доли компонента N1, N2. (1) –
растворитель, (2) – растворённое вещество. Условия образования бесконечно
разбавленных растворов аналогичны условиям образования идеальных растворов. В
случае бесконечно разбавленных растворов пренебрегают одним видом
взаимодействия – взаимодействием между частицами растворённого вещества. В бесконечно
разбавленных растворах растворитель и растворённое вещество подчиняются различным
законам.
Модель бесконечно разбавленного раствора очень близка
к модели идеального раствора, поэтому количественные взаимодействия для них выводятся
на основании приближения к идеальным растворам.
Регулярные – DH ¹ 0, DV = 0, DS > 0, DG < 0,
то есть наблюдается тепловой эффект. Мы знаем, что для самопроизвольности DG <0, а DG = DH – TDS:
DH < 0, Þ DG < 0;
DH > 0, Þ DG > 0,
DG > 0, если ½DH½ < ½TDS½
В регулярных растворах размеры частиц не сильно
отличаются друг от друга, поэтому объем практически не меняется, а
взаимодействием частиц пренебречь нельзя.
Основные
термодинамические соотношения для растворов.
Состояние чистых компонентов определяется
термодинамическими параметрами (параметры: 1) экстенсивности и 2)
интенсивности). К первым можно отнести V, U, H, F, G –
все они зависят от массы вещества. Обозначим все эти экстенсивные свойства
буквой g.
Основные свойства системы можно разделить на
интегральные и дифференциальные (парциальные). Об интегральных свойствах
говорят тогда, когда во взаимодействие вступают чистые компоненты. Интегральная
теплота чистого растворения – это то количество теплоты, которое выделяется или
поглощается при смешении чистых компонентов.
Если к бесконечно большому количеству раствора
добавлять определённое количество одного из компонентов, то изменение
экстенсивного свойства раствора называются дифференциальным (парциальным).
Например, дифференциальные или интегральные свойства
можно отнести к 1 г вещества или же к 1 молю, тогда они называются удельными (к
грамму) или мольными (к молю).
Парциальное давление не является парциальной мольной
величиной, т.к. парциальное давление не связано с массой вещества.
Другой особенностью дифференциальных и интегральных
свойств является то, что они рассчитываются при постоянном давлении и
температуре (T = const, P = const).
Отсюда парциальную величину можно определить:
gi = (¶g/¶n)T,P,
парциальная мольная величина i-го компонента
является результатом введения 1 моля вещества при Т,Р = const и постоянстве количества числа молей всех остальных
компонентов.
Если подставить в эту производную значения V, U, H, G, то мы получим
парциальные мольные величины рассмотренных термодинамических параметров.
Gi = (¶G/¶ni)T,P,ni-
Мы знакомы с 1 парциальной мольной величиной, а именно
с химическим потенциалом mi , который есть парциальная мольная величина. Покажем
это.
Мы знаем G = f(P,T,n1,n2,...,ni), G - функция
состояния, поэтому
dG=(¶G/¶T)P,ni dT+(¶G/¶P)T,ni dT +(¶G/¶n1)P,T,nidni
при Р, Т = const:
dG = S(¶G/¶ni)P,T,ni
dni = Smi dni = SGni dni
В данном случае понятие химического потенциала и
парциальной величины совпало.
Физический
смысл – химический потенциал есть
парциальная мольная величина изобарно-изотермического потенциала.
Пусть мы имеем смесь, которая содержит большое
количество молей веществ, прибавим 1 моль вещества. Это существенно не изменит
Р, С и V, будет происходить только изменение
изобарно-изотермического потенциала, которое будет равно парциальному молю
данного вещества в смеси. Это изменение G и является химическим потенциалом. Химический
потенциал, выраженный через другие термодинамические функции, не является парциальной
мольной величиной.
Законы Рауля.
Первый закон
Рауля.
Устанавливает кинетическую зависимость давления
насыщенного пара растворителя над раствором от мольной доли растворителя. При
выводе первого закона Рауля используются следующие предпосылки:
1.раствор бесконечно разбавлен, N1
= 1, N2
= 0, при N1
+ N2
= 1.
N1 –
мольная доля растворителя, N2 – мольная доля растворенного вещества.
2.Растворитель летуч, растворенное вещество – нелетуче.
Это значит, что растворитель имеет газовую фазу над жидкостью и кристаллами, а
растворенное вещество имеет только конденсированные фазы в растворе. В результате,
в системе устанавливается следующее равновесие:
газ – растворитель
ж – раствор
кр – растворитеь
![]() – давление насыщенного пара над чистым растворителем.
– давление насыщенного пара над чистым растворителем.
![]() – 1 фoрмa
– 1 фoрмa
Давление
насыщенного пара растворителя над раствором и прямо пропорционально мольной
доле растворителя.
![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
;
![]()
![]() – 2 форма
– 2 форма
Понижение
давления насыщенного пара растворителя пропорционально мольной доле растворенного
вещества.
![]() – 3 форма
– 3 форма
Относительное понижение давления насыщенного пара
растворителя равно мольной доле растворенного вещества.