Лекция 23. Основы линейной неравновесной термодинамики. Линейная
термодинамика необратимых процессов (основные понятия и определения). Источник
энтропии. Соотношение Онзагера.
Оглавление
Возникновение
энтропии в открытых системах.
Непрерывные
системы. Соотношение Онзагера. Стационарное состояние непрерывной системы.
Стационарные
состояния в непрерывных системах.
Диффузия
в системах с однородной и неоднородной температурой.
Впервые в 1854г термодинамические соотношения применил
В. Томпсон (Кельвин) к изучению неравновесных процессов.
В 1922г Де-Донде связал ²нескомпенсированную теплоту² Клаузиуса и химическое сродство.
В 1931г Онзагер сформулировал соотношения взаимности, которые
явились основой изучения связи различных неравновесных процессов в линейной
области.
Дальнейшее развитие
неравновесной термодинамики и обосование ее
формализма связано с именами И. Пригожина, Глансдорфа,
Казимира.
Общая формулировка
второго закона термодинамики: ![]() , причем знак = относится к равновесному процессу, а знак >
характеризует самопроизвольный неравновесный процесс и обычно используется лишь
в качестве критерия направленности процессов в изолированных системах.
, причем знак = относится к равновесному процессу, а знак >
характеризует самопроизвольный неравновесный процесс и обычно используется лишь
в качестве критерия направленности процессов в изолированных системах.
Для второго случая Р. Клаузиус предложил другую форму записи:
![]() или
или ![]() , где
, где ![]() - ²нескомпенсированная теплота² в
терминологии Клаузиуса, т.е. та теплота, которая была
бы поглощена при равновесном процессе дополнительно к неравновесному количеству
- ²нескомпенсированная теплота² в
терминологии Клаузиуса, т.е. та теплота, которая была
бы поглощена при равновесном процессе дополнительно к неравновесному количеству
![]() , с тем чтобы восстановилось
равенство:
, с тем чтобы восстановилось
равенство: ![]() , т.е. для равновесных процессов
, т.е. для равновесных процессов ![]() = 0 , а для
неравновесных
= 0 , а для
неравновесных ![]() > 0.
> 0.
Физический смысл ²нескомпенсированной теплоты² можно определить следующим образом: разделим
полное изменение энтропии на две части – внешнюю, связанную с равновесным
поглощением теплоты извне, и внутреннюю, вызванную неравновесными процессами
внутри системы, т.ч. ![]() , причем
, причем ![]() ,
, ![]() . Последнее соотношение связывает ²нескомпенсированную теплоту² с т.н. возникновением энтропии в
системе, вследствие протекающих в ней неравновесных процессов. Неравновесные
процессы, протекают с конечной скоростью и их изучение по существу – область
кинетики, поэтому в рассмотрение вводится время t. Так если энтропия
. Последнее соотношение связывает ²нескомпенсированную теплоту² с т.н. возникновением энтропии в
системе, вследствие протекающих в ней неравновесных процессов. Неравновесные
процессы, протекают с конечной скоростью и их изучение по существу – область
кинетики, поэтому в рассмотрение вводится время t. Так если энтропия ![]() возникает за время dt, то можно говорить о скорости
возникновения энтропии:
возникает за время dt, то можно говорить о скорости
возникновения энтропии: ![]() . Для изолированной системы, в которой нет изменения энергии и массы полное изменение энтропии запишется:
. Для изолированной системы, в которой нет изменения энергии и массы полное изменение энтропии запишется: ![]() .
.
²Нескомпенсированную теплоту²
можно связать с изменением основных термодинамических функций и получить
критерий неравновесности процесса:
![]() , где
, где ![]() или
или ![]() .
.
При S = const, V = const ® ![]()
![]() ;
; ![]() ;
; ![]() .
.
Если химическая реакция
идет в прямом направлении и сопровождается изменением числа молей dni, то изменение любой химической
переменной z определяется соотношением: ![]() , ni – стехиометрический коэффициент определяет полноту реакции.
, ni – стехиометрический коэффициент определяет полноту реакции.
Де-Донде ввел определение химического
сродства А
через ²нескомпенсированную теплоту²: ![]() - неравенство Де-Донде.
- неравенство Де-Донде.
Связь между А и
алгебраической суммой химических потенциалов реагентов устанавливается на
основе определения химического потенциала: 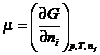
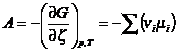 . Вант-Гофф и Гельмгольц в качестве меры химического сродства
применяли
. Вант-Гофф и Гельмгольц в качестве меры химического сродства
применяли ![]() . Отличие такое же как между средней
скоростью и истиной. Определим по Де-Донде скорость
реакции по всей системе:
. Отличие такое же как между средней
скоростью и истиной. Определим по Де-Донде скорость
реакции по всей системе: ![]() ,
, ![]() ,
, ![]() отсюда вследствие соотношения А и V, т.е.
отсюда вследствие соотношения А и V, т.е. ![]()
![]()
![]() , тогда с учетом скорости возникновения энтропии в химической
реакции можно записать
, тогда с учетом скорости возникновения энтропии в химической
реакции можно записать ![]() этому выражению
соответствует следующее определение, присущее термодинамике неравновесных
процессов: скорость возникновения энтропии, умноженная на абсолютную
температуру, равна произведению некоторой обобщенной силы А на вызываемый ею обобщенный поток V.
этому выражению
соответствует следующее определение, присущее термодинамике неравновесных
процессов: скорость возникновения энтропии, умноженная на абсолютную
температуру, равна произведению некоторой обобщенной силы А на вызываемый ею обобщенный поток V.
Возникновение энтропии в открытых системах.
Открытые системы способны
обмениваться с окружающей средой, как энергией, так и веществом. Для открытой
системы первый закон термодинамики можно записать в форме: ![]() и
и ![]() , здесь dU и dH полное суммарное изменение
внутренней энергии и энтальпии. dФ – поток энергии, получаемый системой за время
, здесь dU и dH полное суммарное изменение
внутренней энергии и энтальпии. dФ – поток энергии, получаемый системой за время ![]() как вследствии теплопередачи, так и вместе с потоком вещества.
Согласно второму закону термодинамики, внутри любой системы энтропия может только
создаваться, но не уничтожаться. Поэтому для открытой системы баланс энтропии
запишется в виде:
как вследствии теплопередачи, так и вместе с потоком вещества.
Согласно второму закону термодинамики, внутри любой системы энтропия может только
создаваться, но не уничтожаться. Поэтому для открытой системы баланс энтропии
запишется в виде: ![]() . Полная энтропия:
. Полная энтропия: ![]() , где SV – локальная энтропия, рассчитанная в
единице объема в каждом элементе объема. Тогда скорость возникновения энтропии
также должна рассматриваться в элементе объема системы:
, где SV – локальная энтропия, рассчитанная в
единице объема в каждом элементе объема. Тогда скорость возникновения энтропии
также должна рассматриваться в элементе объема системы: ![]() . Если единственным неравновесным процессом является
химическая реакция, то
. Если единственным неравновесным процессом является
химическая реакция, то ![]() , здесь
, здесь ![]() - локальная скорость. Но в системе может одновременно
протекать несколько реакций, тогда
- локальная скорость. Но в системе может одновременно
протекать несколько реакций, тогда ![]() , где
, где ![]() , взятая по всем реакциям должна быть положительной, тогда
как отдельные члены суммы могут быть отрицательными, если только сумма
остальных членов достаточно велика, чтобы обеспечить s>0.
Так возникает представление о возможной связи между потоками и обобщенными
силами. В химии оно проявляется в наличии сопряженных реакций, идущих с
отрицательным сродством. Аналогично рассматривается возникновение энтропии,
связанное с диффузией и тепловым потоком, но при этом всегда sобщ.>0.
, взятая по всем реакциям должна быть положительной, тогда
как отдельные члены суммы могут быть отрицательными, если только сумма
остальных членов достаточно велика, чтобы обеспечить s>0.
Так возникает представление о возможной связи между потоками и обобщенными
силами. В химии оно проявляется в наличии сопряженных реакций, идущих с
отрицательным сродством. Аналогично рассматривается возникновение энтропии,
связанное с диффузией и тепловым потоком, но при этом всегда sобщ.>0.
Непрерывные системы. Соотношение Онзагера. Стационарное состояние
непрерывной системы.
Непрерывными называются системы, которые не имеют ярко выраженных поверхностей
раздела, но являются гомогенными, т.к. их свойства непрерывно меняются от точки
к точке.
Будем считать, что для
каждой точки такой системы можно определить любое экстенсивное свойство g в виде его локального интенсивного значения gV: ![]() , количество gV будет плотностью свойства g. При этом gV связано с массовым количеством gm через плотность:
, количество gV будет плотностью свойства g. При этом gV связано с массовым количеством gm через плотность: ![]() . В основе термодинамики неравновесных процессов в
непрерывных системах лежит уравнение Гиббса для изменения энтропии гомогенной
системы:
. В основе термодинамики неравновесных процессов в
непрерывных системах лежит уравнение Гиббса для изменения энтропии гомогенной
системы: ![]() , разделим на общую массу системы, приведя его к единице
массы:
, разделим на общую массу системы, приведя его к единице
массы: ![]() . Здесь химический потенциал определен локально:
. Здесь химический потенциал определен локально: 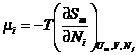 . Согласно основному допущению термодинамики неравновесных
процессов, приведенное к единице массы уравнение Гиббса сохраняет значение и в
некоторой области вне равновесия, следовательно, его можно записать для
изменений в элементе массы центра масс, движущегося вдоль линии движения:
. Согласно основному допущению термодинамики неравновесных
процессов, приведенное к единице массы уравнение Гиббса сохраняет значение и в
некоторой области вне равновесия, следовательно, его можно записать для
изменений в элементе массы центра масс, движущегося вдоль линии движения: ![]() . Это уравнение можно преобразовать и получить выражение для
локального баланса энтропии, из которого следует, что элемент объема может
получить энтропию извне засчет проникновения вещества
со скоростью, вследствие теплового потока W из окружающей среды, а также засчет диффузии каждого компонента со скоростью Di. Кроме того, энтропия возникает
внутри рассматриваемого элемента объема с определенной скоростью засчет химической реакции в связи с потоком теплоты и
диффузионным потоком. Обозначим потоки через Ji и обобщенные силы (сродство) xi, тогда согласно второму закону
термодинамики источник энтропии примет вид:
. Это уравнение можно преобразовать и получить выражение для
локального баланса энтропии, из которого следует, что элемент объема может
получить энтропию извне засчет проникновения вещества
со скоростью, вследствие теплового потока W из окружающей среды, а также засчет диффузии каждого компонента со скоростью Di. Кроме того, энтропия возникает
внутри рассматриваемого элемента объема с определенной скоростью засчет химической реакции в связи с потоком теплоты и
диффузионным потоком. Обозначим потоки через Ji и обобщенные силы (сродство) xi, тогда согласно второму закону
термодинамики источник энтропии примет вид: ![]() . Вблизи состояния термодинамического равновесия, где силы
малы, можно разложить зависимость потоков от сил вблизи нуля, чтобы сохранить
только линейную зависимость. В этом случае можно постулировать линейное
соотношение между потоками и силами, это соотношение называется уравнением Онзагера:
. Вблизи состояния термодинамического равновесия, где силы
малы, можно разложить зависимость потоков от сил вблизи нуля, чтобы сохранить
только линейную зависимость. В этом случае можно постулировать линейное
соотношение между потоками и силами, это соотношение называется уравнением Онзагера:
![]() , где суммирование ведется по всем неравновесным процессам,
это уравнение имеет силу для систем, состояние которых мало отличается от равновесных.
, где суммирование ведется по всем неравновесным процессам,
это уравнение имеет силу для систем, состояние которых мало отличается от равновесных.
Вторым соотношением является
теорема взаимностей Онзагера:
в пределах действительности линейного приближения коэффициент
пропорциональности Lik должен удовлетворять условию симметрии: Lik = Lki , ![]() ,
, ![]() . Отсюда следует равенство перекрестных производных:
. Отсюда следует равенство перекрестных производных: ![]()
![]() . Наличие эффективных связей между двумя неравновесными
процессами устанавливают с помощью опыта. Если экспериментально установлено
существование связей между данной силой xk и потоком Ji, то согласно соотношению Онзагера будет существовать и обратная связь между силой xi и потоком Jk.
. Наличие эффективных связей между двумя неравновесными
процессами устанавливают с помощью опыта. Если экспериментально установлено
существование связей между данной силой xk и потоком Ji, то согласно соотношению Онзагера будет существовать и обратная связь между силой xi и потоком Jk.
Согласно
экспериментальным наблюдениям Фурье, Фика, Ома и др.
каждый поток пропорционален сопряженной с ним силе, причем здесь появляется
прямой коэффициент пропорциональности, который обозначается Lkk или Lii и прямые коэффициенты проявляются на диагонали
матрицы сил ряда уравнений Онзагера, в которых есть
перекрестные коэффициенты Lik и Lki.
Стационарные состояния в непрерывных системах.
Особенностью
стационарного состояния, в котором свойства системы не зависят от времени, является
то, что при некотором условии они характеризуются минимальным возникновением
энтропии. Эта особенность проявляется при условии постоянства
феноменологических коэффициентов. Теорема о минимальном возрастании энтропии
при внутренних процессах diS, выведенное Пригожиным, относится
ко всем процессам, к которым строго применимы линейные уравнения и соотношения
взаимностей Онзагера.
При состояниях системы,
достаточно близких к равновесным, при одинаковых
значениях действующей внешней силы, величина приращения энтропии при внутренних
процессах diS имеет наименьшее значение и
стремится к нулю при стационарном состоянии системы. Например, если два сосуда,
соединенных капилляром или разделенных мембраной, в которых находится одинаковая
газовая смесь, поместить в резервуары с разной температурой, то изменение
энтропии diS будет определяться термическим JT и концентрационным Jk потоками, вследствие различия Т и химического
потенциала данного газа. По уравнению Онзагера с
учетом соотношения взаимностей будем иметь: ![]() при этом поток
при этом поток ![]() ,
, ![]() и
и ![]() . Отсюда
. Отсюда ![]() .
Определим производную по xk:
.
Определим производную по xk: 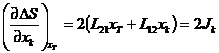 при стационарном состоянии
при стационарном состоянии 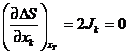 , т.е.
минимальное изменение энтропии будет соответствовать стационарному состоянию.
, т.е.
минимальное изменение энтропии будет соответствовать стационарному состоянию.
Данная теорема применима
и к скорости приращения энтропии при внутренних процессах. Рассмотрим случай,
когда в системе происходит перенос вещества XM и перенос энергии XT между двумя фазами с разной, но постоянной
температурой. В этом случае скорость возникновения энтропии запишется: 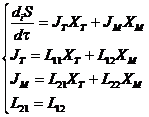
![]()
![]() -для стационарного состояния. Точка
экстремума является точкой минимума, т.к.
-для стационарного состояния. Точка
экстремума является точкой минимума, т.к. ![]() .
.
Диффузия в системах с однородной и неоднородной температурой.
Запишем уравнение Гиббса
для изобарного потенциала, отнесенного к единице объема, это будет ![]() , где
, где ![]() - концентрация.
- концентрация. 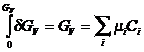 . Взяв полный дифференциал этого выражения
и сравнив его с исходным выражением, получим уравнение Гиббса-Дюгема в локальной форме:
. Взяв полный дифференциал этого выражения
и сравнив его с исходным выражением, получим уравнение Гиббса-Дюгема в локальной форме: ![]() или при T = const
или при T = const ![]() . Здесь вариация d означает применимость уравнений к
открытым системам. Для систем с непрерывно изменяющимися переменными
дифференциал по координатам дает следующее выражение для диффузии в невязкой
жидкости:
. Здесь вариация d означает применимость уравнений к
открытым системам. Для систем с непрерывно изменяющимися переменными
дифференциал по координатам дает следующее выражение для диффузии в невязкой
жидкости: ![]() , где Fi – сила,
действующая на 1 моль компонента. Для скорости возникновения энтропии
вследствие диффузии
, где Fi – сила,
действующая на 1 моль компонента. Для скорости возникновения энтропии
вследствие диффузии ![]()
![]() - выражение
диффузионного сродства. Для двухкомпонентной системы имеет место соотношение:
- выражение
диффузионного сродства. Для двухкомпонентной системы имеет место соотношение: ![]() в области малых
значений диффузионного сродства поток
в области малых
значений диффузионного сродства поток ![]() подчиняется линейному
соотношению
подчиняется линейному
соотношению ![]() ,
, ![]() - скорость диффузии i – компонента. Отсюда следует
выражение для диффузионной скорости возникновения энтропии в среде с однородной
температурой:
- скорость диффузии i – компонента. Отсюда следует
выражение для диффузионной скорости возникновения энтропии в среде с однородной
температурой: 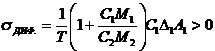 . Данное соотношение показывает, что в бинарной системе имеется
единственный диффузионный поток в случае однородной температуры. В системах с
неоднородной температурой скорость возникновения энтропии вследствие переноса
теплоты и диффузии будет суммарной:
. Данное соотношение показывает, что в бинарной системе имеется
единственный диффузионный поток в случае однородной температуры. В системах с
неоднородной температурой скорость возникновения энтропии вследствие переноса
теплоты и диффузии будет суммарной: 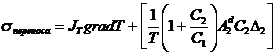 . Используя соотношение Онзагера, получим
следующее выражение для теплового и диффузионного потоков:
. Используя соотношение Онзагера, получим
следующее выражение для теплового и диффузионного потоков: 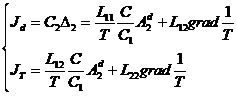 Эти линейные уравнения
предсказывают существование взаимосвязи и взаимовлияния двух потоков или двух
эффектов: термодиффузии (эффект Соре) и диффузионного термоэффекта
(эффект Дюфура). Эффект Соре
возникает тогда, когда смесь газов или жидкий раствор находится в сосуде, одна
часть которого поддерживается при более высокой температуре, чем другая. При
эффекте Дюфура gradT возникает и устанавливается в системе
в результате поддержания различия состава воздействием извне. Эффект Дюфура наблюдался при смешении путем взаимной диффузии
газов первоначально одинаковой температуры. При этом поток JT должен быть равен
Эти линейные уравнения
предсказывают существование взаимосвязи и взаимовлияния двух потоков или двух
эффектов: термодиффузии (эффект Соре) и диффузионного термоэффекта
(эффект Дюфура). Эффект Соре
возникает тогда, когда смесь газов или жидкий раствор находится в сосуде, одна
часть которого поддерживается при более высокой температуре, чем другая. При
эффекте Дюфура gradT возникает и устанавливается в системе
в результате поддержания различия состава воздействием извне. Эффект Дюфура наблюдался при смешении путем взаимной диффузии
газов первоначально одинаковой температуры. При этом поток JT должен быть равен ![]() . Этот эффект еще не наблюдался в жидкости. Существование
эффекта Соре вытекает из следующих соображений: при N2=0 gradT¹0
. Этот эффект еще не наблюдался в жидкости. Существование
эффекта Соре вытекает из следующих соображений: при N2=0 gradT¹0 ![]() , где
, где ![]() - коэффициент
теплопроводности. С=С1+С2
- коэффициент
теплопроводности. С=С1+С2
![]() отсюда следует, что
если однородную систему нагревать с одного конца и охлаждать с другого, то
возникает диффузия и частицы второго вещества будут концентрироваться у теплого
конца, если L12>0 или у холодного, если L12<0. Термодиффузия
применяется при разделении изотопов 235U и 238U в парах UF6.
отсюда следует, что
если однородную систему нагревать с одного конца и охлаждать с другого, то
возникает диффузия и частицы второго вещества будут концентрироваться у теплого
конца, если L12>0 или у холодного, если L12<0. Термодиффузия
применяется при разделении изотопов 235U и 238U в парах UF6.
Электрокинетические эффекты.
Методом неравновесной
термодинамики с помощью соотношений Онзагера можно
рассмотреть взаимосвязи между различными электрокинетическими эффектами,
возникающими в системе при наличии разности потенциалов или ведущим к ее
возникновению. Рассмотрим систему, состоящую из двух сосудов, соединенных
пористой перегородкой. Температура и концентрация предполагается одинаковой во
всей системе, две фазы отличаются только давлением и электрическим потенциалом.
В этом случае имеет место возникновение энтропии вследствие переноса вещества
из одного сосуда в другой: ![]() , здесь
, здесь ![]() - электрохимическое
сродство.
- электрохимическое
сродство. 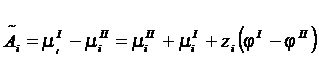 , при
, при 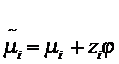 ,
, ![]() - кратность зарядов ионов. Парциальный мольный объем
- кратность зарядов ионов. Парциальный мольный объем ![]()
![]() . Выражение для потока имеет вид
. Выражение для потока имеет вид ![]() - ²поток
объема² – результирующий поток вещества,
- ²поток
объема² – результирующий поток вещества, ![]() - электрический ток засчет переноса заряда от I к II
фазе.
- электрический ток засчет переноса заряда от I к II
фазе. ![]() .
.
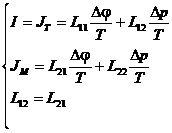 Отсюда при I=0
Отсюда при I=0 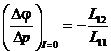 - потенциал течения.
- потенциал течения.
При Dp=0 ![]() - электроосмотический эффект.
- электроосмотический эффект.
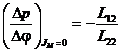 - электроосмотическое
давление.
- электроосмотическое
давление.
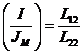 - электрический ток
течения.
- электрический ток
течения.