Лекция 27. Элементарный акт химического превращения. Поверхность потенциальной энергии. Истинная энергия активации.
Оглавление
Элементарные
акты химических реакций
Поверхность
потенциальной энергии
Элементарные акты химических реакций
Химические
реакции в которых переход реагирующих частиц в продукты реакции протекает в
одну стадию называются элементарными реакциями.
Элементарные
акты химического превращения могут весьма разнообразны:
1.Цис-, транс- изомерия
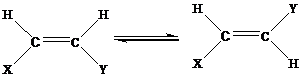
2.распад
молекулы
![]()
3.взаимодействие
частиц в обменных реакциях:
![]()
4.Взаимодействие
нескольких частиц:
![]()
5.Взаимодействие
со стенкой сосуда:
![]()
В
элементарном акте участвует совокупность атомов, которые перегруппируются в
частицы продуктов реакции. Взаимное расположение атомов характеризуется 3n-6 координатами: число степеней свободы 3n, но 6 из них характеризуют поступательное и
вращательное движение системы как целого. Систему из атомов А, В и С можно
описать 3- мя параметрами r1 – расстояние АВ, r2 –
расстояние между ВС и угол θ между атомами.
Энергия
системы АВС складывается из Т – кинетической энергии движения атомов, ЕЭ
– энергия электронов и потенциальной энергии электрического взаимодействия
между ядрами UЯ. Таким образом:
![]()
Функция ![]() формально сложно представить как уравнение поверхности
(3n-6) – го порядка в (3n-5) – мерном пространстве с величинами U и qi в
качестве координат. Это так называемая потенциальная поверхность реакции
или поверхность потенциальной энергии (ППЭ).
формально сложно представить как уравнение поверхности
(3n-6) – го порядка в (3n-5) – мерном пространстве с величинами U и qi в
качестве координат. Это так называемая потенциальная поверхность реакции
или поверхность потенциальной энергии (ППЭ).
Поверхность
потенциальной энергии
Состояние
системы на ППЭ можно изобразить перемещением точки. Последовательность
промежуточных состояний через которые проходит система в ходе элементарного
акта, называется путём реакции.
Рассмотрим
реакцию:
![]()
Для данной
реакции ПЭ может быть записана как функция 3-х переменных ![]() , где θ – выражает фиксированный угол сближения
АВ и С. Для упрощения примем θ=const.
Например, θ=180○. Тогда
, где θ – выражает фиксированный угол сближения
АВ и С. Для упрощения примем θ=const.
Например, θ=180○. Тогда ![]() и ППЭ может
быть изображена на плоскости с координатами r1 и r2.
и ППЭ может
быть изображена на плоскости с координатами r1 и r2.
Двухатомная
молекула характеризуется r1= r2, отвечающая равновесному состоянию. Очевидно при ![]() - наблюдается
отталкивание, а при
- наблюдается
отталкивание, а при ![]() - наблюдается
полная диссоциация атомов.
- наблюдается
полная диссоциация атомов.
Очевидно,
при ![]() атом С не
взаимодействует с молекулой АВ:
атом С не
взаимодействует с молекулой АВ:
![]()
Поверхность
потенциальной энергии для рассматриваемой реакции может быть представлена
графически
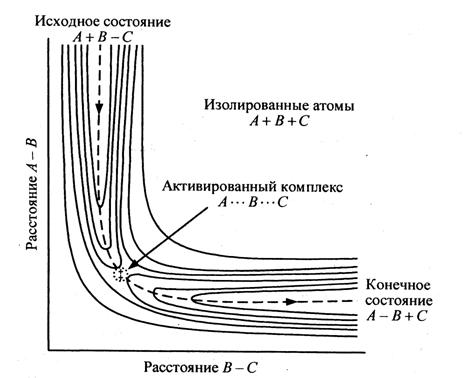
Поверхность
потенциальной энергии для системы из трех атомов А, В и С, представленная в
виде контурных сечений.
Элементарный
акт химического превращения может быть представлен как перемещение точки по
ППЭ. Области с большими значениями r1 и r2 соответствуют полной диссоциации молекул.
Для
изображения пути реакции вводится понятие координаты реакции x. Выбор
координаты реакции произволен. Важно лишь, чтобы она возрастала и потенциальная
система проходила через максимальное значение.
Состояние
системы атомов, которое реальной точке на ППЭ – это состояние активированного
комплекса (переходное состояние).
Высота
потенциального барьера для любого пути, проходящего через переходное состояние
равна потенциальной энергии в переходном состоянии.
Любое
химическое превращение – разрыв старых химических связей и образование новых.
Поэтому активация системы протекает лишь путём сообщения ей энергии
колебательных и вращательных барьеров энергии. Основную роль играют колебательная
энергия.
В силу
квантовомеханических закономерностях
полная энергия системы в исходном состоянии не может быть ниже некоторой
нулевой:
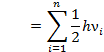
где n – число колебательных степеней свободы в системе
νi – частота колебаний.
В
активированном комплексе энергия колебаний не может быть меньше:
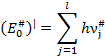
где – l число колебательных степеней свободы в активированном
комплексе:
νi# - частота колебаний в активированном
комплексе.
Если
нулевую энергию активированного комплекса обозначить ![]() , то полная энергия может быть выражена
, то полная энергия может быть выражена
![]()
Химическая
реакция не может произойти, если система атомов в исходном состоянии
обладает энергией ![]() ( если в системе исключается протекание туннельного
эффекта).
( если в системе исключается протекание туннельного
эффекта).
Таким
образом, протекание химической реакции возможно при наличии дополнительной
энергии, т.е. при активации системы. Энергия системы:
![]()
Истинная энергия активации, U равна разности
энергии переходного и основного состояния системы.
Разность истинных энергии активации обратной и прямой
реакции равна тепловому эффекту реакции при абсолютном нуле. Исходя из этого:
![]()
![]()
Где Е* - активационный барьер.