Лекция 32. Фотохимические реакции
Оглавление
Физические
и химические фотопроцессы
Кинетическая
схема Штерна – Фольмера
Одним из
простейших методов инициирования химической реакции ,
протекающей по цепному механизму, является действие света определенной длинны
волны. Этими реакциями легко управлять и фотохимическая
техника удобна для изучения цепных реакций при низких температурах.
Термин фотохимический относится к видимой и УФ-области спектра. Реакции, протекающие за счет ИК-области – это обычные
термические реакции, которые требуют значительного нагревания.
При
освещении среды свет проходит, поглощается, отражается и рассеивается. Первый
закон фотохимии, открыл ещё в начале XIX в., Гротгусол и Дремром (1844) гласит, что только поглощенный свет
может быть эффективным. Из этого закона следует, что не всякий свет приводит к
реакции. Так ацетальдегид, освещенный светом длинной волны
366 нм не приводит к химической реакции. Ацетальдегид поглозает свет только с длинами волн ниже 340 нм.
Поглощаемый
свет оценивается на основе закона Бугера – Ламберта
– Берра. В
соответствии с этим законом интенсивность проходящего света находится по
соотношению:
![]()
Очевидно,
что
![]()
или
![]()
где k и
ε
– молярные коэффициенты поглощения.
С – концентрация поглощающих частиц
l – длина пути потока
Если
пренебречь рассеиванием и отражением, то поглощенный свет ![]() можно найти по
разности интенсивности падающего света и проходящего:
можно найти по
разности интенсивности падающего света и проходящего:
![]()
Таким
образом, приданной длине волны количество световой энергии, поглощенное
системой будет зависеть от С, l и k или ε.
Согласно
квантовой механике, энергия излучения квантована, т.е. её можно рассматривать
как совокупность дискретных порций энергии (квантов). Энергия кванта это
уравнение Планка:
![]()
Если
рассмотреть один моль квантов, то
![]()
Очевидно,
что поглощение энергии с длиной волны, совпадает с энергией разрешенных
переходов для возбуждения молекул. В связи сэтим
поглощается не весь свет, а только доля его.
Второй
закон фотохимии – закон фотохимической эквивалентности гласит: « Каждая
молекула участвует в фотохимической реакции, поглощая один квант света». Этот
закон был сформулирован Штарком и Эйнштейном. Он дает возможность судить о
механизм процесса. Из этого следует, что система, содержащая
1 моль частиц не может поглощать более 1 Эйнштейна энергии:
![]()
Если
каждая частица перейдет в продукт, то будем наблюдать 100% выход. В общем же
случае квантовый выход:
![]()
Где N – число
молей продукта образовавшегося при облучении ![]() молей реагента
молей реагента
![]() - число молекул
- число молекул
Очевидно,
что ![]() указывает на
цепной механизм процесса, что не противоречит закону Штарка-Эйнштейна. Он
справедлив только для стадии возбуждения.
указывает на
цепной механизм процесса, что не противоречит закону Штарка-Эйнштейна. Он
справедлив только для стадии возбуждения.
Пример
При
фотолизе ацетона светом с λ=313 нм в течении23000 с при56○ С распалось 5,23·1019 молекул.
Рассчитать квантовый выход, если за 1 сек. Поглощалось 8,52·10-3 Дж.
Решение:
Энергия
кванта
![]()
Число
квантов, поглощенных за 1 сек.
![]()
За все
время освещения поглощено:
![]()
Следовательно квантовый
выход:
![]()
Из I и II законов
фотохимии можно сформулировать закон Вант – Гоффа: количество,
вступившего в фотохимическую реацию,
вещества пропорционально поглощенной энергии. Следовательно, для скорости инициирования фотохимической реакции можно записать:
![]()
1)
При ![]() , т.е. l – мало
, т.е. l – мало
![]()
2)
При ![]() , т.е. l – велико
, т.е. l – велико
![]()
Физические и химические фотопроцессы
При
поглощении света энергия электромагнитных колебаний трансформируется в энергию
движения электронов, которые переходят на более высокие энергетические уровни.
Эта стадия заканчивается за ![]() с.
с.
Электоронно
–возбужденные молекулы претерпевают превращение по
одному из первичных процессов
Процессы ![]() - химимческие,
- химимческие, ![]() - физические.
- физические.
По
направлению 1 могут протекать:
А)
диссоциация на атомы и радикалы,
Б) фотоионозация:
![]()
В) распад
на молекулы и атомы
![]()
По
направлению (2) протекают изомеризации многоатомных молекул. Реакции по
направлению (3) могут протекать как с градиентом третьей частицы, так и внутримолекулярно.
Рассмотрим
фотохимические процессы. Электронное состояние молекулы характеризуется мультиплетностью
2S+1, где S – суммарный
спин. Если молекулы не содержат электронов, то она находится синглетном состоянии S0 с
мультиплетностью = 1. При нахождении света она переходит в возбужденное
состояние. Время жизни возбужденного синглета ![]() . Возможны переходы, когда спин электрона становится
параллельно, то мультиплетность увеличивается до 3-х. Время жизни триплета
всегда больше, чем сингета и равен
. Возможны переходы, когда спин электрона становится
параллельно, то мультиплетность увеличивается до 3-х. Время жизни триплета
всегда больше, чем сингета и равен
![]() .
.
Возбужденная
молекула может снять энергию различными путями: либо излучая эту энергию, либо
передавая её.
Во втором
случае возможны следующие процессы:
1)Колебательная релаксация
2)Внутренняя
конверсия - Энергия теряется за счет перехода на более низкий уровень.
3) Интеркомбинационный переход – переход из состояния с одной
мультиплетностью в состояние с другой мультиплетностью.
Если
процесс протекает по направлению (4), то наблюдается излучение. Это либо флуоресценция,
либо фосфоресценция.
Флуоресценция – это излучение при переходе с низшего возбужденного синглетного состояния в исходное.
При этом испускаемая частота близка к поглощаемой.
Фосфоресценция – излучение при переходе из электронно
– возбужденного состояния триплета на низшем уровне в основное синглетное состояние. Триплетное состояние является
метастабильным, поэтому фосфоресценция длится от 10-3 до 10 с.
Фотохимический
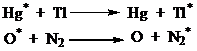
процесс может протекать за счет фотосенсибилизации,
т.е. нечувствительная к излучению молекула может возбуждаться за счет молекулы
поглотившей квант света:
Hg + hν = Hg* E=4.9 эВ
H2 + Hg* → 2H + Hg ![]()
Кинетическая схема Штерна – Фольмера
При
изучении кинетики фотохимических процессов используется упрощенная схема Штерна-Фольмера:
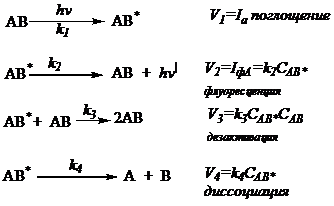
Находим ![]() методом
стационарных концентраций:
методом
стационарных концентраций:
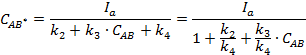
Очевидно первичный
квантовый выход, может быть рассчитан:
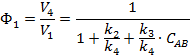
Таким
образом, для фотохимических реакций применяем обычный прием получения
кинетических уравнений.