Лекция 39. Двойной электрический слой и методы его изучения.
На границе раздела
электрод-раствор происходит переход электрона из металла на границу в растворе
и обратный процесс – переход электрона с границы на электрод. Знание строения
границы между электродом и раствором имеет большое значение при изучении кинетики
и механизма электрохимической реакции. Различают два основных явления, связанных
с образованием границы раздела фаз. Первое явление – адсорбция, оно состоит в
том, что вследствие разности Е границ на поверхности в объеме их равновесная
концентрация изменяется по мере приближения к поверхности. Если концентрация
увеличивается, то «+» адсорбция, а если уменьшается, то «-» адсорбция. Для
количественного описания адсорбции на границе раздела фаз используют
адсорбционное уравнение Гиббса: dσ = ΣГidμi.
σ – обратимая поверхностная работа, которую необходимо затратить в
равновесных условиях для увеличения поверхности на единицу площади или
поверхностного натяжения, σ = [Дж/м2]. Гi –
поверхностный избыток i–го компонента в моль/м2. μi
– химический потенциал.
Следует различать
понятие адсорбции Гi, как поверхностного избытка, и
поверхностную концентрацию Аi моль/м2, как
количество компонента i, непосредственно связанного с единицей поверхности.
Поверхностная концентрация Аi всегда больше нуля, а
поверхностный избыток имеет значения ±. Чтобы из опытного значения
поверхностного избытка рассчитать поверхностную концентрацию необходимо выбрать
модель, описывающую распределение концентрации компонентов в зависимости от
расстояния до электрода. Обычно предполагается, что распределение ионов
подчиняется формуле Больцмана:
Ci = Ci0 exp (ZiFφx ⁄RT);
Ci – концентрация ионов в объеме,
Zi –
заряд i иона.
φx – потенциал на расстоянии x от поверхности электрода.
Для большинства
органических веществ принимается ступенчатое изменение концентрации вблизи
поверхности электрода. В этом случае весь поверхностный избыток локализован в
пределах мономолекул слоя толщиной d. Горг ≈ Аорг
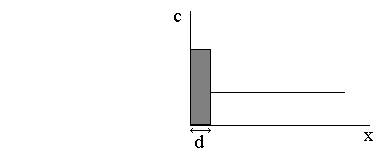
Таким образом адсорбция
характеризует изменение состава поверхностного слоя по сравнению с некоторой
идеальной системой, в которой концентрация всех компонентов остается неизменной
вплоть до самой границы раздела фаз. К свойствам такой идеальной системы приближается
граница раздела электрод-раствор при заряде q = 0 называется потенциалом
нулевого заряда. Явление адсорбции тесно связано со вторым явлением – пространственным
разделением зарядов и гальванопотенциалом, обусловленным этим разделением.
Распределение концентраций ионов NaF в зависимости от расстояния до поверхности
электрода при заряде поверхности q<0 можно представить:
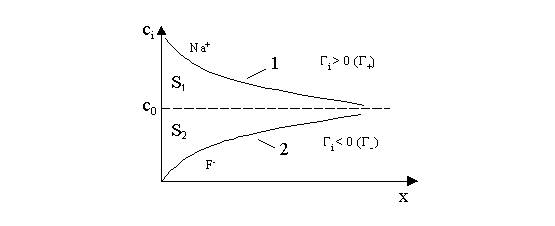
По условию
электронейтральности при заряде равном 0
F · Г+
= F · Г-.
При сдвиге потенциала в область « – » зарядов величина q = - F · Г+
+ F · Г-.
Здесь q – заряд на единицу
поверхности. Таким образом, на границе электрод–раствор в результате
электростатической адсорбции ионов возникает своеобразный микроконденсатор,
создающий разность потенциалов Δφ ≈ φ0, т.е.
изменение гальванического потенциала.
Скачок потенциалов
Δφ в дв. эл. слое может образоваться не только в результате специфической
адсорбции ионов при q = 0, а также при ориентированной адсорбции орг. веществ
φ0 > 0, если «+»
концы диполей направлены параллельно электроду и φ < 0, если наоборот.
Таким образом, образование дв. эл. слоя всегда тесно связано с адсорбцией на
границе электрод–раствор ионов и полярных молекул. Модель дв. эл. слоя строится
на основе данных по адсорбции, потенциалов φ0, зарядов
поверхности q. Основные модельные представления о строении дв. эл. слоя
сводятся:
1.
Первая модель дв. эл. слоя – модель плоского
конденсатора Гельмгольца. Конденсатор характеризовался емкостью: c = q/φ,
дифференциальная емкость: cд = dq/dφ
2.
Теория диффузионного слоя Гуи была в 1910 г., а в
1913 г. она была дополнена Чакменом, получила название модели Гуи – Чакмена.
Математически теория Гуи – Чакмена построена так же, как и возникшая позже
Дебая – Гюккеля. В этой модели ионы рассеиваются как математические точки,
находящиеся тепловом движении и одновременно в электрическом поле, действующим
перпендикулярно поверхности электрода. Это обстоятельство позволило получить
точное решение уравнения Пуассона – Больцмана: 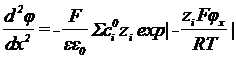 . φ(х) (φх) – потенциал слоя на
расстоянии х от поверхности металла.
. φ(х) (φх) – потенциал слоя на
расстоянии х от поверхности металла.
3.
1924г. Штерн учел собственные размеры ионов и
создал теорию аналогичную II приближению Дебая – Гюккеля. Одновременно в теории
Штерна были учтены силы неэлектрического статического взаимодействия ионов с Ме
для учета специфической адсорбции ионов. Согласно современным теоретическим
представлениям о дв. эл. слое предполагается, что дв. эл. слой состоит из двух
частей: плотного и диффузного, которые разделены плоскостью х = х2,
называемой внешней плоскостью Гельмгольца. Толщина плотного слоя равна радиусу
гидратированных ионов и составляет примерно
3- 4 А0, а ε1 в плотном слое много меньше
ε в растворе.
Граница раздела
электрод-раствор:
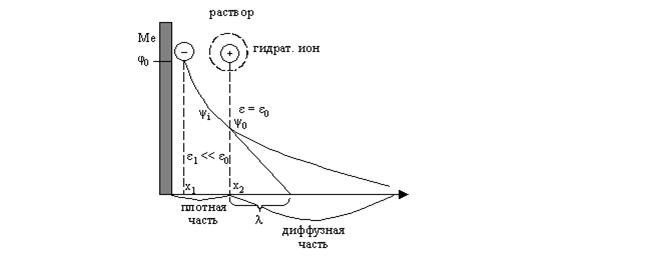
ε0 –
диэлектрическая проницаемость
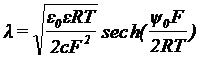
φ0 –
потенциал внешней плоскости Гельмгольца
При отсутствии
специфической адсорбции ионов падение потенциала в плотном слое линейное, в
диффузном слое напряженность много меньше, поэтому диэлектрическая проницаемость
почти как в обычном растворе. Толщина диффузионного слоя теоретически бесконечна,
но практически вводят некоторую эффективную толщину, аналогично эффективному
радиусу ионной атмосферы.
Плоскость, на которую
локализуются эл. центры специфически адсорбированных ионов, называется
внутренней плоскостью Гельмгольца на расстоянии х = х1. Заряд
специфически адсорбированных ионов q1 связан с их поверхностной
концентрацией Аi соотношением: ![]()
Из условия
электронейтральности общий заряд:
q = - (q1 + q2) , q2 –
заряд диффузного слоя, тогда
q2 = - q - q1
Теория диффузного слоя
позволяет связать величину q2 с
потенциалом внешней плоскости Гельмгольца с концентрацией ионов.
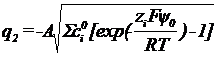 ;
; ![]()
Для 1-1 вал.: ![]() ;
;
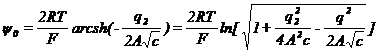
При отсутствии
специфической адсорбции для емкости дв. эл. слоя «с» по теории Гуи – Чакмена
определяется соотношением: ![]() .
.
![]() - емкость плотного
слоя.
- емкость плотного
слоя.
![]() - емкость диффузного
слоя.
- емкость диффузного
слоя.
![]()