ЛЕКЦИЯ
4
Объединенное уравнение первого и второго начала термодинамики для физических и химических процессов
План лекции:
1.
Фундаментальное уравнение термодинамики в дифференциальной
форме.
2.
Зависимость термодинамических потенциалов от
количества вещества. Понятие химического потенциала.
3.
Энергия Гиббса и энергия Гельмгольца – критерии самопроизвольного
протекания процессов.
4.
Применение энергии Гиббса к изучению равновесий в
физико–химической системе.
Объединенное уравнение первого
и второго начала термодинамики, для равновесного обратимого процесса может быть
выражено:
TdS = dU + pdV (4 – 1)
Отсюда следует, что
dU = TdS – pdV (4 –
1)
Введя новые функции состояния
U ≡U + pV, G ≡H – TS, F ≡U - TS
можно получить четыре
эквивалентные формы записи:
![]() dU = TdS – pdV
dU = TdS – pdV
dH = TdS + Vdp
dF
= - pdV – SdT (4 - 2)
dG = Vdp – SdT
Все
выражения (4 – 2) справедливы лишь для закрытых систем, в которых не совершаются
другие виды работ за исключением механической работы. В этом случае, как уже
отмечалось
U = U (S, V) H = H (S, P) G = G (P, T) F = (V, T) являются термодинамическими потенциалами и
определяют направления самопроизвольного протекания процесса. Но, совершенно
очевидно, что эти процессы связаны либо с выделением энергии в форме теплоты,
либо с совершением механической работы. Никакие другие процессы здесь не рассматриваются.
Если в системе протекает химическая реакция,
она становится аналогом открытой системы, поэтому возникает необходимость
учитывать обмен энергией и массой с окружающей средой. Поэтому
термодинамические потенциалы будут функцией всех веществ участвующих в реакции
и систему уравнений (4 – 2) следует записать:
![]()
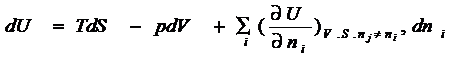
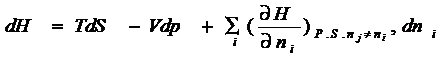
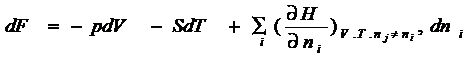

Все
производные по количеству вещества равны между собой и характеризуют приращение
соответствующего термодинамического потенциала при измерении данного вещества при
фиксированных естественных переменных и неизменных количествах остальных
веществ: (4 - 4)
µi = (![]() )S,V, nj≠i = (
)S,V, nj≠i = (![]() ) S,P,nj≠i = (
) S,P,nj≠i = (![]() ) V,T,nj≠i = (
) V,T,nj≠i = (![]() )P,T,nj≠i
)P,T,nj≠i
Эта
новая функция, введенная Гиббсом, получила название химического потенциала. Химический
потенциал фактически является движущей силой при массопереносе. Система
самопроизвольно переходит в состояние с более низшим потенциалом. Более нагретое
тело, с большей температурой, нагревает менее нагретое тело, с меньшей температурой,
т.е. температура – потенциал при теплопередачи, т.е. температура выступает
здесь движущей силой. Работа расширения
совершается аналогично за счет уменьшения давления: давление потенциал в случае
механической работы. Все потенциалы, как известно интенсивные переменные,
т.е. не зависящие от массы. Любой самопроизвольный процесс – это процесс
приводящий к выравниванию потенциалы в результате чего достигается равновесие.
Очевидно, что если в системе совершаются другие виды работ,
связанные с переносом массы, то учет ∑μidni не достаточен.
Уравнения (4 -3) справедливы
лишь в том случае, если химическая реакция протекает в гомогенной системе и
системе не совершает других видов работ, кроме механической. Очевидно в этом
случае:
![]() dU =
dU = ![]() μidni (S,V =
const)
μidni (S,V =
const)
dH = ![]() μidni (S, p = const)
μidni (S, p = const)
dG = ![]() μidni (T, p
= const)
μidni (T, p
= const)
dF = ![]() μidni (T,V =
const)
μidni (T,V =
const)
Для
гетерогенной системы эти уравнения должны быть записаны для каждой фазы в
отдельности. При этом, равновесие в
гетерогенной системе наступает лишь тогда, когда химические потенциалы всех
компонентов во всех фазах выравниваются.
Среди
рассмотренных термодинамических потенциалов в конкретных термодинамических
расчетах наибольшее значение имеют энергия Гельмгольца F и энергия Гиббса G. Их естественные переменные наиболее удобны,
поскольку легко реализуемы. Изменение этих функций в каком – либо процессе при
постоянстве естественных переменных равно максимальной работе, которая система
может совершить в этом процессе при проведении процесса обратимо. Изменение
этих термодинамических потенциалов можно найти из термодинамических констант,
поэтому они позволяют определить возможность самопроизвольного процесса и
глубину его протекания:
∆GT
= ∆HT - T∆ST (4 – 6)
∆FT = ∆HT - T∆ST (4
– 7)
Если
условия протекания процесса не сильно отличаются от стандартных, то в расчете
можно использовать термические константы, отнесенные к стандартным условиям. В
этом случае расчет ∆rG°T может быть осуществлен:
∆rG°T = ∆rH°T
где ∆rHº T и ∆rSº T рассчитываются на основе стандартных
энтальпий образования и абсолютных энтропий с пересчетом к температуре T.
Изменения
энергии Гиббса может быть рассчитано аналогично тепловому эффекту реакции с
использованием энергий Гиббса образования:
∆rG° T = ∑υi∆fG° T - ∑υj∆ fG° T (4
– 8)
i j
продукты реагенты
Фазовые равновесия I рода
Рассмотрим
равновесия типа:
![]()
![]() Жидкость Пар
Жидкость Пар
![]()
![]() Твердое тело Пар
Твердое тело Пар
![]()
![]() Твердое тело Жидкость
Твердое тело Жидкость
Равновесие, как известно, характеризуется равенством
энергий Гиббса для индивидуального вещества.
Исходя из (4 – 2) для жидкой и паровой фаз мы можем
записать:
![]() dGж = Vжdр – SжdT
dGж = Vжdр – SжdT
dGпар = Vпарdр - SпарdT (4
– 9)
Если энергии Гиббса отнесены к 1 молю, то условие
равновесия может быть записано:
Gпар= Gж
Отсюда
следует, что
dGпар = dGж
Из системы (4 – 9) получаем:
Vжdp – SжdT = Vпdp – Sпdt
Отсюда
следует, что
![]() (4
– 10)
(4
– 10)
Уравнение (4 – 10) – это уравнение Клаузиуса – Клайперона,
которое показывает, как изменяется давление с ростом температуры при изменении
агрегатного состояния вещества.
Уравнение (4 – 10) применимо к любому фазовому
переходу I рода. Оно может быть
преобразовано с учетом того, что
∆Gф.п. = ∆Hф.п. - Т∆Sф.п. = 0
Для процессов испарений и сублимации Vтв/ж ›› Vп. Считая, что
пар подчиняется закону идеальных газов: Vп = RT/P. Уравнение (4 – 10) можно преобразовать:
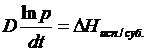 (4 - 10′)
(4 - 10′)
Уравнения (4 – 10) и (4 – 10′ ) позволяют определить
энтальпию фазового перехода по температурной зависимости давления паров. В
случае плавления требуются дополнительные сведения о больших объемах жидкой и
твердой фаз.
Рассмотрим несколько примеров
таких расчетов.
Пример 4 - 1
Приняв энтальпию плавления льда
при 273,15 К равный 333,5 Дж∙2ˉ¹, а удельные объемы жидкой воды
и льда равными 1,0002 см³∙2ˉ¹ и 1,0908 см³∙2ˉ¹
соответственно, рассчитать на сколько нужно повысить давление, чтобы температура
плавления льда уменьшилась на 1 К.
Решение:
Из уравнения (4 – 10) следует ![]()
![]()
![]()
Знак «-» указывает, что
температура плавления льда уменьшается с ростом давления.
Пример 4 - 2
При
давлении 1 атм. Бензол кипит при 80,1º С. Какое давление паров бензола при
стандартной термодинамической температуре?
Решение
На
основании уравнения (4 - 10′) получаем
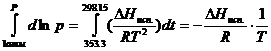 │
│![]()
В
условии задачи отсутствует ∆Нисп. Её можно найти через энтальпии образования,
предположив, что энтальпия испарения слабо зависит от температуры.
![]() = 82,98 кДж∙мольˉ¹
= 82,98 кДж∙мольˉ¹
![]() = 49,07 кДж∙мольˉ¹
= 49,07 кДж∙мольˉ¹
Следовательно,
∆барНº(298, С6Н6) = 33,91 кДж∙мольˉ¹
![]()
![]()
Возможна
и другая оценка энтальпии испарения. Для неполярных жидкостей выполняется
правило Трутона, согласно которому мольная энтальпия испарения в точке НТК
(нормальной температуры кипения) примерно равна 88 Дж∙мольˉ¹ Кˉ¹.
Оценивая
для бензола ∆Нисп., получаем ∆Нисп. = 88∙353,3 = 31100 Дж∙мольˉ¹. В
этом случае получаем р=0,141 атм.
Пример
4 – 2′
Какое
давление паров бензола при стандартной термодинамической температуре, если
стандартные энергии Гиббса образования жидкого и газообразного бензола равны
+124,43 кДж∙мольˉ¹ и +129,75 кДж∙мольˉ¹
соответственно.
Решение:
Если
Т = const = 298,15 то
![]()
Принимая
∆V = Vпар = получаем, после интегрирования
![]()
![]()
![]()
P= 0,117 атм.
Пример
4 - 3
При
каком давлении алмаз и графит находятся в равновесии друг с другом при температуре
298,15 К, если плотность графита и алмаза 2,25 и 3,51 г∙смˉ³
соответственно, а ![]() = 2,900 кДж∙мольˉ¹
= 2,900 кДж∙мольˉ¹
Решение:
![]() Сграфит
Салмаз
Сграфит
Салмаз
![]()
∆fG≡0
∆fG=2,900 кДж∙мольˉ¹
Поскольку
![]() , то
, то 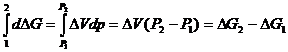
По
условию равновесие соответствует ∆G2 = 0, следовательно
P2 – P1 = ∆G2 -
![]()
∆G1= - ∆fGº.
Если принять, что стандартные условия отнесены к Р1 = 1 атм. = 101325,1 Па,
то
![]() =
=![]()
Пример 4 – 4
При
70ºС давление насыщенных паров CCl4 621,15 мм рт. ст, а при 80ºС 843,29 мм рт. ст. Чему
равна энтальпия испарения ССl.
Решение
Из
уравнения Клаузиуса – Клайперона
![]() , получаем
, получаем
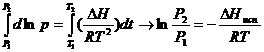 │=
│=![]() │=
│=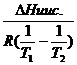
![]()
![]()