Лекция 42. Коррозия и защита металлов.
Электрохимические методы
составляют основу прикладной электрохимии и широко применяются в различных
областях современного производства.
Часто в технике при
контакте металла с растворами электролитов наблюдаются коррозионные явления.
Коррозия – процесс
самопроизвольного разрушения металлов при их контакте с окружающей средой.
Атмосферная коррозия
протекает в тонких пленках электролита, которые возникают на поверхности
металлов в результате адсорбции, конденсации или прямого попадания воды и
растворенных в ней коррозионно-активных газов и солей. Процесс оказывается
типичным электрохимическим процессом. Основу электрохимической коррозии удобно
рассматривать на конкретном примере растворения Zn в
кислоте. Пусть в начале Zn электрод находится в водном растворе Zn|ZnCl2 и
приобрел равновесный потенциал Еp = -0,76 В.
При отклонении
потенциала в катодную сторону от Еp > Е на его поверхности выделяется
Zn. При
отклонении в анодную сторону происходит анодное растворение Zn (Еp
< Е). При Еp = Е ток прямого процесса равен току обратного
процесса и равен току обмена.
![]()
«1» относится к Zn как
первому металлу.
Поляризующая кривая
выделения и ионизации Zn, кривая выделения и ионизации молекулы Н2
на Zn из
раствора ZnCl2 + НCl имеет вид:
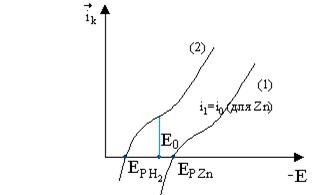
Так как равновесный
потенциал Zn более отрицателен, чем обратимый водородный потенциал,
то при добавлении кислоты к раствору ZnCl2 на
поверхности Zn происходит разряд иона водорода. Процесс связан с
отрывом электронов от металла и смещением потенциала Zn в
анодную сторону. При этом скорость выделения Н2 снижается, а
скорость растворения Zn растет. Устанавливается стационарное состояние,
при котором ![]() . При этом электрод приобретает некоторый промежуточный
потенциал ЕS, называемый стационарным потенциалом, а скорость
растворения металла при ЕS называется скоростью
саморастворения.
. При этом электрод приобретает некоторый промежуточный
потенциал ЕS, называемый стационарным потенциалом, а скорость
растворения металла при ЕS называется скоростью
саморастворения.
Таким образом, процесс
растворения Zn в HCl на самом деле является результатом одновременного
протекания сопряженных электрохимических реакций:
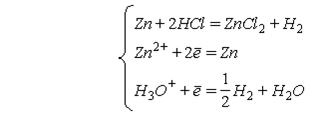
В отсутствии
диффузионных ограничений скорость растворения Zn:
![]()
скорость выделения
водорода:
![]()
При
стационарном потенциале: ![]() или
или ![]()
![]() - при любом числе
сопряженных реакций.
- при любом числе
сопряженных реакций.
Сумма скоростей всех
катодных процессов при стационарном потенциале равна сумме скоростей всех
анодных процессов.
Между стационарным и
равновесным потенциалами существуют различия:
1)
равновесный потенциал отвечает равенству скоростей
окисления и восстановления одного и того же вещества, а стационарный потенциал
отвечает равенству суммарных скоростей катодных и анодных растворов для
нескольких систем;
2)
при равновесном потенциале состав фаз постоянен,
при стационарном он постепенно меняется. Так как скорости процессов зависят от
концентраций компонентов, то в принципе стационарный потенциал может меняться
во времени, хотя очень медленно;
3)
равновесный потенциал не зависит от состояния
поверхности электрода, а стационарный потенциал зависит от всех факторов,
которые влияют на скорость электродных процессов, поэтому стационарные
потенциалы часто плохо воспроизводятся.
Для определения тока
саморастворения поляризационные характеристики удобно представлять в
полулогарифмических координатах. Координаты точки пересечения поляризационных
кривых соответствующих скоростям –i1 и i2
отвечают lgiS
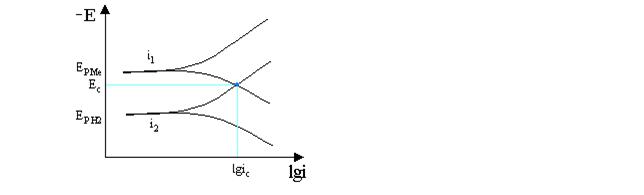
Графическое
представление поляризационных кривых широко применяют при анализе различных
видов коррозии. Защиту от коррозии или снижение скорости коррозионных процессов
осуществляют различными методами:
1)
повышение чистоты индивидуального металла;
2)
катодная поляризация металла (катодная и
протекторная защита);
3)
ингибиторы коррозии, снижающие скорости анодного,
катодного или обоих процессов;
4)
явление пассивности (анодная защита).