Лекция № 5
Гетерогенные фазовые равновесия.
Физико-химический анализ.
План лекции
1. Понятие гетерогенного равновесия. Понятие компонент, фаза, число степеней свободы.
2. Правило фаз Гиббса. Вывод правила фаз.
3. Сущность и значение физико-химического анализа для изучения гетерогенного равновесия.
4. Гетерогенное равновесие в адиокомпонентной системе. Диаграммы плавкости.
При кипении жидкости при постоянном давлении, при плавлении кристаллов, при выделении кристаллов из насыщенных растворов устанавливается гетерогенное равновесие. Термодинамическое условие равновесия в гетерогенных системах – сколь угодно длительное существование фаз в условиях р и Т = const: концентрация в каждой фазе при этом не изменяется:
∑ μidni = 0 (5-1)
Изменение внешних параметров приводят к нарушению равновесия и к изменению концентраций и фаз. Предсказать возможность изменения фаз позволяет закон равновесия фаз, выведенный Гиббсом термодинамическим путем в 1876г:
В равновесной многофазной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз, если на систему из внешних термодинамических параметров влияют только давление и температура:
С = К – Ф + 2
где С – число степеней свободы; К – число компонентов; Ф – число фаз.
Компонентами называются химические однородные вещества, которые являются независимыми составными частями системы. При выборе компонентов выбираются те вещества, наименьшее число которых достаточно для образования всей системы, так и любой ее части.
При определении минимального числа компонентов, таким образом, необходимо знать число связей, т.е. число уравнений, которые определяют соотношения компонентов в условиях термодинамического равновесия.
например, система, состоящая из СаО, СаСО3 и СО2 может быть описана двумя компонентами, т.к. концентрация СО2 при данной температуре однозначно определяется через константу равновесия обратимого процесса:
![]()
![]() СаСО3 (тв.) СаО (тв.)
+ СО2
(г.)
СаСО3 (тв.) СаО (тв.)
+ СО2
(г.)
Гомогенная система:
![]()
![]() Н2
(г.) + У2 (г.) 2 НУ (г.)
Н2
(г.) + У2 (г.) 2 НУ (г.)
может быть задана количеством НУ (г.), т.е. число независимых
компонентов для данной системы может быть определено равным 1.
Гомогенная часть гетерогенной системы
определяется как фаза. Для фазы должны быть одинаковые термодинамические и
физические свойства. Этим фаза отличается от агрегатного состояния. В одном и
том же агрегатном состоянии могут быть вещества, составляющие несколько
независимых фаз.
Вариантностью системы, или числом
степеней свободы называется число тех параметров состояния системы,
величину которых можно менять без применения числа фаз.
Вывод правила фаз.
Правило фаз выводится их известного
алгебраического условия: в системе уравнений число независимых переменных равно
разности между общим числом переменных и числом связывающих эти переменные
уравнений.
Если в гетерогенной системе к - коэффициентов и Ф – фаз находятся в устойчивом
термодинамическом равновесии. Состояния каждой фазы определяются внешними параметрами, которые задаются и
меняются - это, как правило, р и Т, и составом.
Состав каждой фазы определяется не всеми К компонентами,
а только К – 1, т.к. ![]() = 1 и достаточно знать концентрации n-1 компонента, а концентрация п-го компонента
определяется из уравнения связи. Следовательно, в Ф фазах Ф (К - 1) - независимых концентраций, а с учетом р = соnst и Т
= соnst число
независимых переменных ставит Ф(К - 1) + 2.
= 1 и достаточно знать концентрации n-1 компонента, а концентрация п-го компонента
определяется из уравнения связи. Следовательно, в Ф фазах Ф (К - 1) - независимых концентраций, а с учетом р = соnst и Т
= соnst число
независимых переменных ставит Ф(К - 1) + 2.
Число связывающих эти компоненты
уравнений определяются на основе уравнения (5-1). В равновесии наблюдается
равенство химических потенциалов всех компонентов во всех фазах.
![]() μ
μ![]() = μ
= μ![]() = μ
= μ![]() …= μ
…= μ![]()
μ![]() = μ
= μ![]() = μ
= μ![]() =… μ
=… μ![]()
μ![]() = μ
= μ![]() = μ
= μ![]() … μ
… μ![]()
Очевидно, что для каждого компонента
(Ф-1) – уравнение, а всего для всех компонентов во всех фазах К(Ф-1) – уравнение
связи.
Отсюда, число степеней свободы:
С
= Ф(К-1) + 2 – К(Ф-1) = К – Ф + 2
Установить наличие полиморфных превращений в однокомпонентной системе, природу фаз и область их существования в зависимости от температуры и давления, а также проанализировать взаимодействие в многокомпонентной системе можно двумя путями: препаративным или проводя физико-химический анализ и построив диаграммы «состав-свойство».
Препаративный метод требует подбора условий синтеза и используется в случае одновременно протекающих нескольких реакций, когда равновесие не достигается.
Однако, состав конкурентных соединений, бывает сложно определить, поскольку не всегда удается выделить чистые вещества. В этом случае получают физико-химический анализ.
Физико-химический
анализ заключается в изучении взаимодействия веществ в многокомпонентных
системах без выделения образующихся продуктов. В физико-химическом анализе исследуется функциональная зависимость
между численными значениями физических свойств равновесной химической системы и
концентрациями компонентов, определяющими состояние равновесия.
На основании результатов измерения строятся химические диаграммы в координатах «состав свойство».
Геометрические особенности этих диаграмм позволяют судить как о природе продуктов, так и числе этих продуктов, границах их устойчивости, условиях совестного существования различных фаз в системе.
Анализ гетерогенных равновесий проводится по диаграмме на основе правила фаз Гиббса и принципов непрерывности и соответствия, сформулированных А.С. Кураковым.
Принцип непрерывности. Если непрерывно изменяются давления, температуры, концентрации, то свойства отдельных фаз системы изменяются также непрерывно. Пока не изменится число и характер фаз, непрерывно изменяются свойства всей системы.
Принцип соответствия. Совокупности находящейся в равновесии фаз на диаграмме соответствует определенный образ.
Термический
анализ.
Наиболее распространен среди методов физико-химического анализа – термический анализ. Термический анализ состоит в изучении систем по кривым нагревания или охлаждения в координатах «температура-время». Изломы и кипейные участки на этих кривых позволяют построить диаграммы в координатах «температура - состав» для многокомпонентной системы или «температура - давление» для однокомпонентной. Исследование однокомпонентных систем этим методом позволяет определить температуры полиморфных превращений, плавления, кипения и тепловые эффекты этих процессов. В сложных системах можно установить наличие или отсутствие взаимодействия компонентов, составы фаз и другую информацию.
Однокомпонентные системы: Р-Т проекции
В координатах Р-Т однокомпонентные системы имеют вид:
![]()
![]()

![]()
жидкость
![]() твердое жидкость
твердое
твердое жидкость
твердое
![]()
![]()
пар пар
![]()
![]()
рис. 5-1 рис. 5-2
Если удельный объем жидкости фазы, образующийся при плавлении больше удельного объема твердой фазы, то диаграмма соответствует рис. 1. Если имеется обратная зависимость, то диаграмма соответствует рис. 2. Линии, разделяющие поля, отвечают сосуществованию двух фаз и описываются уравнением Клапейрона - Клаузиуса. Они многовариантны, т. к. произвольно на этих линиях можно изменить только давление или температуру, изменение второго параметра определяется уравнением.
Точка пересечения трех линий – тройная точка, ноивариантна. Она соответствует сосуществованию в равновесии всех трех фаз.
В зависимости от состояния фаз, диаграммы для двухкомпонентных систем можно классифицировать следующим образом.
![]()
![]() Т
Т
 кривая ликвидуса
кривая ликвидуса
![]() кривая солидуса
кривая солидуса
рис. 5-3
![]() А состав В
А состав В
I тип (рис. 5-3): диаграмма отвечает случаю полной взаимной растворимости компонентов А и В как в расплаве так и в твердой фазе.
![]()
![]() Т Т
Т Т
![]() кривая ликвидуса
кривая ликвидуса

жидкое +
![]() кристаллы жидкое
+
кривая солидуса
кристаллы жидкое
+
кривая солидуса
кристаллы
![]()
![]() А В
А В
кристаллы А
+ кристаллы В
эвтектика + эвтектика
![]() А В
А В
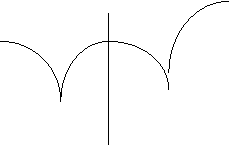
II тип (рис. 5-4): диаграмма с простой эвтектикой. А и В не расслаиваются в жидкой фазе, но в твердом состоянии представляют собой гетерогенную двухфазную систему.
![]()
![]()



![]()
![]() Т Т
кривые ликвидуса
Т Т
кривые ликвидуса
ж. + ж.
кр. тв.р. + кр.
α α тв. р. β
![]()
![]()
![]() β
β
![]()
![]()
 кривые солидуса
кривые солидуса
тв. р-р α + тв. р-р β
эвтектика + этектика рис. 5-5
![]() А состав В
А состав В
III тип (рис. 5-5): диаграмма с неограниченной растворимостью в жидкой фазе при частичной растворимости в твердой фазе.
![]()
![]() Т Т
Т Т
жид. + жидк. +
жидк. + жидк. + хим. соед. кр. В
![]()
![]() кр. А хим. соед.
кр. А хим. соед.

А + Э1 х.с. + Э1 хим. соед. В т.
+ Э2
+ Э2
рис. 5-6
![]()
![]()
![]() А состав В
А состав В
эвтектика 1 эвтектика 2
IV тип (рис. 5-6): диаграмма, отвечающая образованию химического соединения, плавящегося без разложения (т.е. конгруэнтно).
![]()
![]()
 Т Т
Т Т
 жидкость
жидкость
+ кристаллы
А

![]()
![]() жидк. +
жидк. +
жидк. + кр. А
![]() Акр. + хим. соед. хим.
сед.
Акр. + хим. соед. хим.
сед.
![]() хим. соед. + Вкр. +
хим. соед. + Вкр. +
эвтектика эвтектика
рис. 5-6
![]() А
В
А
В
V тип (рис 5-7): диаграмма со скрытым максимумом, который отвечает химическому соединению, которое разлагается при плавлении (т.е. плавится инконгруэнтно).