Особенности
строения кристаллических веществ. Основы зонной теории строения кристаллов.
Кристаллические решетки
металлов
Для металлов характерна кристаллическая структура с плотнейшей упаковкой атомов, при этом большинство металлов
кристаллизуются в следующие типы кристаллических решеток.
ОЦК: Na, K, Rb, Cs, Cr,
Mo, W (к.ч. = 8).
ГЦК: Ag, Au,
Cu, Li, Al,
Ni, Pt, Pd
(к.ч. = 12).
ГПУ: Zn, Cd, Be, Mg, Ru, Os (к.ч. = 12).
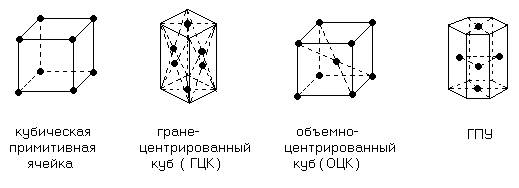
Координационное число – число равноудаленных друг от друга атомов в
кристаллической решетке.
При различных температурах кристаллические решетки
могут взаимопревращаться друг в друга - протекают полиморфные
превращения.
Кристаллические решетки технических металлов не
являются идеальными, так как при выплавке и разливе расплавов металлов в изложницы
возникает большое число центров кристаллизации и при образовании твердых
металлов из расплавов возникает большое число мелких кристаллов – кристаллитов.
Таким образом, особенности строения металлов
следующие:
1)
плотная упаковка
атомов; что приводит к высокой прочности и твердости металлов;
2)
способность к
перемещению атомных слоев относительно друг друга; что позволяет придавать
металлическим изделиям различную форму под определенным давлением (эти свойства
называются ковкостью и пластичностью).
Металлическая связь
Металлическая
связь – основной тип химической связи
в кристаллической решетке металлов. В металлической связи присутствует и
некоторая доля ковалентной связи. Не только для щелочных, но для всех остальных
металлов металлическая связь
осуществляется обобществленными (делокализованными)
электронами, причем таких электронов приходится 1 электрон на 1 атом. Остальные
валентные электроны участвуют в ковалентной связи, которая в отличие от
металлической связи, обладает направленностью, т.е. здесь электроны
локализованы. Особенно велика роль ковалентной связи в кристаллах d-элементов,
т.к. d-орбитали имеют сложную геометрию и большие
размеры, т.е. большие возможности для перекрывания электронных облаков и
образования направленной ковалентной связи. Чем больше доля ковалентной связи,
тем прочнее кристаллическая решетка. О прочности кристаллической решетки можно
судить по величине энергии атомизации (энергии
кристаллической решетки). Е атомизации - это
количество энергии затрачиваемое на разделение 1 моля
атомов, связанных в кристаллической решетке на изолированные атомы (т.е.
перевод металла в парообразное состояние). С увеличением R атомы Е атомизации
уменьшается.
|
кДж/моль |
Li |
Na |
Cs |
|
Cu |
Ag |
Au |
|
Si |
W |
|
263 |
181 |
125 |
539 |
458 |
383 |
763 |
865 |
В побочных подгруппах та же закономерность, но Еат. больше.
Для щелочных и щелочноземельных металлов наблюдаются
минимальные значения энергий атомизации (решетки не
очень прочные - легко режутся ножом). Объясняется это тем, что для этих
металлов металлическая связь существует в чистом виде (нет ковалентной связи).
Для атомов неметаллов в их кристаллических решетках характерна только
ковалентная связь, так, например, в кристаллической решетке кремния Е=763 кДж/моль.
Наибольшая Еат.
решетки наблюдается для W (865
кДж/моль).
Зонная теория и метод
молекулярных орбиталей
Зонная теория использует метод молекулярных орбиталей для описания связи в металлических кристаллах.
Электронейтральные атомы металлов можно встретить лишь в изолированном
состоянии. С точки зрения ММО при взаимодействии 2-х атомных
орбиталей образуется 2 молекулярных орбитали: связывающая и разрыхляющая. При взаимодействии n атомных орбиталей
образуется n молекулярных орбиталей.
В случае щелочных металлов, имеющих 1 валентный ![]() идет заполнение только
связывающих
идет заполнение только
связывающих ![]() орбиталей,
таким образом заполняется только
орбиталей,
таким образом заполняется только ![]() орбиталей,
а остальные свободны.
орбиталей,
а остальные свободны.
У щелочных металлов на последнем энергетическом уровне
свободны также р-орбитали. Свободные
молекулярные орбитали образуют зону проводимости, а
занятые молекулярные орбитали осуществляют
металлическую связь и это называется валентной зоной.
Для элементов IIА группы
заполняются все молекулярные орбитали т.е. свободны
только р-орбитали ![]() из валентной зоны
могут переходить в зону проводимости при небольших энергетических воздействиях
(разность потенциалов, разность температур
(теплопроводность).
из валентной зоны
могут переходить в зону проводимости при небольших энергетических воздействиях
(разность потенциалов, разность температур
(теплопроводность).
Таким образом в междоузлиях
металлических кристаллов ![]() образуют 2 зоны. Валентная
зона и зона проводимости, причем образуется n число
М.О. очень близки по запасу Е. Объясняется это тем, что при
сближении n числа атомов происходит расщепление
уровней энергии. Воспользуемся М.М.О.
образуют 2 зоны. Валентная
зона и зона проводимости, причем образуется n число
М.О. очень близки по запасу Е. Объясняется это тем, что при
сближении n числа атомов происходит расщепление
уровней энергии. Воспользуемся М.М.О.
Т.е. образуется большое число очень близко лежащих отдельных
энергетических состояний (по значению
Е). При большом числе атомов энергия меняется практически непрерывно. Поэтому
для перехода ![]() из валентной зоны в
зону проводимости достаточно небольших Е воздействий. Таким образом при большом
числе атомов происходит расщепление Е уровней, на
большое число М.О.
из валентной зоны в
зону проводимости достаточно небольших Е воздействий. Таким образом при большом
числе атомов происходит расщепление Е уровней, на
большое число М.О.
Рассмотрим возникновение валентной зоны в атоме Na.
Рассмотрим энергетическую диаграмму для кремния Si:
Si 1s2
2s2p6 3s2p2 4so
3s и 3р орбитали в атоме Si
подвергаются sp3 гибридизации, поэтому 3s и 3p энергетические
подуровни выравниваются по запасу Е (очень близки).
В кристаллической решетке атом Si валентная зона и зона проводимости не прерываются,
т.е. между ними существует разница в уровнях энергии называемая энергия Ферми.
Это граничная Е, при температуре близкой к 0, между
заполненными и незаполненными энергетическими уровнями. Для кристаллической
решетки Si DЕ=1,12 В,
т.е. при обычных условиях Si не обладает
электропроводностью, но при приложении небольших энергетических воздействий
(разность потенциалов). Эта Е может быть преодолена
электронами и они из валентной зоны перейдут в зону проводимости, т.е. Si(кр.) является полупроводником. Для изоляторов характерно,
что они ни при каких воздействиях не проводят эл.тока, т.е. энергия Ферми слишком высока.
|
DЕ, эВ |
Ме |
Полупроводники |
Неметаллы |
алмаз |
|
0-0,1 |
0,1-3 |
3-6 |
5-7 |