Основы
химической термодинамики. I и II начала термодинамики. Критерии
самопроизвольного протекания процессов. Константа химического равновесия.
Начала
химической термодинамики
Термодинамика отвечает на вопрос: "Может или не
может протекать процесс при данных условиях?"
Основные понятия и определения, используемые в
термодинамике.
Система - объект изучения химической термодинамики.
Все процессы рассматриваются с точки зрения системы. Система - это вещество или
смесь веществ, мысленно или фактически выделенных из окружающей среды. По характеру
взаимодействия с окружающей средой системы делятся на
открытые, закрытые и изолированные.
|
|
открытые |
закрытые |
изолированные |
|
потоки вещества |
¯ |
- |
- |
|
потоки энергии |
¯ |
¯ |
- |
По агрегатному состоянию системы делятся на гомогенные и гетерогенные. Гомогенные системы - это
системы, в которых нет поверхности раздела. Гетерогенные системы - это системы,
в которых существует видимая поверхность раздела, вещества
находятся в разных фазах.
Систему характеризуют параметры состояния. Параметры
состояния бывают интенсивные и экстенсивные. Интенсивные параметры не зависят
от количества вещества в системе (например: плотность, температура). Экстенсивные
параметры зависят от количества вещества (например: объем, масса,
теплоемкость).
Любое изменение одного или нескольких параметров
называется переходом системы из одного состояния в другое.
Цикл - цепь последовательных превращений системы, в
результате которой все параметры возвращаются в исходное состояние.
Работа и теплота - формы передачи энергии. Теплота (Q) передается хаотическим движением молекул, это ненаправленная
форма передачи энергии. Работа (А) - направленная форма передачи энергии.
Внутренняя энергия - кинетическая энергия движения
атомов и молекул и потенциальная энергия их взаимодействия. Абсолютный запас
внутренней энергии неизвестен, так как для этого надо было бы учесть все
кинетические и потенциальные энергии частиц. Для внутренней энергии не существует
нуля отсчета так как все движения и взаимодействия
должны прекратиться. Можно определить лишь изменение этой величины (DU).
Внутренняя энергия - это функция состояния системы.
Под функцией состояния понимают такую функцию, изменение которой не зависит от
пути перехода системы из одного
состояния в другое, а зависит только от начального и конечного состояния
системы.
Начала
термодинамики.
Первый закон термодинамики:
Q = DU + A
Представляет собой в общем виде закон сохранения
энергии: подведенное количество теплоты расходуется на совершение работы и
изменение внутренней энергии.
Другие формулировки этого закона.
Невозможно провести процесс таким образом, чтобы
единственным его результатом было бы превращение теплоты в работу.
Вечный двигатель
первого рода невозможен (вечный двигатель первого рода работу, не
затрачивая энергии; вечный двигатель второго рода полностью превращает теплоту
в работу).
Нельзя получить работу, не затратив эквивалентного
количества теплоты.
Работу принято представлять в виде двух слагаемых:
А = рDV + А'max
рDV - работа расширения газов;
А'max -
максимальная полезная работа.
Q = рDV + А'max
Большинство практически важных процессов протекают
либо при постоянном давлении, либо при постоянном объеме.
1.
V = const, A'=0.
Qv = DU (теплота, поглощенная системой)
Qv - теплота при постоянном объеме.
Теплота при постоянном объеме равна изменению
внутренней энергии. Следовательно, чтобы измерить изменение внутренней энергии
надо измерить теплоту процесса при постоянном объеме системы.
2.
P = const
Qp = рDV + DU
DV = V2 -
V1 DU = U2 -
U1
Qp = U2 - U1
+pV2 - pV1
Qp = (U2 + pV2)
- (U1 + pV1)
H = U + pV
Энтальпия (H)
обладает всеми свойствами внутренней энергии.
Qp = DH
Qр -
теплота при постоянном давлении, DH - функция состояния системы.
Теплота при постоянном давлении равна изменению
энтальпии системы.
Направление самопроизвольного протекания химической
реакции. Второй закон термодинамики.
КОНкр ® КОНр-р, DН < 0;
NH4NO3кр ® NH4NO3р-р, DН > 0.
Самопроизвольными называются процессы, в результате
которых можно получить полезную работу.
Несамопроизвольные процессы - это процессы, которые требуют затрат
энергии (работы).
Энтропия (S) - мера
неупорядоченности в системе (функция состояния системы). Чем больше степень
беспорядка в системе, тем выше энтропия.
В отличие от энтальпии и внутренней энергии,
абсолютное значение энтропии может быть определено, поскольку энтропия *идеально
образованного кристалла при Т ~ 0К стремится к нулю. Значения абсолютной энтропии индивидуальных
веществ при стандартных условиях (Sо298, Дж/моль×К) имеются в таблицах.
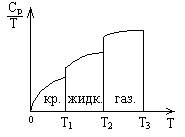
Учитывая, что энтропия - функция состояния системы, ее
изменение легко рассчитать по второму следствию из закона Гесса. Кроме того, в
таблицах имеются энтропии фазовых переходов, гидратации и т.д.
![]()
![]()
![]()
![]()
Чтобы учесть одновременно обе тенденции (выделение
тепла и увеличение беспорядка в системе) вводят функцию G.
G = H – T × S
G – энергия Гиббса (свободная энергия, изобарно-изотермический
потенциал).
T×S - "связанная энергия".
DGp,T =
- Amax
DG = 0 – система находится в состоянии равновесия.
Самопроизвольные процессы могут протекать, если DG убывает. Любая система стремится к уменьшению свободной
энергии.
DG = DH – T × DS
Для того, чтобы рассчитать
изменение свободной энергии необходимо рассчитать изменение энтальпии и
энтропии системы.
Задание. Определить, возможно
ли самопроизвольное разложение СаСО3 при 298К.
CaCO3 = CaO + CO2
|
Вещество |
DНо298, кДж/моль |
So298, Дж/мольК |
|
СаСО3 |
-1206 |
93 |
|
СО2 |
-394 |
214 |
|
СаО |
-635 |
40 |
DН = - 635 - 394 + 1206 = 177 кДж/моль;
DS = 214 + 40 - 93 = 161 Дж/мольК;
DG = 177000 - 47988 = 129022 Дж
DGo298 > 0
Þ процесс
самопроизвольно протекать не может
Изменение энергии Гиббса в химической реакции.
В отличие от изменения энтальпии или энтропии
изменение энергии Гиббса в химической реакции зависит не только от абсолютных
количеств веществ, но также и от их соотношения (концентраций). Эта зависимость
задается уравнением Вант - Гоффа.
mA + nB
= pC + rD
![]()
а - активность (эффективная концентрация).
a = j×C
Обычно коэффициент активности (j < 1) зависит от природы вещества и концентрации.
Из уравнения изотермы видно, что, меняя концентрации
веществ в исходном состоянии можно изменить DG. Для того, чтобы сравнивать DG отдельных
реакций между собой, необходимо задаться одним и тем же исходным состоянием:
Р = 1 атм (101325 Па)
Т = 298К
а = 1
Тогда получим уравнение стандартной изотермы Вант -
Гоффа:
DGo = - RTln(Kравн.)
![]()
Отсюда видно, что изменяя концентрации веществ в
исходном состоянии можно добиться необходимого направления и глубины протекания
процесса.
Задание. Определить, при каких температурах возможно
разложение СаСО3:
CaCO3 = CaO + CO2
DНо298 = 177 кДж; DSо298 = 161 Дж/К; DGо = DНо - ТDSо
DGо298 = 129,022 кДж; DGо600 = 80,4 кДж; DGо800 = 48,2 кДж;
DGо1000 = 16 кДж; DGо1200 = -16,2 кДж.
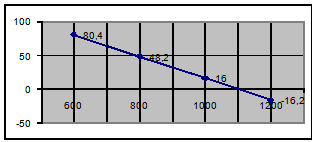
Построим графическую зависимость DGо от Т:
Из графика видно, что DG = 0 при Т = 1100 К. Выше этой температуры процесс
будет протекать самопроизвольно при стандартном состоянии, т.е. Р(СО2) = 1
(в атмосфере СО2).
Так как Р(СО2) в
воздухе равно 0,03, то получим следующие данные:
DG = DGо + RTln(P(C02))
DGо298
= DGо298 - 8,7 = 120 кДж; DGо600 =
80,4 - 17,5 = 63 кДж;
DGо800 = 48,2 - 23,3 = 25 кДж; DGо1000 = 16 -29 = -13 кДж;
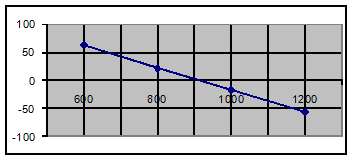
DGо1200 = -16,2 - 34,9 = -56,4 кДж.
Из графика видно, что Т равн. 900 К.
Химическое
равновесие.
Состояние
системы, которое характеризуется равенством скоростей прямой и обратной реакции
и постоянством концентрации всех веществ называется химическим равновесием.
mA + nB = pC
+ qD
![]()
Константа
равновесия зависит от природы веществ и температуры и не зависит от исходных
концентраций. В небольших количествах (1 - 2 атм) давление на константу равновесия не влияет.
DGo = - RTln(Kравн.)
Изменение
константы равновесия с температурой определяется изменения энтальпии. Если DН < 0, то с
увеличением температуры константа равновесия уменьшается. Если DН > 0, то с
увеличением температуры константа равновесия
увеличивается.
![]()
Смещение равновесия.
Смещение
равновесия – переход системы из одного равновесного состояния в другое при
изменении внешних условий.
Принцип Ле-Шателье
Если изменить
одно из условий, при которых система находится в равновесии, то в системе
усилится та реакция которая противодействует производственному
изменению. На конденсированные системы давление существенного влияния не
оказывает.
N2 + 3H2
= 2NH3