Скорость
химической реакции. Факторы, влияющие на скорость химической реакции. Константа
скорости. Порядок реакции. Энергия активации. Катализ.
Кинетика и механизм
химических реакций
Кинетика –
раздел химии, изучающий скорости и механизмы химических реакций.
Скорость реакции – изменение концентрации реагирующих веществ в единицу времени.

![]()
Все реакции делятся на
гомогенные и гетерогенные.
Гомогенные реакции – реакции, в которых все реагирующие вещества находятся в одной фазе.
Гетерогенные реакции – реакции, в которых реагирующие вещества находятся в разных фазах.
Кинетические закономерности протекания гомогенных и
гетерогенных реакций существенно различаются.
Факторы, влияющие на скорость реакций:
1) природа реагирующих веществ;
2) концентрация (давление влияет через изменение
концентрации);
3) температура;
4) катализатор (изменение природы реагирующих веществ).
Кинетика гомогенных химических реакций
Влияние концентрации на скорость реакций. Закон
действия масс.
При постоянной температуре скорость химических реакций
прямо пропорциональна произведению концентраций реагирующих веществ, взятых в
некоторых степенях.
хА + уВ = рС
![]() - кинетическое
уравнение
- кинетическое
уравнение
К – константа скорости
реакции. Это одна из трех фундаментальных характеристик реакции. Зависит от
природы реагирующих веществ и температуры (не зависит от концентрации веществ).
m, n – частные порядки
реакции по данным веществам.
m + n – порядок реакции.
Порядок реакции – вторая фундаментальная кинетическая характеристика реакции. Зависит
от природы реагирующих веществ. Только для элементарных реакций, идущих в одну
стадию х и m, у и n – совпадают.
Принято различать реакции нулевого, первого, второго,
третьего и дробных порядков. Наиболее часто встречаются реакции первого и
второго порядков.
1. Реакции нулевого порядка.
![]()
![]()
![]()
Начальные
условия:
t = 0, С = С0;
С0 – С = k0t
![]() - уравнение константы
реакции нулевого порядка
- уравнение константы
реакции нулевого порядка

Зависимость
концентрации от времени:
СаСО3
= СаО + СО2 (t)
![]()
2.
Реакции первого
порядка
![]()
![]()
![]()
Начальные
условия:
t = 0, С =
С0;
const = lnC0
ln С = - kIt +ln C0
![]()
![]() - уравнение константы
реакции первого порядка
- уравнение константы
реакции первого порядка
Зависимость
lnC от времени:

Н2
= Н + Н (Pt, t)

3.
Реакции второго
порядка
или

![]()
![]()
Начальные
условия:
t = 0, С = С0; ![]()
![]()
![]() - уравнение константы
реакции второго порядка
- уравнение константы
реакции второго порядка

Зависимость
величины обратной концентрации от времени:
N2 + O2 = 2NO
![]()
4.
Реакции третьего
порядка
2NO
+ O2 = 2NО2
![]()
Порядок
реакции определяется порядками стадий этой реакции:
а)
последовательные – самой медленной;
б)
параллельные – самой быстрой.
Гетерогенные реакции
Гетерогенные реакции являются многостадийными:
1. Подвод реагентов к границе раздела (медленная стадия)
2. Адсорбция на поверхности
3. Химическое взаимодействие (может протекать в несколько
элементарных стадий)
4. Десорбция продуктов реакции
5. Отвод продуктов реакции от поверхности раздела фаз (диффузия) в объем системы
(медленная стадия)
Скорость процесса определяется самой медленной
стадией. Сказать, какая из стадий будет самой медленной заранее невозможно, так
как законы происходящих процессов сильно отличаются друг от друга и их нельзя
свести к одному уравнению (виду).
При постоянной температуре скорость гетерогенной
реакции прямо пропорциональна площади границы раздела фаз и произведению
концентраций жидких и газообразных веществ в степенях, соответствующих частному порядку по веществам
в данной реакции.
Fe2O3
+ 3CO = Fe + 3CO2
![]()
![]()
![]()
![]()
Zn + 2HCl = ZnCl2
+ H2
![]()
![]()
![]()
Влияние давления на скорость реакции.
Давление оказывает влияние на неконденсированные
системы.
Пример: Во сколько раз увеличится скорость реакции,
если увеличить давление в 3 раза?
2NO + O2 = 2 NO2
Проведем реакцию в цилиндре под поршнем:
![]()
При уменьшении давления в 3 раза в 3 раза
увеличивается концентрация газообразных веществ.
Решаем задачу по закону действующих масс:
![]()
![]()
![]()
Ответ:
Скорость реакции увеличится в 27 раз.
Методы определения константы скорости и
порядка реакции
В абсолютном большинстве случаев по виду химического
уравнения невозможно предположить,
каково будет кинетическое уравнение. Поэтому основные кинетические
характеристики, а именно константа скорости, определяются, исходя из
экспериментальных данных.
1. Графический метод. Состоит в подборе функции от концентрации, линейно зависящей от
времени.
2.
Аналитический
метод. Состоит в подборе
кинетического уравнения:
|
t0 |
С0 |
|
|
|
|
t1 |
С1 |
k0,1
|
kI,1 |
kII,1 |
|
t2 |
С2 |
k0,2 |
kI,2 |
kII,2 |
|
tn |
Сn |
k0,3 |
kI,3 |
kII,3 |
Та колонка, в которой значения константы остаются
постоянными, соответствует кинетическому уравнению реакции.
![]()
3.
Метод Вант – Гофа.
Применяется
для случаев, когда скорость реакции зависит от концентрации одного вещества и
когда имеются какие-либо независимо определенные скорости реакции.
![]()
При
этом экспериментально находятся:
С0 ![]() u0
u0
С1 ![]() u1
u1
С2 ![]() u2
u2
С3 ![]() u3
u3
Сn ![]() un
un

![]()
4. Метод определения константы скорости по периоду полупревращения (самостоятельно).
Влияние температуры на скорость реакции.
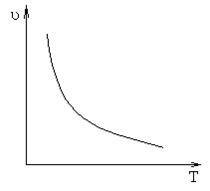

С увеличением температуры скорость реакции в
большинстве случаев растет. Но есть реакции, в которых скорость при повышении
температуры начинает убывать. Например, белок сворачивается, т.е. используется
уравнение ферментативной реакции.
Радикальное хлорирование:
Правило
Вант-Гоффа:
При увеличении температуры на 10оС скорость
реакции увеличивается в 2 – 4 раза.
 g = 2 – 4
g = 2 – 4
Например:
DТ = 40
g = 2 ![]()
g = 3 ![]()
g = 4 ![]()
Точная зависимость скорости реакции от температуры выражается
уравнением Аррениуса:
![]()
k – константа скорости;
Еакт – энергия активации;
А – константа, зависящая от природы реагирующих
веществ.
Под энергией активации понимают тот повышенный запас
энергии (по сравнению со средней энергией молекул), которым должны обладать молекулы,
чтобы их столкновения приводили к химическому взаимодействию.
Энергия активации зависит только от природы
реагирующих веществ (третья фундаментальная кинетическая характеристика).

Если энергия активации меньше 120 кДж/моль, то реакция
идет очень медленно.
50 < E < 120 кДж/моль – обычные реакции;
Е < 50 кДЖ/моль – быстрые
и очень быстрые реакции.
С увеличением температуры увеличивается не только
общее число столкновений, но и число эффективных столкновений за счет
увеличения доли активных молекул.

Енеобх –
необходимая доля активных молекул.
Т2 > Т1,
g = 3
Методы определения энергии активации
1. Аналитический метод:

2. Остальные методы – самостоятельно.
Кинетика
гетерогенных реакций. Ее особенности.


Во многих случаях гетерогенная кинетика довольно
хорошо описывается простым уравнением: «параболический закон роста пленки»:
![]() - скорость нарастания
толщины продуктов.
- скорость нарастания
толщины продуктов.
![]()
Лимитирующей будем считать диффузию подвижного
компонента через слой продуктов реакции.
![]()
![]()
Константа (k)
зависит от природы реагирующих веществ.
![]()
![]()
Если t = 0, то у = 0;
сonst
= 0
![]()

![]() или
или ![]() - уравнение Янга
- уравнение Янга
Уравнение Янга можно применять даже для двух твердых
поверхностей (но только пока не израсходуется 60% вещества).

Атомы железа свободно проникают через слой оксида Fе3О4, а молекулы кислорода не
могут проникнуть сквозь Fе3О4.
Следовательно, железо – подвижный, а кислород – неподвижный реагент.
Катализ.
План:
-
влияние
катализатора на скорость химической реакции
-
гомогенные и
гетерогенные химические реакции
-
промежуточные
стадии в гомогенных и гетерогенных каталитических реакциях
Катализ это ускорение химической реакции под действием
некоторых веществ. Вещества, ускоряющие химическою реакцию, но не изменяющиеся
в результате реакции, называются катализаторами.
Вещества, замедляющие химическую реакцию, называются ингибиторами.
Катализатор не
меняет термодинамику процесса, т. е. если в данных условиях DG > 0, то и в присутствии катализатора реакция не
пойдёт.
Катализатор
увеличивает скорость химической реакции, как прямой, так и обратной, т. е.
ускоряет момент наступления равновесия. Константа равновесия при этом не
меняется.
Действие
катализатора основано на том, что он вступает во взаимодействие с исходными
веществами с образованием промежуточного продукта С
(рис.1.), причем энергия активации этой стадии небольшая. Затем
промежуточный продукт превращается в конечный тоже с очень малой энергией активации.
Суммарная энергия активации этих двух стадий меньше энергии активации некатализируемой реакции,
т.е. ![]() . Таким образом, снижая энергию активации, катализатор
увеличивает число активных молекул.
. Таким образом, снижая энергию активации, катализатор
увеличивает число активных молекул.
А + В = АВ;
В присутствии
катализатора: А + Кат→ С;
C + B → AB + Кат.

Рис.1.
Энергетическая диаграмма катализируемого (I) и некатализируемого (II) процессов.
Еисх- общий запас энергии исходных веществ,
Екон - общий запас энергии продуктов реакции.
Екакт = Е1
+ Е2, Екакт < Еакт
Катализ бывает
гомогенный и гетерогенный. При гомогенном катализе реагирующие вещества и
катализатор находятся в одной фазе.
Примером гомогенного катализа может служить гидролиз
сложных эфиров в кислой среде, катализатором являются ионы Н+:

Примером
гомогенного газофазного катализа может служить окисление
окиси углерода в присутствии водяных паров.
![]()
В гетерофазном катализе, катализатор -
твёрдая фаза, а исходные вещества и продукты реакции – газы или жидкости.
Гетерогенный катализ происходит на
поверхности раздела фаз, т. е. на поверхности катализатора. Исходные вещества
адсорбируются на поверхности катализатора, при этом ослабевают связи в
молекуле, вследствие чего происходит снижение Еакт
и ускорение реакции.