Четвертая группа Периодической системы Д.И.Менделеева
– титан, цирконий, гафний.
Ti
…1s2 2s2 p6 3s2 p6 d2
4s2
Zr …4d2 5s2
Hf …5d2 6s2
Th …5fo 6s2 6p6
6d2 7s2
Ku
…5f14 6s2 6p6 6d2 7s2
Th - торий
устойчивый изотоп 239, период
полураспада (Т1/2 = 18 млд.лет).
Ku - элемент синтезированный,из
плутония за счет бомбардировки ядрами Не. Химические свойства Тh и Ku во многом аналогичны свойствам Ti, Zr, Hf,
конечно, с учетом того, что это элементы 7 периода, rат увеличивается, поэтому в соединениях
эти элементы проявляют устойчивую степень окисления 4+, основной характер
оксидов и гидроксидов усиливается.
Физико-химические свойства
|
|
tпл. |
tкип. |
Р |
Ео |
Содержание масс % в земной коре |
|
Ti |
1668 |
3260 |
4,51 |
-1,75 |
0,6 |
|
Zr |
1855 |
4330 |
6,51 |
-1,43 |
0,02 |
|
Hf |
2222 |
5400 |
13,31 |
-1,57 |
4×10-4 |
Измерение электронных потенциалов Ti, Zr, Hf затруднительно, поскольку эти
металлы покрываются на воздухе при обычной температуре защитной пленкой
(оксидно-нитридной) т.е. находящиеся в воздухе О2
и N2, попадая на поверхность этих металлов, расщепляются на атомы.
Поскольку на d - подуровне Ti, Zr, Hf предпоследнего энергетического
уровня свободны 3 орбитали, атомарный кислород и
атомарный азот могут поместить свои валентные ![]() электроны на свободные орбитали,
поэтому атомы О и N внедряются в
кристаллическую решетку этих металлов (в поверхностный слой). Свойства
поверхностного слоя металлов резко изменяются. (соединения нестехиометрического состава): ~ЭО2, ~Э3N4. Эти соединения обладают химической
инертностью, твердостью, тугоплавкостью и коррозионной устойчивостью.
Электродные потенциалы Ti, Zr, Hf смещаются в область положительных
значений. Поэтому электродные потенциалы были измерены при постоянной зачистке
поверхности этих электродов. В отсутствие оксидной пленки Ti, Zr, Hf - активные металлы.
электроны на свободные орбитали,
поэтому атомы О и N внедряются в
кристаллическую решетку этих металлов (в поверхностный слой). Свойства
поверхностного слоя металлов резко изменяются. (соединения нестехиометрического состава): ~ЭО2, ~Э3N4. Эти соединения обладают химической
инертностью, твердостью, тугоплавкостью и коррозионной устойчивостью.
Электродные потенциалы Ti, Zr, Hf смещаются в область положительных
значений. Поэтому электродные потенциалы были измерены при постоянной зачистке
поверхности этих электродов. В отсутствие оксидной пленки Ti, Zr, Hf - активные металлы.
Строение атомов и устойчивые степени окисления.
|
|
Ti |
Zr |
Hf |
|
степ.ок. |
4+ 3+ |
4+ |
4+ 2+ |
|
коорд. число |
6 |
6,7,8 |
6,7,8 |
|
rа, нм |
0,146 |
0,160 |
0,159 |
Радиусы атомов Zr и Hf - очень близки. Zr и Hf - элементы близнецы. В природе соединения Hf всегда сопутствуют соединениям Zr.
Ti4+ O2 - ртутил ZrO2 - бадделит HfO2 ZrSiO4 - цирконил
Выплавку этих металлов производят,
не разделяя их, т.е. получают сплав Zr с Hf. Весьма затруднительно отделить Hf от Zr, т.к. во всех химических соединениях
свойства одинаковы, за исключением некоторых комплексных соединений.
Существуют комплексные соединения
со сложными органическими лигандами,
в которых проявляется различие свойств (т.е. одно из них может выпасть в осадок
при определенных условиях).
Разделять Zr и Hf необходимо, поскольку они
применяются в промышленности в чистом виде:
Zr - отражатель нейтронов
Hf - поглотитель нейтронов
Ti,
Zr и Hf больше всего используется в
качестве добавок в стали.
Химические свойства
В металлическом состоянии Ti, Zr и Hf - обладают рядом ценных свойств, поэтому
важно знать свойства металлов.
Ti, Zr, Hf при обычной температуре реагируют со всеми не- металлами, особенно с О2 и N2 с
образованием соединений нестехиометрического состава. Это активные металлы,
поэтому в тонкодисперсном состоянии они возгораются от искры, при 200оС
- взрываются.
Компактные металлы - сгорают при
температуре красного каления. (600оС).
С О2,
N2, S, C, B, Si, Hal2, реагируют в порошкообразном
состоянии без нагревания, а в компактном состоянии - при 800оС.
Карбиды, нитриды, бориды и силициды - вещества тугоплавкие, химически инертные,
температура плавления 3000-4000оС.
Порошкообразные Ti, Zr, Hf
поглощают Н2 при комнатной
температуре, образуя гидриды внедрения, поэтому Ti, Zr, Hf используют в качестве аккумуляторов
Н2, а также для обеспечения вакуума. Порошкообразные Ti, Zr, Hf поглощают и другие газы. Для Zr и Hf, поглощение при 400оС,
выделение 450оС
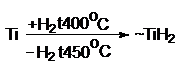
Оксидно-нитридная пленка на поверхности
металла может быть удалена не только зачисткой, но и при обработке в растворе H2F2 (плавиковой кислоты). Смесь H2F2 + HNO3 применяется при травлении
шлифов металлов в металлографии.
TiO2
+ 3H2F2 =
H2[TiF6]
+ 2H2O
ZrO2
+ 4H2F2 = H4[ZrF8] + 2H2O
Защитную пленку можно разрушить
нагреванием. Оксидная пленка растрескивается. Металл реагирует с водой:
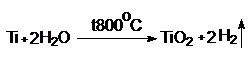
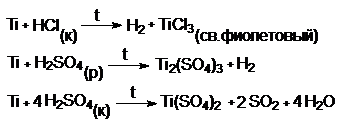
При обычной температуре H2SO4(к) и HNO3(к) пассивируют
металлы.
При обратной температуре Ti не реагирует с концентрированным
раствором щелочи, но при кипячении реакция идет:
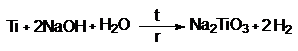
Химические свойства соединений
Оксиды
|
|
TiO2 |
ZrO2 |
HfO2 |
|
tплавл. |
1870 |
2850 |
2900 |
По химическим свойствам оксиды Ti, Zr, Hf инертны, подобны SiО2 (и SnO2). Эти оксиды не реагируют с водой, с азотной кислотой и щелочами при
обычной температуре. Эти оксиды амфотерны, хотя
визуально доказать амфотерность этих оксидов затруднительно. Доказательство
амфотерности надо вести в безводной среде, так как соединения гидролизуются полностью (т.е. по последней ступени). В
результате гидролиза образуется TiO2 × nH2O¯
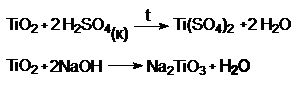
Под действием продукта реакции (H2O) идет гидролиз до TiO2 × nH2O.
Гидроксиды
![]()
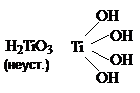
TiO(OH)2 гидратируется,
затем гидролизуется, подвергается полимеризации и
частицы укрупняются до размера коллоидных частиц. Полимеризация происходит во
времени и осадки гидроксидов "стареют".
![]()
полимеризуется очень быстро
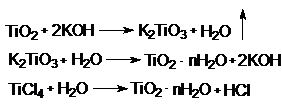
Свежеприготовленные осадки Ti, Zr, Hf
называют a-формой.
Долгостоявшие "состарившиеся" осадки
называют b-формой.
a и b-форма
ведут себя химически по разному. b-форма
– более инертна. Продукт полимеризации образует сначала двухядерные
комплексы, затем полиядерные.
Процессу полимеризации способствуют
нагревание и щелочная среда. Если 2 атома Ti в двухядерном
комплексе соединены за счет ОН-групп,
то это тип полимеризации носит название оляция. Если
же они соединяются за счет атома О, то это оксоляция
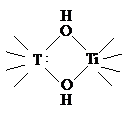
Cначала идет оляция,
затем оксоляция (-Н2О).
Ti(OH)4 – свежеприготовленный
и "состарившийся" ведут себя по разному.
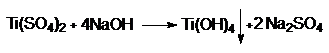
Это соединение неустойчиво, очень
быстро гидратируется и переходит в комплексное
соединение
![]()
Т.е. при гидратации координационное
число Ti(VI) равно 6.
Сначала образуется неустойчивый димер за счет процесса оляции,
затем быстро протекает процесс оксоляции за счет
отщепления молекулы воды. За счет процессов оляции и оксоляции образуются тримеры, тетрамеры и полимеры, до образования коллоидных частиц.
Свежеприготовленный Ti(OH)4 реагирует и с
кислотами и со щелочами, причем с кислотами реакция протекает легче, т.е. в
обычных условиях, а со щелочами при сплавлении. Состарившийся
Ti(OH)4 не реагирует ни с кислотами, ни со
щелочами.
При переходе к Zr(OH)4 и Hf(OH)4 усиливается основной
характер свежеприготовленных гидроксидов, т.е. с щелочами они не реагируют (процесс полимеризации происходит
аналогично).
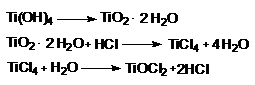
TiCl4 - неустойчив в водной среде.
TiOCl2 – устойчив (т.к. большое сродство Ti к О)
![]()
Несколько иначе идет реакция с HCl(к)
![]()
H2[TiCl6] – устойчивое, хорошо растворимое соединение.
![]()
Комплексные соединения Ti4+ являются устойчивыми, а
комплексные пероксосоединения употребляются в аналитической
химии
![]()
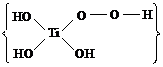
Гидролиз TiCl4
I стадия - гидратация:
TiCl4
+ 2H2O =
[TiCl4(H2O)2]
II стадия - гидролиз:
[TiCl4(H2O)2]
+ 4H2O =
[Ti(OH)4(H2O)2] +
4HCl
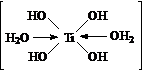
TiCl4 в водной среде
образует аэрозоль: происходит испарение, шипение TiCl4, Н2О,
HCl и
образуются полимерные осадки. Если подкислить раствор TiCl4, то идет
частичный гидролиз
I TiCl4 +
H2O =
Ti(OH)Cl3 + HCl
II Ti(OH)Cl3 + H2O =
Ti(OH)2 Cl2 + HCl
Помимо 4+ Ti может проявлять 3+ (несколько
менее устойчив) и 2+.
Соединения Ti3+
Получение Ti3+
2H2TiCl6 + Zn = 2TiCl3 + ZnCl2 + 4HCl
2H2SO4
+ 2TiOSO4 + Zn = Ti2(SO4)3
+ ZnSO4 + 2H2O
[Ti(H2O)6]3+ к.ч. = 6. – гидролизу подвергается в меньшей
степени, т.е. Ti(OH)3 - является более сильным основанием, чем Ti(OH)4. Концентрация продуктов
гидролиза < 1%.
H2[TiCl6]
+ Zn = 2TiCl3
+ ZnCl2 + 4HCl
TiO2
+ H2 = Ti2O3 + H2O
Ti(OH)3 – гидроксид
основного характера, легко растворяется в кислотах, если он
свежеприготовленный.
Ti2(SO4)3
+ NaOH = Ti(OH)3 ¯ + Na2SO4
При стоянии стареет.
Соединения Ti2+
2TiCl3 + Ti 3TiCl2
2+ не устойчивая степень окисления
и подвергается диспропорционированию.
2TiCl2 = Ti + TiCl4
Ti(OH)2 – на воздухе быстро
окисляется О2:
2Ti(OH)2 + O2 = [TiO(OH)2] ¯
Окислительно-восстановительные свойства.
Соединения Ti4+ - устойчивы и являются очень
слабыми окислителями.
Ti3+ и Ti2+ - неустойчивы, являются сильными
восстановителями.
TiCl2
+ O2 + HCl = Ti4+
TiCl3
+ O2 + H2O = Ti4+
Ti(SO4)3 + KMnO4 + H2SO4 = Ti4+ + Mn2+
(составьте уравнения реакций).
Комплексные соединения
Наиболее характерны галогенидные и оксокомплексы:
H2[TiCl6], K3[ZrF7], [Zr(SO4)3O]4-, [Hf(F)8]4-
пероксо-комплексы: [Ti(SO4)(O2)]2-