Шестая группа Периодической системы Д.И.Менделеева
– хром, молибден, вольфрам (6ч)
|
|
Cr |
Mo |
W |
|
|
d54s1 |
4ds5s1 |
d46s2 |
|
rа, нм |
0,127 |
0,137 |
0,14 |
|
ст.ок. |
2+,
3+,4+, 5+, 6+ |
4+,
5+,6+ |
4+,
5+, 6+ |
|
к.ч. |
4,6 |
4,
6, 8 |
4,
6, 8 |
Переработка хромистого железняка:
1)
в дихромат:
4Fe(CrO2)2
+ 8Na2CO3 + 7O2 = 8Na2CrO4
+ 2Fe2O3 + 8CO2
2Na2CrO4 + 2H2SO4 =
Na2Cr2O7 + 2NaHSO4 + H2O
Na2Cr2O7
+ 2C = Cr2O3 + Na2CO3
+ CO
2)
в феррохром
Fe(CrO2)2
+ 4C = Fe + 2Cr +
4CO
Химические свойства металлов
|
|
Ео, В |
|
Cr |
-0,74 |
|
Mo |
-0,2 |
|
W |
-0,15 |
На воздухе Cr, Mo, W покрываются оксидной пленкой.
4Cr + 3O2
= 2Cr2O3
Порошкообразный Cr может полностью сгореть в О2 при 600оС.
Cr, Mo, W – могут реагировать с галогенами (F2, Cl2, Br2) при высокой температуре. При температуре
> 1000оС реагируют с углеродом, азотом и серой, образуя
соединения нестехиометрического состава.
~WC –победит – высокая твердость –
изготавливаются сверла и резцы.
WC – химически инертен,
растворяется только в царской водке и НNO3 (к) при длительном
кипячении, т.к. WC имеет плотнейшую упаковку атомов в
кристаллической решетке.
WC
+ 4HCl(к) + 10HNO3(к)
= H2[WO2Cl4]
+ CO2 + 10NO2 + 6H2O
WC
+ 10HNO3
WO3 + CO2 + 5H2O + 10NO2
В воде
Cr, Mo, W
не
растворяются, т.к. покрыты защитной пленкой.
Mo,
W + HCl ¹
Cr
+ 2HCl + 4H2O = [Cr(H2O)4Cl2] + H2
- голубой раствор
Mo
может растворятся в HF.
Mo
+ 2H2F2 + H2O = [MoOF4] + 3H2
W не растворяется в кислотах, где Н+
- окислитель.
При комнатной температуре Cr, Мо, W пассивируется
H2SO4 (к) и в HNO3 (р) и (к). При t реакции идут по обычным закономерностям, т.к.
происходит депассивация
Cr
+ 6HNO3(к)
= Cr(NO3)3
+ 3NO2 + 3H2O
Оксиды и гидроксиды
|
Cr2+ |
CrO |
Cr(OH)2 |
|
Cr3+ |
Cr2O3
(т.зеленый) |
Cr(OH)3
= CrO(OH) + H2O
|
|
Cr4+ |
CrO2 (черный) |
CrO2
= CrO3 + Cr2O3
|
|
Сr6+ |
CrO3 (т.красный) |
H2CrO4, H2Cr2O7,
H2Cr3O10 |
|
Mo4+ |
3MoO2 (коричневый) |
|
|
Mo6+ |
MoO3 (св.зеленый) |
H2MoO4 |
|
W4+ |
WO2 (коричневый) |
|
|
W6+ |
WO3 (желтый) |
H2WO4 |
WO2 –
устойчивый оксид (до 1500оС) – плавится, а при дальнейшем нагревании
возгоняется без разложения.
CrO
Cr2+ - неустойчивая степень окисления.
Для получения CrO требуются особые условия:
2(Hg)Cr + O2 = 2CrO
Cr2O3
+ 2H(Zn + HCl) =
2CrO + H2O
CrO не устойчив 3CrO = 2Cr
+ CrO3
4CrO
+ O2 = 2Cr2O3
Cr(OH)2
Получение:
CrCl2
+ 2NaOH = Cr(OH)2 ¯ + 2NaCl
Cr(OH)2 – легко окисляется О2
4Cr(OH)2 + O2 = 4Cr(OH)3 + 2H2O
Cr2+ - сильный восстановитель
Eo(Cr2+/Cr3+)Þ-0,407B
2CrCl2 +
2H2O = H2 +2Cr(OH)Cl2
Cr(OH)2
- основной характер
Cr(OH)2 +
2H3O+ + 2H2O = [Cr(H2O)6]2+
Cr(OH)2 + NaOH ¹
Наиболее устойчивым соединением является тетрацетат Cr(II). Это комплексное соединение, где в качестве лигандов (СH3COO-) - бидентантные, к.r.= 6
2[Cr(H2O)4Cl2]
+ 4CH3COONa = [Cr(H2O)2(CH3COO)4]
+ 4NaCl
Mo образует аналогичное соединение,
где длина связи (Мо-Мо) = 0,213, связи (Мо-Мо) = 0,243 нм.
Связь Cr-Cr
- довольно слабая, а у Мо-Мо более прочная. Комплексные соединения, в которых имеется связь Ме-Ме называются
кластерными соединениями.
Тетраацетатодиаквадихромат (II) является димером,
но т.к. длина связи между атомами Cr сравнительно велико, его не относят к кластерным соединениям.
Cr2O3 – наиболее устойчивый оксид хрома.
Cr2O3 -
свежеполученный - аморфный - зеленая окраска,
прокаленный мелкокристаллический Cr2O3 имеет
черную окраску, химически инертен, не реагирует ни с кислотами ни с щелочами. tпл=2265оС. Свежий Cr2O3
можно получить:
I.
CrCl3 + 3NaOH = Cr(OH)3 + 3NaCl
Cr(OH)3 =
CrO(OH) + H2O
CrO(OH) Cr2O3
+ H2O
II.
(NH4)2Cr2O7
= Cr2O3
+ N2 + H2O
Cr2O3
+ 6HCl + 2[Cr(H2O)6]Cl3
Cr2O3
+ 6NaOH 2Na3[Cr(OH)6]
Cr(OH)3 – свойства
свежеполученного и долгостоявшего различны.
Cr2O3
+ NaOH
NaCrO2 + H2O
NaCrO2
+ 2H2O
Na3 [Cr(OH)6]
Na3[Cr(OH)6]
+ 3CO2
Cr(OH)3 ¯ + 3NaHCO3
При стоянии Cr(OH)3 - отщепляет воду
Cr(OH)3 = CrO(OH) + H2O
Если получать Cr(OH)3
обычными способами, то получается CrО(OH)
– метагидроксид Cr(III).
Cr(H2O6)Cl3 +3NaOH = CrO(OH) + 3NaCl + 7H2O
Метагидроксид далее подвергается полимеризации. Оловые, оксоловые мостики -
слоистый осадок, химически инертный.
Соли Cr3+
В растворе (холод.) существует [Cr(H2O)6]Cl3.
[Cr(H2O)6]Cl3
[Cr(H2O)5Cl]Cl2 [Cr(H2O)4Cl2]Cl
СrCl3 – кристаллический,
красно-фиолетовый.
Безводные соли Сr3+ плохо растворяется в воде
(медленно), а кристаллогидраты – быстро и легко.
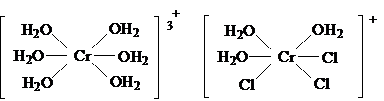
Гидролиз.
Некоторые соли Сr3+ подвергаются необратимому
гидролизу Cr2S3, Cr2(SO3)3, Cr(CH3COO)3.
2CrCl3
+ 3H2S = Cr2S3 + 6HCl
Cr2S3
+ 6H2O = 2Cr(OH)3 ¯
+H2S
При совместном гидролизе 2-х солей
разного типа гидролиз усиливается и идет до конца.
3H2O
+ 2CrCl3 + 3Na2SO3 = 2Cr(OH)3 + H2SO4
+ 3SO2 + 6NaCl
Некоторые соли на 1-й стадии гидролизуются как мономеры, на 2-ой стадии димеризуются.
[Cr(H2O)6]Cl3
+ (H2O) =
[Cr(H2O)5OH]Cl2
+ HCl
2[Cr(H2O)5OH]2+ =
[Cr2(H2O)8(OH)2]
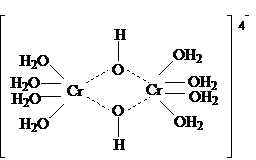
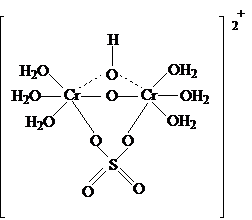
Далее полимеризация. При гидролизе
может также наблюдаться гидратная изомерия. Например если вместо 2 молекул воды по внутреннюю сферу
включится SO42-
Качественные реакции на W5+ и Мо5+
Из сплава соединений Мо или W
2(NH4)2WO4
+ Zn + 6HCl = W2O5
+ ZnCl2 + 4NH4Cl + 3H2O
Мо – аналогично
Mo2O5 – молибденовая синь
W2O5 – вольфрамовая синь
Оксиды при стоянии полимеризуются.
[Mo4O10(OH)2]
Cоединения Cr6+, Mo6+ и W6+.
Оксиды.
CrO3 – темно красный (относительно устойчив t=500оС)
4CrO3
2Cr2O3 + 3O2
tпл.=197оС
МоО3 tпл.=801оС (белый цвет)
Возгоняется без разложения – устойчив
WO3 – желтый tпл.=1473оС
Не плавится, а сразу возгоняется –
устойчив.
Получение: CrO3
K2Cr2O7
+ H2SO4 (к) = 2CrO3 ¯
+ 2KHSO4 + H2O
1.
CrO3
+ H2O = H2CrO4
2.
CrO3 + H2O =
H2Cr2O7 2H2Cr2O7
= H2Cr4O13
3. CrO3 + H2O = H2Cr3O10
Общая формула полихроматов
и полихромовых кислот:
H2
Crn O3n+1
Ме 2Cr n O3 n+1
Полихроматы получаются в сильно
концентрированных растворах, а при сильном разбавлении могут опять преобразоваться
в хроматы-ионы.
Хромовая кислота H2CrO4
H2CrO4 = H+ + HCrO (KI =3,16 × 10-7)
HCrO =
H+ + CrO2-4 (KII =9 × 10-17)
2HCrO =
Cr2O + H2O
Для растворов средней концентрации
существует график показывающий соотношение хромат-
дихромат и гидрохромат ионов.
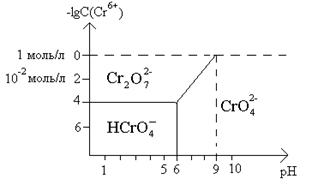
В кислых растворах рН (0-6) при
С< 10-4 М существуют гидрохромат-ионы.
В этом же интервале рН и до рН=9 при повышенной концентрации существуют до 1М
существуют дихромат-ионы.
При рН
> 9 и С £
1M
существует хромат-ион. В более концентрированных растворах
существуют полихроматы.
Полихроматы – пример: изополисоединений.
Изополисоединения – это многоядерные комплексы,
содержащие только 1 вид лигандов.
Гетерополисоединения – это многоядерные комплексы,
содержащие различные виды лигандов.
Изополисоединения:
[Cr4O13]2- [Mo7O24]6-
[W12O41]10-
Гетерополисоединения:
K4[Si(W12O40)]
Na3[P(Mo12O40)]
12(NH4)2Mo6+O4
+ Na3PO4 + 24HNO3(к)
=
=
(NH4)3[P(Mo12O40)]
¯
+ 18H2O + 21NH4NO3 + ×NaNO3