Двенадцатая
группа Периодической системы Д.И.Менделеева - цинк, кадмий, ртуть.
|
|
Zn |
Cd |
Hg |
|
|
3d104s2 |
4d105s2 |
5d106s2 |
|
rа |
0,139 |
0,156 |
0,160 |
|
ст.ок. |
Zn22+ |
Cd22+ |
Hg22+
(-Hg-Hg-) |
|
|
крайне неустойч. |
неустойч |
|
|
|
|
|
|
Если в соединении присутствует связь Ме-Ме, соединение называется КЛАСТЕР Hg22+ - кластерный ион. Подуровень d10
стабилизирован, степень окисления 2+.
Характерная особенность подгруппы –
наличие кластерных ионов.
Свойства соединений обратных Ме22+
Есть экспериментальные
доказательства двухядерного строения Ме22+.
1. Данные
рентгеноструктурного анализа в связи (Hg-Hg)
=).238 Нм, тогда как lHg-Hg в твердой ртути = 0,320 Нм.
2. Диамагнетизм
Ме+…d10n3 – парамагнетизм
Ме22+ … -
диамагнетизм (Hg2Cl2 – каломель)
3. Данные
инфракрасной спектроскопии: наличие полосы поглощения, которой нет ни у
металлической ртути, ни у двухвалентной, т.е. появление новых линий
соответствует новому соединению. Кластерные ионы способны к реакциям диспропорционирования.
Hg22+
= Hg + Hg2+
Hg2Cl2 = Hg + HgCl2
Поэтому каломель растирают с Hg и в таком виде кластерный ион устойчив.
ПР(Hg2Cl2) = 10-12
Введение SO42- и J- ионов смещают равновесие:
Hg2J2 ¯ = Hg + HgJ2 ¯
ПР = 10-24 ПР = 10-30
ПР(HgS) = 10-52
Общие свойства. Zn, Cd, Hg
1.Склонность к комплексообразованию.
2. Токсичность. Hg накапливается в организме и не
выводится, Рнасы.пара = 0,1 Па (tобычн.) Cd – также ядовит, как и ртуть, Zn – в меньшей степени.
Химические свойства металлов
1. С неметаллами:
а) с Н2
- непосредственно не реагирует.
Гидриды Cd и Hg получают косвенным путем.
б) с О2
– на воздухе Zn и Cd
- окисляются.
Zn
+ O2 + CO2 + H2O = (ZnOH)2CO3
2Zn
+ O2 = 2ZnO
2Zn
+ O2 + 2H2O = 2Zn(OH)2
Hg + O2 ¹ (обычн. tо)
т.к. р(О2) = 0,21 ат., однако
D Go (HgO)=58,5.
2Hg
+ O2 = 2HgO
р(О2)=1 – станд. условия.
2Hg + O2 2HgO , однако
HgO при высоких t неустойчив.
2HgO 2Hg + O2
в) с серой
Zn
+ S
ZnS
Cd + S
CdS
Hg
+ S = HgS – рассыпавшуюся ртуть собирают
серой.
г) с Hal
Zn + Hal2
= ZnHal2 (Cd, Hg – аналогично)
д) Взаимодействие металлов с
кислотами и щелочами происходит по общим правилам, однако Cd и Hg при обычных условиях со щелочами не реагируют,
т.к. Cd(OH)2 имеет основной
характер.
6Hg
+ 8HNO3 =
3Hg2(NO3)2 + 2NO +4H2O
Hg
+ 4HJ = H2[HgJ4] + H2
Кн
= 10-30
Hg
+ КСN
= H2[Hg(CN)4] + H2, Кн=10-19
Химические свойства соединений
|
|
ZnO |
CdO |
HgO |
Zn(OH)2
ZnO + H2O |
|
DGo |
-318 |
-226 |
-58,5 |
Cd(OH)2 CdO + H2O |
|
|
|
|
|
Hg(OH)2
HgO + H2O |
Hg(OH)2 - при обычных
условиях не существует.
Hg(NO3)2 + 2KOH = HgO + 2KNO3 + H2O
Hg2(NO3)2
+ 2KOH = HgO + Hg + 2KNO3
+ H2O
Hg2(OH)2 и HgOH -
не получены.
Однако при длительном кипячении с
концентрированными щелочами:
Cd(OH)2 + 4NaOH = Na4[Cd(OH)4]
В отсутствии избытка щелочи
разлагается.
Na4[Cd(OH)6]
= Cd(OH)2 + 4NaOH
HgO - основной характер, не реагирует
с NaOH ни при каких условиях.
У Zn и Cd соли обычные, а у Hg - ряд особенностей.
и HgCl2 - возгоняются.
HgCl2 - слабый электролит, малорастворим
в H2O
Hg2(CN)2 - неэлектролит
В солях ртути присутствует большая
доля ковалентной связи.
Псевдогалогениды (SCN- , CN- - псевдогалогенид
ионы.
4Hg(SCN)2 =
4HgO + 2CS2 + 3CN2 + N2 - "фараоновые змеи".
Сульфиды: ZnS (белый), CdS (светло-желтый или оранжевый), HgS (черный ).
ZnS + 2HCl = ZnCl2 + H2S -(Cd - аналогично с HCl(к))
HgS + HCl
HgCl2 + H2S ПР(HgS)=10-52
HgS + HJ
H2[HgJ4]
+ H2S
HgS + K2S = K2[HgS2]
HgS хорошо растворяется в HNO3 (к) и
царской водке.
HgS + 10HNO3(конц)
Hg(NO3)2 + 8NO2 + H2SO4
+4H2O
3HgS + 8HNO3 + 6HCl =
3HgCl2 + 3H2SO4 + 8NO + 4H2O Hg2S - не существует, так как диспропорционирует.
Hg2(NO3)2
+ Na2S =
Hg + HgS + 2NaNO3
Комплексные соединения
Аммиакаты Zn довольно устойчивы, а в ряду Zn, Cd, Hg устойчивость аммиакатов падает.
Zn + 4NH3 + 2H2O
= [Zn(NH3)4](OH)2
+ H2 Кн=10-8,7
Аммиакаты Hg не устойчивы. Устойчивый белый
осадок можно получить лишь при избытке NH4Cl.
HgCl2
+ 2NH3 + NH4Cl =
[Hg(NH3)2]Cl2
В отсутствии NH4Cl - амидное соединение.
HgCl2 + NH3 = H2NHg)Cl ¯ + NH4Cl
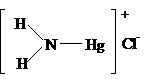
Если 2 атома Н2
заместить на атомы Hg, то получится нитрид диртути:
Hg(NO3)2 + NH3(к)
+ H2O =
(Hg2N)NO3 × H2O + 3NH4NO3
соль основания Милона
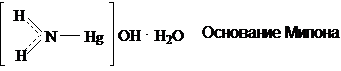
Комплексные соединения ртути дают
аналогичные соединения.
Реактив Несслера:
K2[HgJ4] + KOH
2K2[HgJ4] + NH3 + 3KOH = (Hg2N)J × H2O + 7KJ + 2H2O
Эту реакцию можно записать по
стадиям:
K2[HgJ4]
+ 2KOH = Hg(OH)2 + 4KJ
Hg(OH)2 =
HgO + H2O
2HgO + NH3 = [Hg2N]OH + H2O - основание Милона
H2O[Hg2N]OH + KJ = [H2N]J×
H2O + KOH
Окислительно-восстановительные
свойства:
Zn
и Cd имеют постоянные степени окисления
2+ и в окислительно-восстановительных реакциях не участвуют.
Hg2+, Hg22+, Hgo участвуют в
окислительно-восстановительных реакциях.
Hg2+ - сильный окислитель.
SnCl2, FeSO4, KJ, - восстановители.
HgCl2 -
восстанавливается KJ и SnCl2 до Hg. Для Hg22+
характерно диспропорционирован.