Пятнадцатая
группа Периодической системы Д.И.Менделеева- азот,
фосфор, элементы подгруппы мышьяка – мышьяк, сурьма, висмут
Общая характеристика.
Азот.
N: 1s2 2s2
p3
N-3: NH3, Mg3N2 (нитриды), NH2Na (амиды).
N+1: N2O (закись азота)
N+2: NO (окись азота)
N+3: N2O3,
HNO2,
NaNO2 (нитрит)
N+4: NO2,
N2O4
N+5: N2O5, HNO3,
NaNO3 (нитрат)
В природе он находится в свободном
состоянии (в газообразном).
Содержание азота в атмосфере = 78%.
В связанном виде: NaNO3 – чилийская селитра.
Связанный азот получается в грозовых разрядах (в
плазме):
N2
+ O2
= 2NO
Некоторые микроорганизмы способны связывать азот.
Азот – органогенный элемент.
Промышленный способ получения связанного азота –
получение аммиака (каталитический процесс).
N2
+ 3H2
= 2NH3
N2
– молекула азота – очень прочная.
Связь осуществляется за счет p – электронов.
Есв. = 941 кДж/моль (N º N).
Физические
свойства азота.
Азот – это газ без вкуса и запаха. Ткип
= - 196°С.
При нормальных условиях реагирует только с литием, при
высокой температуре может реагировать со многими металлами.
Mg + N2 = Mg3N2 (нитрид магния).
Электроотрицательность достаточно высокая: F > O > N.
В соединениях с фтором и кислородом проявляет
положительную степень окисления.
Соединения
азота.
В степени окисления: -3 – аммиак: N2
+ 3H2
« 2NH3.
В промышленности производят при: р = 30 мПа, t = 450°, катализаторы = Fe (Al2O3, K2O).
Аммиак –
газ с неприятным резким запахом, хорошо растворим в воде. Ткип
= -33°.
NH3
+ H2O = NH4OH (гидроксид
аммония)
(NH3×H2O) – гидрат аммиака – слабое основание.
Kд. = 1,8×10-5 Þ слабое основание.
В
окислительно-восстановительных реакциях является восстановителем:
NH3
+ O2
= N2
+ H2O
NH3
+ O 2 = NO + H2O ( в присутствии
катализатора)
Mg3N2
+ H2O = Mg(OH)2 + NH3
Взаимодействует с кислотами с образованием солей
аммония:
NH3
+ HCl = NH4Cl (хлорид аммония)
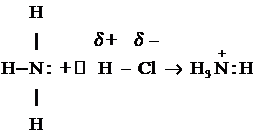
Ион аммония построен по типу донорно-акцепторной
связи. Соли аммония при нагревании разлагаются:
NH4Cl = NH3
+ HCl
NH4H2PO4 = NH3 + H3PO4
Если соль аммония, образована кислотой, в которой
кислотный остаток является окислителем, то при нагревании происходит
окислительно-восстановительная реакция:
(N-3N4)2Cr+62O7
= N2 + Cr2O3
+ 4H2O
N-3H4N+5O3
= N2O + H2O (может сопровождаться взрывом).
N-3H4N+4O2
= N02 + H2O
Аммиак с солями d-элементов может давать комплексные соединения: Ni(NO3)2 + 5NH4OH = [Ni(NH3)4]NO3 + 5H2O + NH4NO3
зелёный комплексный
аммиакат
синий
Кислородные
соединения азота.
Оксиды: N2O (безвреден), NO, N2O3,
NO2,
N2O5
(ядовиты).
N+12O: “веселящий
газ”, несолеобразующий оксид.
Получают разложением нитрата аммония
NH4NO3
= N2O + H2O
Поддерживает горение, т.к. при разложении образуется
кислород:
2N2O = 2N2 + O2
NO – несолеобразующий оксид
Получение: NH3
+ O2
® NO + H2O ,
катализатором является: Pt – Rh.
Легко окисляется кислородом воздуха:
2NO + O2
= 2NO2
В лабораторных условиях:
Cu0 + HN+5O3(разб.) = Cu+2(NO3)2 + N+2O
+ H2O
N2O3: газ, в жидком состоянии –
синяя подвижная жидкость, солеобразующий оксид.
N+2O + N+4O2
= N+32
O3
N2O3
+ H2O = HNO2 (азотистая кислота)
NO2: 2NO + O2 = 2NO2
(бурый газ)
Очень легко димеризуется:
2NO2 « N2O4
газ димер
(при Т= +22° -жидкость, при t = +110 C – твердое, бесцветное вещество)
Получение.
Cu + HNO3(конц.) = Cu(NO3)2 + NO2
+ H2О
Pb(NO3)2
= PbO + NO2
+ O2
NO2
+ H2O = HNO3 + HNO2
(смесь азотной и азотистой кислот).
NO2
+ NaOH = NaNO3
+ NaNO2 + H2O – солеобразующий оксид
N2O5: 4HNO3 + P4O10 = 2N2O5 + 4HPO3
Кристаллическое вещество, на воздухе постепенно
разлагается; сильный окислитель.
2N2O5
= 4NO2
+ O2
Практическое значение имеют: HNO2,
HNO3
и их соли (нитриты и нитраты).
Азотистая кислота не существует в свободном виде, а
только в растворе
NO + NO2 + H2O
= HNO2
Kд = 5×10-4 –
кислота средней силы (HNO2).
![]()
Структурная формула: в виде двух таутомерных
форм:
Азотистая кислота и ее соли могут выступать как
окислителями, так и восстановителями:
NaNO2 + KMnO4
+ H2SO4
= MnSO4 + NaNO3 + K2SO4 + H2O
вос-ль ок-ль
NaNO2 + KI + H2SO4 = NO + I2
+ Na2SO4 + H2O + K2SO4
ок-ль вос-ль среда
Азотная
кислота: HNO3.
Получение: NO2 + O2
+ H2O = HNO3
На свету постепенно разлагается.
HNO3
= NO2
+ O2
+ H2O (слегка окрашена из-за NO2)
HNO3(конц.) – сильный окислитель
Эта кислота будет реагировать по-разному с различными
металлами, но водород не будет выделяться:
Mg – активный металл
Mg + HNO3(разб.) = NH4NO3 + Mg(NO3)2
+ H2O
Fe – металл средней активности
Fe + HNO3(разб.) = N2O (N2) + Fe(NO3)3
+ H2O
Cu – малоактивный металл:
Cu + HN+5O3(разб.) = N+2O + Cu(NO3)2
+ H2O
HNО3 (концентрированная)
пассивирует некоторые металлы:
Al, Fe, Cr, Co, Ni,
Ti
Непассивирующиеся металлы любой
активности реагируют с азотной концентрирванной
кислотой с выделением диоксида азота
HNO3(конц.) + Zn = Zn(NO3)2 + NO2 + H2O
Нитраты хорошо растворяются в воде. Являются слабыми
окислителями.
KNO3 + Al + KOH = NH3
+ K[Al(OH)4]
Нитраты щелочных и щелочно-земельных
металлов (Ca, Mg) разлагаются до нитритов:
NaNO3 = NaNO2
+ O2
NaNO2 = Na2O
+ NO2 + O2 ( температура > t пл.)
Нитраты большинства тяжелых металлов:
Cu(NO3)2
= CuO + NO2
+ O2
AgNO3
= Ag + NO2 + O2
Применение
соединений азота.
Синтез аммиака, азотная кислота, азотные удобрения.
Азот – инертный газ (неактивный), используется для
создания инертной атмосферы.
Токсикологическое
действие.
Азот относится к элементам жизни. В организме человека
содержится до 7,2% азота.
Токсическое действие: большинство соединений обладают
токсичностью, поражают верхние дыхательные пути и глаза.
Оксид азота вызывает разложение озонового слоя:
O3
+ NO = NO2 + O2
При поражении глаз возможна слепота.
Фосфор и его
соединения.
Фосфор находится в VА группе.
Электронное строение: 1S2
2S2 P6 3S2 P3
Фосфор проявляет много степеней окисления:
-3: PH3
(фосфин); Ca3P2 (фосфид)
+1: H3PO2
(фосфорноватистая кислота), NaH2PO2
+3: PCl3
(трихлорид фосфора), H3PO3,
Na2HPO3
+5: PCl5
(пентахлорид), P2O5,
H3PO4,
Ca3(PO4)2, CaHPO4.
В природе фосфор не относится к редким элементам
(встречается в виде фосфоритов и апатитов): 9,3×10-2% - в
земной коре.
Важнейшие минералы: Ca3(PO4)2 – фосфорит, Ca3(PO4)2×CaX2
– апатит (X = OH – гидроксилапатит,X = F – фторапатит)
Содержится в организме человека: в костной ткани и в
эмали зубов (связанный фосфор).
Свободный фосфор: P4
(состоит из тетраэдров).
Фосфор имеет 11 аллотропных
модификаций.
Белый фосфор:
ядовит, при Т = 40° - возгорается, вызывая ожоги. Тпл.
= 44°.
Красный фосфор может
получиться при длительном нагревании белого фосфора без доступа воздуха » до 300° около 50 часов.
Красный фосфор не ядовит, Т воспламенения » 270° ( Р4 ).
Если при повышенном давлении и высокой температуре
нагревать красный фосфор, то получится черный фосфор – самая устойчивая модификация.
Ркр.® Рчерн. (при р = 1,2 гПа, t = 200°)
По физическим свойствам черный фосфор похож на графит
(слоистая структура).
Получение
фосфора в промышленности:
Ca3(PO4)2 + SiO2
+ C = P + CaSiO3
+ CO ( фосфор получается парообразный). Эта реакция идет
при t = 1500°. Первоначально получается белый фосфор.
Свойства
фосфора.
1). Энергично реагирует с галогенами:
Р + Br2 = PBr3
, PBr5
P + Cl2
= PCl3 , PCl5
жидк. твёрд.
2). При нагревании с активными металлами дает фосфиды:
Р + Са = Са3Р2
Активные металлы дают стехиометрические соединения, а d – элементы – нет.
3). Р + О2 = Р2+3О3
(медленное окисление на воздухе ) – Р4О6
Р + О2 = Р4О10
( в избытке кислорода)
4). Фосфор
можно окислить концентрированной азотной кислотой
Р + HNO3 (k) = H3PO4 + NO + H2O
5). Р + Н2О
= Н3РО4
+ Н2 ( при Т=700°)
6). Р + NaOH = PH3 + NaH2PO2 +H2O
Соединения фосфора.
1.
Водородные
соединения:
РН3 – фосфин – ядовитый газ с запахом тухлой рыбы, не реагирует с
водой, воспламеняется.
Са3Р2 + Н2О
= РН3 + Са(ОН)2
РН3 + HCl = PH4+Cl-
(хлорид фосфония – неустойчив).
Проявляет только восстановительные свойства:
РН3 + О2 = Р2О5
+ Н2О (Н3РО4
– фосфорная кислота).
![]()
2.
Кислородные
соединения фосфора:
P4O6
– белое кристаллическое вещество, Тпл.
= 24°, при нагревании распадается:
P4O6
= (P2O4)n + Pкр.
P4O10 – белое, гигроскопичное вещество (поглощает воду из воздуха). Ангидрид фосфорной кислоты – P2O5
3. Кислородные кислоты фосфора:
![]()
1). Гипофосфористая (фосфорноватистая) кислота: H3P+1O2
– одноосновная кислота.
Структурная формула:
Степень окисления: +1, валентность: 5.
NaH2PO2
– гипофосфит.
P + Ba(OH)2 + H2O
= Ba(H2PO2)2
+ PH3
Ba(H2PO2)2 + H2SO4 = H3PO2 + BaSO4¯
Это кислота средней силы, Kд = 8,5×10-2
Гипофосфористая кислота и ее соли – сильные
восстановители, восстанавливают даже катионы металлов.
2NaH2PO2
+ NiCl2 + H2O = Ni¯ + 2NaCl + 2H3PO3
Эта реакция лежит в основе нанесения металлических
покрытий неэлектролитическим путем на нетокопроводящие
изделия.
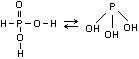
2). Фосфористая кислота: H3PO3
– двухосновная кислота. Эта кислота
средней силы, неустойчивая.
H3PO3
= H3PO4
+ PH3
(диспропорционирует при нагревании).
Na2HPO3 – фосфит (плохо
растворим в воде).
Соли и кислота могут проявлять окислительные свойства
в реакциях с активными металлами, а обычно – восстановители.
H3PO3
+ Na ® PH3 + NaOH
3). Ортофосфорная кислота, метафосфорная кислота,
пирофосфорная кислота.
H3PO4, (HPO3)n, H4P2O7
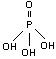
Ортофосфорная кислота (фосфорная): твердое вещество, Тпл. = 42°
Ca3(PO4)2 + H2SO4(конц.) ® H3PO4
+ CaSO4
это трехосновная
кислота средней силы
NaH2PO4
– дигидрофосфат, рH = 4
NaHPO4
– гидрофосфат, рH = 8
Na3PO4
– фосфат, рH = 11
Ее соли подвергаются гидролизу:
PO43- + H2O « HPO42- + OH-
H2PO4 - « H+ + HPO4 2-
HPO42- « H+ + PO4 3-
HPO42- + H2O « H2PO4- + OH-
При нагревании кислые соли ведут
себя по-разному:
NaH2PO4
= NaPO3 + H2O
Na2HPO4
= Na4P2O7
+ H2O (пирофосфат)
Фосфаты щелочных металлов – устойчивы.
(NH4)3
PO4 = 3NH3 + H3PO4
P2O5
+ 3H2O = 2H3PO4
P2O5
+ H3PO4
® (HPO3)n – полиметафосфорная кислота (n >3).
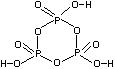
Может иметь циклическое строение (n=3). Транспортируют в виде полифосфорных кислот.
H3PO4
® H4P2O7
® (HPO3)n
200° 300°
Качественные реакции на фосфорные кислоты.
1. AgNO3
H3PO4
+ AgNO3 = Ag3PO4¯ + 3 HNO3
желт.
H4P2O7 + AgNO3
= Ag4P2O7¯ + HNO3
бел.
HPO3 + AgNO3
= AgPO3¯ + HNO3
бел.
Далее их различают по взаимодействию с белком:
HPO3
– свертывает белок
H3PO4,
H4P2O7
– не свертывают белок
Аналитическая
реакция на фосфат – анион: РО43-
21HNO3 + H3PO4 + 12(NH4)2MoO4
=
(NH4)3PMo12O40×6H2O + 21NH4NO3 + 6H2O
желт.
Применение.
Элементарный фосфор используется для получения
фосфорного ангидрида, фосфорной кислоты и в органическом синтезе. Важное применение
– фосфорное удобрение (фосфорит переводят в растворимую форму).
Ca3(PO4)2 + H2SO4
= Ca(H2PO4)2
+ CaSO4
суперфосфат
Фосфорная кислота используется для нанесения
антикоррозионных покрытий.
Токсикологическое действие.
Фосфор относится к элементам жизни: в мышечной ткани:
0,3 – 0,8%,
в костной ткани: 6 – 7%
В организме взрослого человека: до 780 г фосфора.
Ежедневный прием с пищей: 900 – 2000 мг.
Фосфор входит в состав ДНК, АТФ и АДФ.
Белый фосфор – сильнодействующий яд, летальная доза – 60мг., приводит
к выпадению зубов. Растворим в жировых тканях.
Фосфин – ядовитый газ с сильным запахом. Действует на
нервную систему. 0,1 мг/м3 – вызывает рвоту, обморок и смерть. Хроническое отравление
приводит к ухудшению зрения.
Оксиды,
галогениды фосфора – вызывают ожоги и
поражение слизистой оболочки.
Фосфаты
металлов – наиболее безопасное
соединение для человека.