Семнадцатая
группа Периодической системы Д.И.Менделеева-галогены
– фтор, хлор, бром, йод, астат.
Общая характеристика.
199F
1s22s2p5
35,517Cl
1s22s2p63s2p5
8035Br
1s22s2p63s2p64s23d104p5
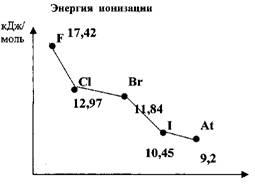
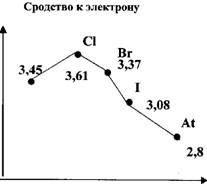
1. Способность к присоединению
одного электрона, следствием этого является ярко выраженные неметаллические
свойства.
2. Способность к
образованию ковалентной связи.
3. Степени
окисления: у всех галогенов кроме фтора -1, 0, +1, +3, +5, +7;
у фтора -1, 0.
Особенности
строения фтора.
Минимальный радиус атома, нет d – подуровня.
1. Отсутствие на внешнем энергетическом уровне свободных d – орбиталей.
2. Различие в энергии s - и p – орбиталей у фтора гораздо больше, чем у всех остальных.
3. Число валентных электронов равно 1( у
остальных 7)
4. Различное число электронов на предвнешнем
уровне. У фтора оно равно 2; у хлора – 8; у брома – 18.
5. Аналогия между F- и H- ионами.
6. Аналогия между F-,OH-, O2-
Состояние зависит от энергии межмолекулярных связей (Ван-дер-Ваальсовы силы). Чем больше радиус, тем выше
энергия взаимодействия.
Растворимость:
Хорошо растворяются в углеводородах, бензоле, CCl4.
Химические
свойства.
|
|
Фтор |
Хлор,
бром, йод |
|
Водород,
H2 |
Реагирует
со взрывом (в темноте при 2000С), образуется
HF |
Cl2
реагирует со взрывом на свету; Br2 – при t > 2000C (катализатор Pt+); I2 при t > 2000C равновесие смещено влево |
|
Кислород,
O2 |
OnF2 (где n от 0 до 6) |
Не
реагируют |
|
Сера,
S |
SFn (где n от 0 до 6) |
Cl2
образует соединения:S2Cl2, SCl2, SCl4; Br2: S2Br2 I2 не
реагирует |
|
Азот,
N2 |
Не
реагирует |
Не
реагирует |
|
P |
PF3, PF5 |
PГ3 – образуют все, РГ5
– кроме I2 |
|
Инертные
газы: He, Ne, Ar, Kr, Xe |
Не
взаимодействуют ЭFn (n = 2, 4, 6) |
Не
взаимодействуют Не
взаимодействуют |
|
Металлы |
загораются |
При
нагревании |
Закономерности
в химических свойствах
Химическая активность падает от F2 к I2
Характер связи
Hal–Me – ионный, Hal–Hal –
ковалентный
Энергия( прочность) связи :
наибольшая у элемента – фтора, при взаимодействии со F многие элементы
проявляют высшие степени окисления.
Высокая реакционная способность:
1) Низкая энергия диссоциации молекул Eсв = 155КДж/моль
2) Высокая энергия связи Э–F Есв =
200 – 600 КДж/моль, следовательно более высокая DH
3) Обычно низкая энергия активации реакции фторирования
Особенности
химических свойств фтора.
S +3F2 = SF6 ; DH = -1207 кДж
5F2 + 2P = 2PF5 ; DH = - 3200 кДж
2F2 + 2H2O = 4HF + O2
2F2 +
SiO2 Û SiF4 +
O2
F2 +
2NaOH Û 2NaF + OF2
+ H2O
F2 +
2KHSO4 Û 2HF + K2S2O8
(персульфат калия)
Химические свойства Cl2, Br2, I2.
2P + 5Cl2
= 2PCl5 (+ PCl3)
2P + 3Br2
= 2PBr3 (+ PBr5)
2P + 3I2 = 2PI3
2Al + 3Br2
= 2AlBr3
2Al + 3I2 = 2AlI3
H2 + Cl2 = 2HCl
Пример
цепных реакций с неразветвленной цепью
1.
Зарождение цепи
Сl2 ® Cl* + Cl* (активные центры)
2.
Рост(развитие цепи)
Сl* + H2 = HCl + H*
H* + Cl2 = HCl + Cl*
Cl* + H2 = HCl + H*
3.
Обрыв цепи
(концентрация H2 и Cl2 очень
мала, и возрастает вероятность столкновения H* и
Cl*)
H* + Cl* = HCl
H* + H* = H2
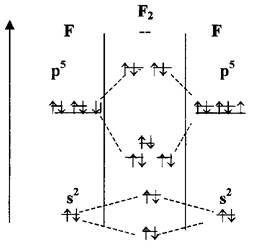
Особенности строения.
Молекулы линейные, порядок связи равен 1.
Молекулы диамагнитны
Энергия связи от HF к HI уменьшается
(разность между Еат и Еион)
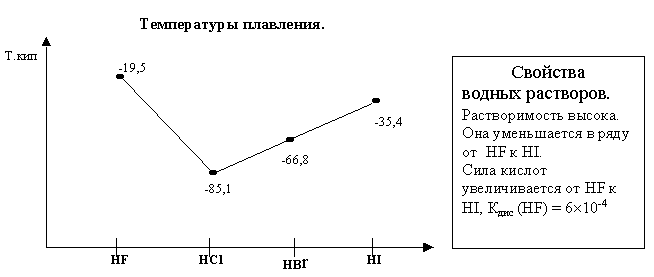
Дипольный момент от HF к HI уменьшается.
Восстановительные
свойства
|
2Г- + 2е-
Û Г2 |
F |
Cl |
Br |
I |
|
E, B |
+2,83 |
+1,36 |
+1,06 |
+0,536 |
HI – лучший
восстановитель.
KCl + H2SO4(К)= HCl
+ KHSO4
KBr + H2SO4(К) = Br2 + SO2
+ KHSO4 + H2O
KI + H2SO4(К) = I2 + H2S
+ KHSO4 + H2O
Взаимодействие
галогенов с водой
В общем случае можно выделить 3 стадии:
1. Растворение и гидратация
Г2 + nH2O ® Г2(р-р)nH2O
Из опытных данный следует,
что при низких температурах гидраты можно выделить, они представляют собой
соединения включения молекул галогенов в пустоты решетки воды. Такие соединения
называются клатраты, например: 8Cl2´46H2O.
2. Гидролитическое расщепление молекул галогенов
Г2 + H2O ® ½ O2 + 2Г- + H+
Г2 +
2е- ® 2Г- E0 в
зависимости от Г( cм выше)
H2O – 2e- ® ½ O2 + 2H+ E0=1,23 при pH=7
По этой схеме может идти только процесс со фтором (в случае Cl следует учитывать перенапряжение в выделении O2)
Cl2 + H2O
= HCl + HOCl
Реакция обратимая
HCl + Na2CO3 = NaCl + CO2
3. Термическое разложение (например HOCl)
Скорость разложения зависит от температуры и как правило увеличивается от Cl к I.
Кроме того распад может протекать по разным схемам.
|
Процесс |
Кравн |
||
|
Cl |
Br
|
I
|
|
|
Г2 (газ) +
nH2O Û Г2 ´ nH2O Г2 (Р-Р) +Н2OÛГ- +H++ ГОН (в кислой среде) 3ГО- ÛГ- + ГО3- (в щелочной среде) 2НОГ Û Г- + Н+ + НГО2 4ГО3- Û Г- + 3ГО4- |
0,06 4´10-9 1027 10-5 1029 |
0,21 7´10-9 1015 кисл. не сущ. кисл. не сущ. |
0,0013 2´10-13 1020 кисл. не сущ. 10-53 |
Кислородные соединения галогенов.
|
OnF2 (n от 1 до 6) |
Сl2O ClO2 [Cl2O3] Cl2O4 Cl2O6 Cl2O7 |
Br2O Br2O5 [BrO3] [BrO2] |
I2O4 (IO+IO3-) I2O5 |
|
Не сущ. |
HClO HClO2 HClO3 HClO4 |
HOBr |
HOI H5IO6 |
Названия кислородсодержащих кислот и солей хлора.
|
HClO HClO2 HClO3 HClO4 |
Хлорноватистая Хлористая Хлорноватая Хлорная |
Гипохлориты Хлориты Хлораты Перхлораты |
Свойства оксокислот.
С увеличением степени окисления устойчивость
увеличивается, а окислительная способность уменьшается. Кислоты – наиболее
сильные окислители, чем анионы соответствующих солей.
Сила кислот.
Константы диссоциации
|
Кислота |
РК = -lgКдисс |
||
|
Сl |
Br |
I |
|
|
НГО НГО2 НГО3 НГО4 Н5ГО6 |
7,25 2 0 -10 - |
8 - 0,7 - - |
- - 0,8 - 3,2 |
Окислительно-восстановительные свойства галогенов и их
соединений.
|
Процесс |
Е0, В |
||
|
Cl |
Br |
I |
|
|
H++HOГ+е-®1/2Г2+Н2О 3Н++НГО2+3е-®1/2Г2+Н2О 6Н+ + ГО3-+ 5е-®1/2Г2+Н2О ГО- + Н2О
+ 2е- ®Г- + 2ОН- ГО2- + 2Н2О + 4е-® Г- + 4ОН- ГО3- + 3Н2О + 6е-®Г-+ 6ОН- ГО4- + 4Н2О + 8е-®Г-+ 8ОН- |
pH = 0 |
||
|
1,63 1,64 1,47 |
1,59 - 1,52 |
1,45 - 1,20 |
|
|
pH = 14 |
|||
|
0,89 0,78 0,63 0,56 |
0,76 - 0,61 0,69 |
0,49 - 0,26 0,39 |
|
Межгалоидные соединения.
1. Гомоядерные соединения (одинаковые атомы)
Растворимость I2 в воде
0,3 г/л, а в растворе KI I2 хорошо
растворим.
I2 + I- Û I3-(I5-)
Кроме отрицательно заряженных известны и положительно
заряженные гомокомплексы иода.
2. Гетероядерные соединения (состоящие из атомов разных элементов)
|
|
Cl |
Br |
I |
|
Фториды |
ClF ClF3 ClF5 |
BrF BrF3 BrF5 |
IF IF3 IF5 IF7 |
|
Хлориды |
|
BrCl |
ICl ICl3 |
|
Бромиды |
|
|
IBr |
Все межгалоидные соединения
представляют собой либо газы, либо легкокипящие жидкости.
Некоторые общие закономерности
1.
Чем выше электроотрицательность Hal, тем больше межгалоидных соединений.
2.
Устойчивость
возрастает при переходе сверху вниз.
Химические свойства.
Водой разрушаются, полностью
гидролизуясь, но как правило
с горячей и холодной водой процессы идут по- разному.
Моногалоидные соединения.
СlF +H2O Û HF +HClO ClF + NaOH(хол) Û NaClO + NaF + H2O
ICl + H2O Û HCl + I2 + HIO3 ClF + NaOH(гор) Û NaCl + NaF + NaClO3 +H2O
Тригалоидные соединения
СlF3 +H2O(хол) Û HF +HСlO2
ClF3 + H2O(гор) Û HCl + HF+ HClO3
ClF3 + NaOH(гор) Û NaCl + NaF + NaClO3 +H2O
Пентагалоидные соединения
ClF5 + H2O Û HF + HClO3
ClF5 + NaOH Û NaF + NaClO3
+H2O
Гептафторид иода.
IF7 + H2O
Û HF + H2IO6
IF7 + NaOH Û NaF + Na3H2IO6