Классификация
химических методов анализа. Обнаружение, идентификация, определение.
Химические
методы анализа.
Качественный
химический анализ.
Классификация реакции в качественном анализе.
По
области применения:
а)
Групповые (применяются групповые
реагенты) реакции идущие с определенной группой
элементов или веществ.
Применяются:
1)Для обнаружения присутствия элементов определенной
аналитической группы;
2)В систематическом ходе анализа для полного отделения
аналитической группы от других групп;
3)Для концентрирования групп веществ;
4)Для отделения групп веществ мешающих обнаружению
искомых соединений.
б)
Характерные реакции различают по
селективности
1).
Селективные (избирательные) – для
открытия ограниченного числа ионов (веществ) (2-5) – дают с ними одинаковые или
сходные аналитическое реакции;
2).
Специфичные –
высокоселективные – для открытия 1 компонента.
Избирательность
реакций может быть повышена путем применения приемов маскирования, регулирования
условий проведения (рН, температуры), выделения и
разделения обнаруживаемых компонентов.
Важной
характеристикой аналитических реакций, применяемых для обнаружения веществ является
предел обнаружения – наименьшее
содержание, которое сложно обнаружить в присутствии определяемого компонента с
заданной доверительной вероятностью.
Основные принципы качественного анализа.
Селективных
и специфичных реакций известно немного, поэтому на практике применяют специальные
приемы устранения мешающего влияния компонентов, присутствующих в системе
наряду с интересующими веществами.
Устранить
помехи можно двумя основными способами:
1).
Разделить систему на составные части (подсистемы) и исследовать затем каждую в
отдельности (обычно осуществляется делением на фазы).
2).
Подавлением мешающего влияния внутри анализируемой системы (маскирование).
В соответствии с этим различают систематический и
дробный анализ. Выбор того или иного определяется задачей анализа. Систематическим называют полный анализ
исследуемого объекта, осуществляемый путем разделения исходной системы (пробы)
на несколько групп в определенной последовательности на основе сходства и
различий их аналитических свойств. Аналитические группы разделяют
переводя их в различные фазы. Анализ выделенной группы заключается в том, что
последовательно проводят реакции разделения до тех пор, пока в одной фазе останутся
лишь компоненты, которые можно однозначно идентифицировать характерными реакциями
со специфическими реагентами.
В настоящее время используют несколько схем
систематического анализа. Классическим методом анализа катионов является сероводородный (сульфидный).
Деление катионов на группы по
сероводородному методу.
|
Группы |
1 |
2 |
3 |
4 |
5 |
|
Катионы |
Na+ K+ Mg2+ NH+4 |
Ca2+ Sr2+ Ba2+ |
Al3+, Fe2+ Fe3+, Cr3+ Zn 2+, Ni2+ Co2+, Mn2+ |
Pb2+, Ag+ Hg2+2, Cu2+, Cd2+, Bi3+ |
Sn2+, Sn4+ As3+, As5+ Hg2+, Sb3+, Sb5+ |
|
Групповой реагент |
– |
(NH4)2CO3 |
(NH4)2S |
H2S+ HCl |
Na2S |
Сущность
дробного анализа заключается в
проведении избирательных реакций на отдельные (обнаруживаемые) компоненты в
отдельных порциях анализируемой системы (пробы).
Преимущества
дробного анализа перед систематическим
являются:
1.
Искомые вещества можно обнаруживать в любой последовательности.
2.
Быстрота выполнения (часто отсутствуют операции фильтрования, центрифугирования,
промывания осадков, необходимые в систематическом анализе).
3.Небольшие
объемы пробы.
Недостатки
дробного анализа:
1.
Применяется для обнаружения ограниченного (заданного) числа компонентов. 2. Не
дает полной картины присутствия веществ в пробе.
3.
Требуется большое число специфичных, дефицитных реагентов.
Одним
из разновидностей дробного анализа является капельный анализ (Тананаев, Файгль). Он заключается в выполнении аналитических качественных
реакций на фильтровальной бумаге, пластинках из стекла и фарфора в объеме 2-3
капель. Образование пятна на бумаге - результат сложного взаимодействия капиллярного
распределения, диффузии, разбухания, адсорбции и химического взаимодействия. Капилярный анализ – это разновидность бумажной хроматографии.
Химические
методы анализа связаны с превращением
исследуемого вещества в другое соединение, обладающее такими свойствами, с
помощью которых можно установить соединение или определить его количество.
Химический процесс получения нового соединения называется аналитической реакцией, а вещество вызывающее аналитическую
реакцию – реагентом. В
аналитических реакциях происходят видимые или доступные для регистрации
изменения: появляется окраска, выпадает осадок, выделяется
газообразный продут, образуются кристаллы характерной формы. Характерной
особенностью аналитических реакций служит достаточная селективность - это качество, характеризующее возможность надежного
качественного или количественного определения в присутствии других компонентов,
составляющих анализируемую систему.
Аналогично под аналитическим
процессом следует понимать процесс взаимодействия анализируемого вещества
с внешним источником возбуждения (по отношению к веществу). При этом происходит
выделение характеристических квантов энергии и соответствующих им аналитических сигналов –
корпускулярных потоков молекул, ионов, электронов, протонов, нейтронов, а также
электромагнитное излучение всех доступных диапазонов частот и электрические,
магнитные, гравитационные поля.
Способы измерения количества образующегося вещества
при анализе всегда являются физическими. Например, в титрометрическом
анализе измеряют объемы газов или растворов, в гравиметрическом анализе – массу
вещества.
Макро-, микро, полумикро-методы
химического анализа.
В зависимости от количества исследуемого вещества,
объема взятого раствора и техники выполнения отдельных операций различают макро-, микро, полумикро-, субмикро-,
ультраметоды химического анализа. При макро-методе используют 20-30 мл
раствора, содержащего 1-10 г исследуемого вещества. Отдельные реакции выполняют
в обычных пробирках, химических стаканах или колбах; образующиеся осадки
отделяют фильтрованием через бумажные или пористые фильтры. Для проведения микроанализа необходимо в 103-107
раз меньше исследуемого вещества, чем при макро-анализе. Применяемая посуда
имеет небольшие размеры. Количественное определение веществ осуществляют о
помощью инструментальных методов, а отдельные реакции выполняют капельным или микрокристаллическим способами. Реакции в
капельном методе выполняют на полосках фильтровальной бумаги или на стекле.
Основоположниками микрокристаллического анализа являются русские ученые
М.В.Ломоносов и Т.Е.Ловиц.
В полумикро-анализе используют
1-10 мл раствора, содержащего 50-500 мг исследуемого вещества. Реакции
выполняют в маленьких конических пробирках, емкостью 2-4 мл. Для отделения
осадка от жидкости используют центрифугирование. Анализ микро, полумикрометодов имеет ряд преимуществ. Расход реагентов
уменьшается во много раз. Воздух лабораторного помещения не так сильно загрязняется
вредными газами и парами.
В последнее время все большее распространение получает
ультрамикрометод Хан, позволяющий работать с еще
меньшими количествами анализируемых веществ.
Названия диапазонов рабочих количеств веществ, г, мл
|
Названия |
Рабочие количества г/мл |
|
|
Макроколичества |
>0,5 |
>10 |
|
Полумикроколичества |
0,05-0,5 |
1-10 |
|
Микроколичества |
10-3-10-5 |
10-1-10-4 |
|
Наноколичества |
10-5-10-8 |
<10-4 |
Анализ можно выполнять также сухим и мокрым путем.
Некоторые
понятия АХ.
Диапазон
определяемых концентраций, как
критерий оценки содержания в образце анализируемого компонента: ∆С = mx /(mx
+ my), (1.1)
где mx-масса анализируемого компонента,
основа, матрица, 1-100%; my – масса
побочных компонентов, примеси. При mx
= 0,1-1% - вещество представляет собой примеси; при mx
< 0,01% - следы.
Чувствительность
или коэффициент чувствительности
характеризуют первой производной аналитического сигнала (измеряемого параметра)
по концентрации определяемого компонента. Если между измеряемым параметром ау
и концентрацией Сх существует
линейная зависимость ау = k Сх + в, . . . (1.2), то коэффициент
чувствительности «k» равен тангенс углу наклона градировочной
прямой.
Если градуировочный график
линеен, то «k» – постоянная величина. Линейность
графика сохраняется обычно при ограниченном диапазоне концентраций.Точность анализа. В качестве меры точности Хан используют коэффициент вариации или стандартное
относительное отклонение. Коэффициент вариации рассчитывается по формуле
(КВ):
КВ = 100.S/Хс, (1.4), где S - стандартное
отклонение![]()
S=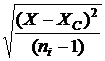 , (1.5), ni –
число параллельных определений; Хс –
среднее значение определяемой величины Х.
, (1.5), ni –
число параллельных определений; Хс –
среднее значение определяемой величины Х.
Аналитическая
возможность метода характеризует
эффективность определенного метода. Надежность
метода определяется близкими значениями результатов параллельных измерений.
Все вышеперечисленные особенности анализа в значительной мере определяются
количеством вещества (пробы), взятого для анализа и содержанием анализируемого
компонента в нем (ней).